柴胡皂苷D对阿霉素治疗小鼠肝癌的靶向导引作用
许严伟,耿胜男,王梦琪,杜钢军*
1.郑州工业应用技术学院,河南 郑州 451150
2.洛阳市第三人民医院,河南 洛阳 471000
3.河南大学药学院,河南 开封 475000
肝癌是人类疾病死亡的重要原因之一,虽然近年来肝癌诊疗水平在不断提高,但多数肝癌患者临床确诊时已进入中晚期,肿瘤组织对药物治疗的敏感性差异较大,临床治疗效果不理想[1]。肿瘤靶向治疗主要是利用癌细胞特性或致癌基因设计的药物对肿瘤细胞进行特异性打击和杀伤,然而,肿瘤细胞快速突变一直是传统化疗药物和肿瘤新靶向治疗药物难以长期有效的主要障碍[2]。传统中医药治疗肿瘤与现代医学强调杀死肿瘤细胞的理念不同,主要是瓦解肿瘤周边支持肿瘤发生发展的微环境,从而使肿瘤失去生长的“土壤”,逐渐停止增殖,在延长肿瘤患者生存期和提高生存质量方面有独特优势[3]。
柴胡Bupleuri Radix在我国作为传统中药材,已有2000 多年药用历史,很早就已认识到其引药入肝的特性,现代研究证明柴胡对拉米呋啶等药物治疗肝病具有引经报使的作用[4]。柴胡皂苷是柴胡中主要的药理活性成分,其中柴胡皂苷 D(saikosaponin D)是控制柴胡药材及其制剂质量的重要指标,也是柴胡多种功效的物质基础[5]。本研究观察柴胡皂苷D对阿霉素治疗小鼠肝癌的靶向导引作用,并探究其可能的靶向导引机制。
1 材料
1.1 细胞
小鼠肝癌H22细胞,购于上海细胞研究所,本实验室传代保存。
1.2 动物
SPF 级昆明种雌性小鼠,体质量(20±2)g,购自北京微通利华试验动物有限公司,实验动物许可证号:SCXK(京)20090002,动物饲料合格证号:41000100003159。光照/黑暗(12 h/12 h)、温度(23±3)℃饲养于河南大学实验动物中心,自由饮食及饮水。动物使用经河南大学动物实验伦理委员会批准(许可号为HUSAM2016-288),严格遵守动物保护协会规定。
1.3 药品和试剂
柴胡皂苷D(质量分数>98%,湖北万得化工有限公司);RPMI1640 培养基(美国Gibco-BRL 公司);羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)、噻唑蓝(methyl thiazolyl tetrazolium,MTT),美国Sigma 公司;吖啶橙(acridine orange,AO,北京索莱宝科技有限公司);2′,7′-二 氯 荧 光 黄 双 乙 酸 盐( 2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)、Mito-Tracker Green 探针(碧云天生物技术公司);胎牛血清(杭州四季青生物工程材料研究所);抗小鼠有机阴离子转运多肽(organic aniontransporting polypeptide 1B1,Oatp1b1)抗体、抗小鼠β-actin 抗体、FITC标记的羊抗兔二抗(武汉三鹰生物技术有限公司);ECL 发光液、RIPA 裂解液、PVDF 膜、甘氨酸(北京索莱宝科技有限公司);小鼠转化生长因子-β1(transforming growth factor-β1,TGF-β1)ELISA 试剂盒、小鼠前胶原蛋白I(procollagen I,PCol-I)ELISA 试剂盒、胶原蛋白IV(collagen IV,Col-IV)ELISA 试剂盒、小鼠层黏连蛋白(laminin,LN)ELISA 试剂盒、小鼠透明质酸(hyaluronic acid,HA)ELISA 试剂盒(R&D Systems 公司);免疫组化试剂盒(Histostain-Plus,上海麦约尔生物科技有限公司);RIPA(强)细胞裂解液(上海碧云天生物技术研究所产品);BCA 蛋白定量试剂盒(北京赛驰生物科技有限公司)。
1.4 仪器
TU-1901 双光束紫外可见光分光光度计(北京普析通用仪器有限责任公司);LGR16-W 型高速冷冻离心机(北京京立离心机有限公司);ELX-800UV型酶标仪(美国BIO-IEK 公司);LDZX-75KBS 型立式压力蒸汽灭菌器(上海申安医疗器械有限公司);二氧化碳细胞培养箱(Thermo Fisher Scientific公司);BX43显微图像分析仪(日本Olympus公司);IX53 型倒置显微镜(日本Olympus 公司);M4 激光全息细胞成像及分析系统(瑞典Phiab 公司)。
2 方法
2.1 细胞增殖和摄取阿霉素的检测
取对数生长期的H22细胞,以5×104/mL 接种于96 孔板,100 μL/孔,每组设6 个平行孔。细胞于含10%胎牛血清的RPMI 1640 培养基中,5%CO2、37 ℃培养箱内培养24 h 后,分别单独添加含不同质量浓度(0.5、1、2、4、8、16 μg/mL)的柴胡皂苷D 或阿霉素以及阿霉素(0.5、1、2、4、8、16 μg/mL)联合柴胡皂苷D(2、4、8、16 μg/mL)的同一培养基,每孔100 μL,继续培养48 h。同时设置对照组(添加空白培养基)。吸弃培养基,每孔加含MTT 0.5 mg/mL 的PBS(pH 6.8)100 μL,培养4 h 后弃上清液,每孔加入二甲基亚砜100 μL,振摇5 min,用多功能酶标仪570 nm 测定各孔吸光度(A)。计算细胞增殖率、生长抑制率以及阿霉素对H22细胞的半数抑制浓度(median inhibitory concentration,IC50)。IC50根据药物浓度-生长抑制率半对数曲线采用GraphPad Prism 8 计算获得生长抑制率50%对应的药物浓度。
细胞增殖率=给药组A值/对照组A值
生长抑制率=(对照组A值-给药组A值)/对照组A值
对于细胞摄取阿霉素的检测,细胞于含10%胎牛血清的RPMI 1640 培养基中,5% CO2、37 ℃培养箱内培养24 h 后,添加含不同质量浓度柴胡皂苷D(0、2、4、8 μg/mL)和阿霉素(1 μg/mL)的同一培养基,每孔100 μL,继续培养24 h。吸取培养基,5000 r/min 离心20 min,取上清用荧光分光光度仪测定A(激发波长485 nm、发射波长590 nm),计算阿霉素含量(以与无柴胡皂苷D 干预的上清A的比值表示)。
阿霉素摄取=1-阿霉素含量
2.2 激光全息检测细胞大小
取对数生长期H22细胞,调整细胞悬液浓度,加入6 孔板中3 mL,使每孔细胞数为1×106个。分别单独加入终质量浓度为2、4、8 μg/mL 的柴胡皂苷D 或阿霉素(1 μg/mL)及阿霉素(1 μg/mL)联合柴胡皂苷D(2、4、8 μg/mL),同时设置未经药物处理的对照组。于37 ℃、5% CO2培养箱内培养48 h,用激光全息细胞系统分析细胞大小。
2.3 AO 染色法检测细胞自噬
取对数生长期H22细胞,调整细胞悬液浓度,在48 孔板中加入细胞使待测细胞数为1×105/孔,分别单独加入终质量浓度为2、4、8 μg/mL 的柴胡皂苷D 或阿霉素(1 μg/mL)及阿霉素(1 μg/mL)联合柴胡皂苷D(2、4、8 μg/mL),同时设置未经药物处理的对照组,每组设3 个复孔,各组均用2%血清诱导自噬,37 ℃培养24 h 后,弃去培养基,PBS 洗2 遍。每孔加入100 μL 含AO(10 μg/mL)染色液,37 ℃避光孵育30 min,倒置荧光显微镜观察并拍照。用Image-pro Plus 5.0 图像分析系统对橙红色信号积分光密度(integral optical density,IOD)值进行分析,以累积IOD 代表细胞自噬水平。
2.4 DCFH-DA 检测细胞ROS 水平
取对数生长期H22细胞,调整细胞悬液浓度,在48 孔板中加入细胞使待测细胞数为1×105/孔,分别单独加入终质量浓度为2、4、8 μg/mL 的柴胡皂苷D或阿霉素(1 μg/mL)及阿霉素(1 μg/mL)联合柴胡皂苷D(2、4、8 μg/mL),同时设置未经药物处理的对照组,每组设3 个复孔。37 ℃培养48 h 后,弃去培养基,每孔加入终浓度为10 μmol/L DCFH-DA 1 mL,37 ℃避光孵育20 min,荧光分光光度计测定ROS 含量。
2.5 Mito-Tracker Green 检测细胞线粒体功能
取对数生长期H22细胞,调整细胞悬液浓度,在48 孔板中加入细胞使待测细胞数为1×104/孔,分别单独加入终质量浓度为2、4、8 μg/mL 的柴胡皂苷D 或阿霉素(1 μg/mL)及阿霉素(1 μg/mL)联合柴胡皂苷D(2、4、8 μg/mL),同时设置未经药物处理的对照组,每组设3 个复孔,37 ℃培养48 h,弃去培养基,每孔加入终浓度为50 nmol/L Mito-Tracker Green,37 ℃避光孵育1 h,倒置荧光显微镜观察并拍照。用Image-pro Plus 5.0 图像分析系统对荧光信号IOD 值进行分析,以累积IOD 代表细胞线粒体功能。
2.6 Western blotting 印迹法检测细胞摄取体Oatp1b1 蛋白的表达
取对数生长期H22细胞,调整细胞悬液浓度,在6 孔板中加入3 mL,使每孔细胞数为1×106个。分别单独加入终质量浓度为2、4、8 μg/mL 的柴胡皂苷D 或阿霉素(1 μg/mL)及阿霉素(1 μg/mL)联合柴胡皂苷D(2、4、8 μg/mL),同时设置未经药物处理的对照组。于37 ℃、5% CO2培养箱内培养48 h,收集细胞,提取细胞膜蛋白,蛋白含量测定后与Lodding buffer 按1∶4 混匀,煮沸10 min,冷却至室温后上样到12%的聚丙烯酰胺凝胶电泳,根据蛋白Marker 相对分子质量切割Oatp1b1 蛋白胶带,经转膜、抗原封闭、与一抗孵育及与二抗孵育后加入ECL 发光液(A 与B 比例1∶1),凝胶成像系统显影拍照并定量蛋白条带相对灰度值。
2.7 肝癌H22 实体瘤小鼠模型制备、分组及给药
取腹水型肝癌H22小鼠腹水,调细胞数5×105/mL,以0.2 mL/只接种小鼠右侧腋部皮下建立小鼠肝癌实体瘤模型。将110 只模型小鼠随即分成4组,分别为模型组(25 只)、阿霉素组(30 只)、柴胡皂苷D 组(25 只)、阿霉素+柴胡皂苷D 联合组(30 只)。肿瘤接种后次日给药,对照组ig 0.5%的CMC-Na 0.2 mL/10 g,每日1 次;阿霉素组尾iv给予阿霉素8 mg/kg,每周1 次;柴胡皂苷D 组ig柴胡皂苷D(0.5% CMC-Na 混悬)20 mg/kg(根据药效学预试验结果得到的最佳剂量),每日1 次;阿霉素+柴胡皂苷D联合组给予阿霉素和柴胡皂苷D,给药途径和剂量同相应单一药物组。治疗时间为3 周。治疗期间各组每日监测小鼠体质量1 次。第22 天,阿霉素组和联合给药组分别随机取5 只小鼠用于检测瘤组织对阿霉素的摄取情况;每组取5 只小鼠用于检测瘤组织的血管通透性;另每组颈椎脱臼处死小鼠10 只,剥离肿瘤,称瘤质量,取瘤组织制备组织匀浆,检测TGF-β1 水平和细胞外基质分泌水平;每组剩余10 只小鼠观察90 d 内的小鼠存活情况。
肿瘤体积=长径×宽径2/2
2.8 瘤组织对阿霉素摄取检测
阿霉素组和联合给药组小鼠尾iv阿霉素30 min后颈椎脱臼处死小鼠,剥离肿瘤,称质量后按组织质量与PBS 容积比1∶5 研磨成组织匀浆,5000 r/min 离心20 min。组织沉淀按原始组织质量与酸性乙醇溶液(0.3 mol/L 盐酸-无水乙醇比例3∶7)容积比1∶3 混匀震荡24 h,5000 r/min 离心20 min取上清,荧光分光光度仪(激发波长485 nm、发射波长590 nm)测定A,计算阿霉素含量,结果以每克瘤组织中阿霉素的含量表示阿霉素摄取情况。
2.9 瘤组织TGF-β1 和细胞外基质分泌检测
称取各组肿瘤组织,按组织质量与PBS 容积比1∶5 研磨成组织匀浆,5000 r/min 离心20 min 取上清,按ELISA 试剂盒说明书操作,测定TGF-β1、PCol-I、Col-IV、LN 和HA 的含量。
2.10 瘤组织血管通透性检测
各组肝癌H22实体瘤小鼠尾iv 伊文斯兰50 mg/kg 30 min 后颈椎脱臼处死,剥离肿瘤,称质量后按组织质量与PBS 容积比1∶5 研磨成组织匀浆,再按组织匀浆容积与25%的甲酰胺容积比1∶4 混匀震荡24 h,5000 r/min 离心20 min 取上清,紫外分光光度仪620 nm 处测定A,按伊文斯兰标准线计算伊文斯兰组织含量,结果以每克瘤组织中的伊文斯兰含量表示血管通透性。
2.11 统计方法
采用GraphPad Prism 8 软件分析,计量数据以±s表示,组间比较采用t检验;生存时间采用Kaplan-Meier 存活分析,P<0.05 表示有显著性差异。
3 结果
3.1 柴胡皂苷D 对H22细胞活性及阿霉素抑制细胞增殖的影响
与对照组(未经药物处理)比较,阿霉素呈剂量相关性抑制H22细胞生长,0.5~16 μg/mL 柴胡皂苷D 不影响H22肝癌细胞增殖(图1-A),但能增强阿霉素的细胞增殖抑制作用(图1-B、C),促进细胞摄取阿霉素(图1-D),增加H22细胞体积(图2),阻止阿霉素诱导的细胞变小,柴胡皂苷D 质量浓度8 μg/mL 作用最佳。
3.2 柴胡皂苷D 对H22 细胞ROS 水平及线粒体功能的影响
与对照组比较,1 μg/mL 阿霉素明显升高H22细胞ROS 水平,柴胡皂苷D 在2~8 μg/mL 内呈剂量相关性地降低H22细胞ROS 水平,恢复阿霉素升高的细胞ROS 水平(图3)。与对照组比较,1 μg/mL阿霉素明显降低H22细胞线粒体功能,柴胡皂苷在2~8 μg/mL 内呈剂量相关性地增强H22细胞线粒体功能,恢复阿霉素降低的细胞线粒体功能(图4)。
3.3 柴胡皂苷D 对H22 细胞自噬及摄取体蛋白Oatp1b1 表达的影响
与对照组比较,1 μg/mL 阿霉素明显抑制AO 标记(橙黄→红)的H22细胞自噬;柴胡皂苷D 在2~8 μg/mL 内呈剂量相关性地抑制H22细胞自噬,并可逆转阿霉素抑制H22细胞自噬的作用(图5)。与对照组比较,1 μg/mL 阿霉素明显促进H22细胞摄取体蛋白Oatp1b1 的表达;柴胡皂苷D 在2~8 μg/mL内呈剂量相关性地增加H22细胞Oatp1b1 的表达,逆转阿霉素抑制H22细胞Oatp1b1 的表达(图6)。
3.4 柴胡皂苷D 对小鼠H22肝癌实体瘤生长及阿霉素治疗效果的影响
与模型组比较,阿霉素明显抑制小鼠H22肝癌实体瘤生长,柴胡皂苷D 对小鼠H22肝癌实体瘤生长无明显影响,但可增加瘤组织摄取阿霉素和阿霉素对肝癌实体瘤的治疗效果,延长阿霉素治疗荷瘤小鼠的生存时间(图7)。
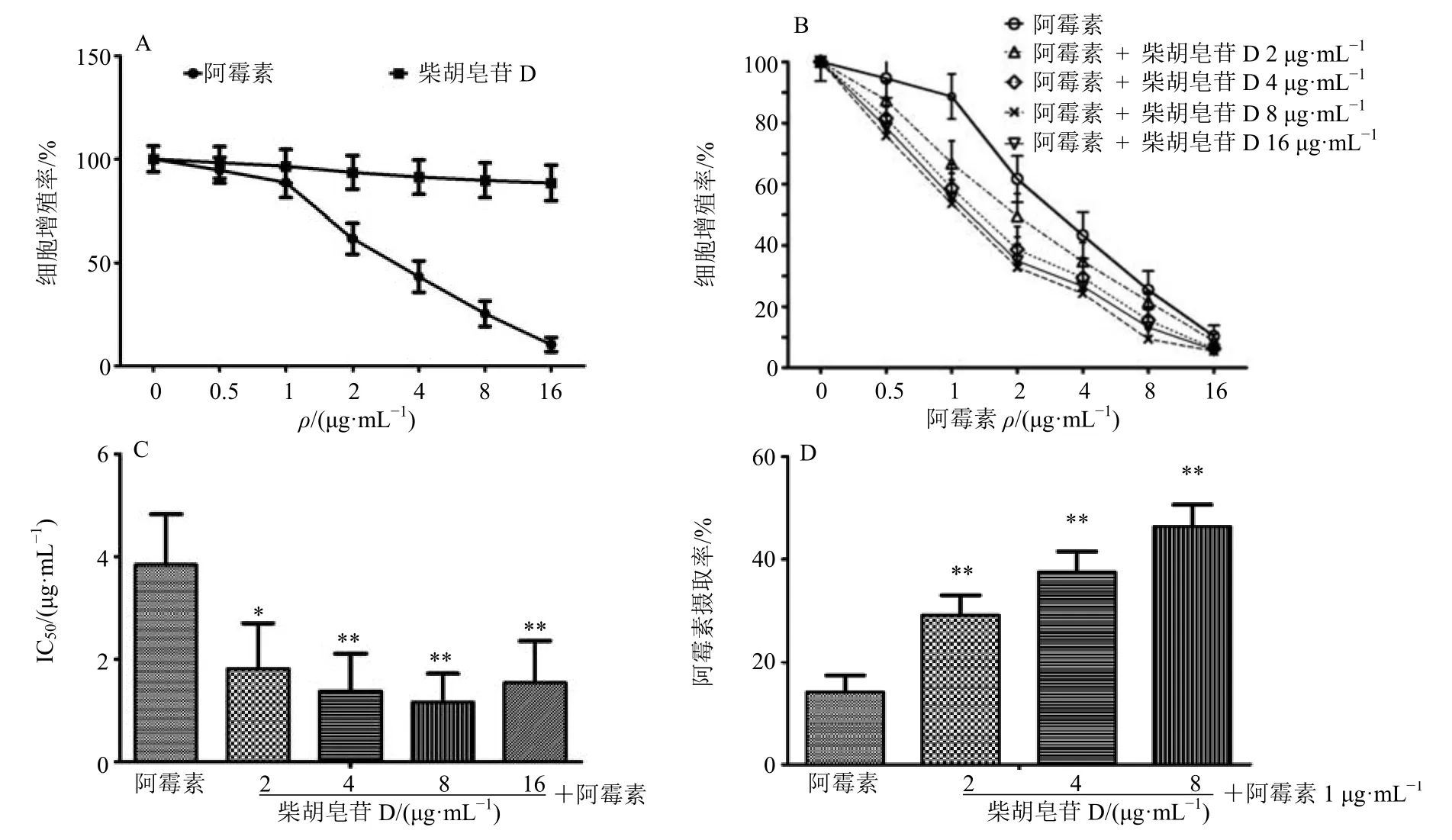
图1 柴胡皂苷D 对H22 细胞增殖 (A)、阿霉素的细胞增殖抑制作用 (B、C) 及细胞摄取阿霉素 (D) 的影响 (±s,n=6)Fig.1 Effects of saponin D on H22 cell proliferation (A),proliferation inhibition of adriamycin (B,C) and cell uptake of adriamycin (D) (±s,n=6)
3.5 柴胡皂苷D 对小鼠H22肝癌实体瘤细胞外基质的影响
与模型组比较,阿霉素明显增加小鼠H22肝癌实体瘤HA、LN、PCol-I、Col-IV 等细胞外基质的分泌;柴胡皂苷D 明显降低小鼠H22肝癌实体瘤以上细胞外基质的产生,改善阿霉素组H22肝癌实体瘤细胞外基质沉积(图8)。
3.6 柴胡皂苷 D 对小鼠 H22 肝癌实体瘤组织TGF-β1 分泌及血管通透性的影响
与模型组比较,阿霉素明显增加小鼠H22肝癌实体瘤组织TGF-β1 的分泌;柴胡皂苷D 可明显减少H22肝癌实体瘤组织TGF-β1 的分泌,逆转阿霉素组H22肝癌实体瘤组织TGF-β1 分泌的增加。与模型组比较,阿霉素明显增加小鼠H22肝癌实体瘤血管通透性;柴胡皂苷D 可明显降低小鼠H22肝癌实体瘤血管通透性,逆转阿霉素组小鼠H22肝癌实体瘤血管通透性的增加(图9)。
4 讨论
柴胡为伞形科草本植物柴胡Bupleurum chinenseDC.或狭叶柴胡B.scorzonerifoliumWilld.的干燥根,入肝胆经,有解表退热、疏肝解郁、升阳举陷的功能,主治以胸胁胀痛、寒热往来、头痛目眩等为主的外感和内伤病症,其引药入肝作用自古就被中医药界所认识[6]。柴胡气味俱薄,能引胃气上升发散表热;同时柴胡味薄兼苦,可通可泄,有疏通肠胃的功能,是调节机体气机升降的重要药物,《本经》谓其与大黄一样有“推陈致新”之功[7]。葛文静等[8]发现,将柴胡加入到肝病治疗药物组方中能将药物引入肝脏,因而增强肝病治疗效果。曾有研究证明,柴胡皂苷D 能抑制人乳腺癌SK-BR-3 细胞[9]、人结直肠癌SW480 细胞[10]和人肝癌HepG2 细胞[11]增殖,诱导细胞周期阻滞[12]。本研究发现柴胡皂苷D 对抗肿瘤药阿霉素治疗小鼠肝癌体内外均有促进细胞摄取阿霉素的靶向导引作用,为柴胡皂苷D 作为柴胡引经作用的物质基础提供了依据。

图2 柴胡皂苷D 对H22 细胞大小的影响 (±s,n=3)Fig.2 Effect of saikosaponin D on H22 cell size (±s,n=3)
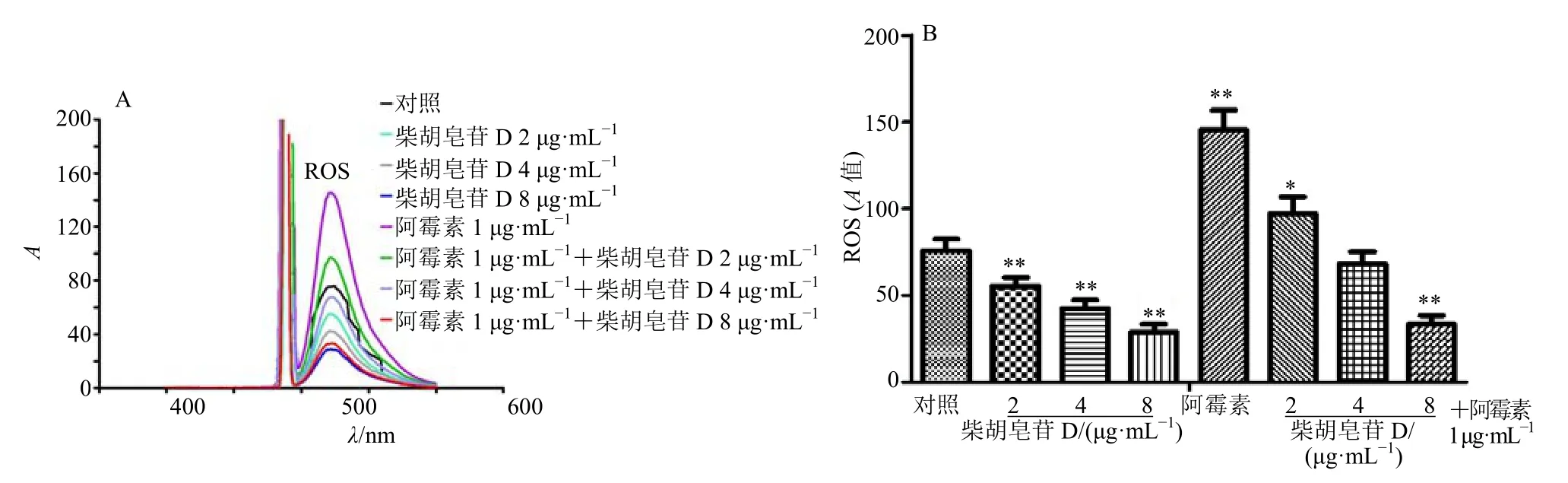
图3 柴胡皂苷D 对H22 细胞ROS 的影响 (±s,n=3)Fig.3 Effect of saikosaponin D on ROS in H22 cells (±s,n=3)
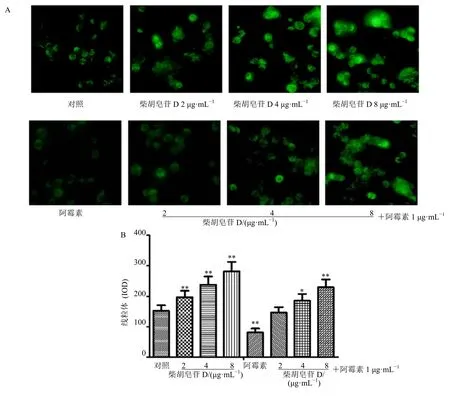
图4 柴胡皂苷D 对H22 细胞线粒体功能的影响 (±s,n=3)Fig.4 Effect of saikosaponin D on mitochondrial function in H22 cell (±s,n=3)
肝癌在中医学古籍中属于“肝积”“黄疸”“鼓胀”等范畴,其症状描述与现代医学中的肝癌临床表现有诸多类似之处,同时认为肝郁气滞是其基本病机[13]。我国学者基于中医理论的“十一脏皆取决于胆”和“胆主枢机”提出“少阳枢机不利为导致肝癌的核心病机”的观点,主张肝癌当从少阳论治[14]。临床观察证实了疏肝解郁治疗方法能够提高肝癌患者的有效率和生存率,减轻放化疗给肝癌患者带来的不良反应及心理抑郁,兼有改善肝功能和调节免疫功能等作用[15]。周仲瑛教授基于临床实践提出“癌毒蓄积是肝癌发生、发展及加重的关键”,认为肝气郁结是肝癌发病的起始,继而形成湿、热、瘀互结的肝脾肾亏虚局面,最终导致癌毒蓄积引发肝癌[16]。临床上“虚-郁-滞”病机贯穿肝癌全程,肝癌患者常出现口苦、咽干、心烦喜呕、胸胁苦满、不欲饮食等肝郁气滞的“正虚、邪实”现象[17]。因此,肝癌治疗的关键应首重理气解郁,同时运用清热利湿、活血化瘀等抗癌解毒之法。柴胡为最常用疏肝解郁中药,兼备畅通气机功能,与中医肝癌治疗原则非常符合。有研究表明,柴胡皂苷能调节Th17/Treg 细胞的失衡和抑制炎性细胞因子分泌减轻大鼠抑郁症状[18],证实了柴胡及其活性成分柴胡皂苷的解郁作用。本研究发现,柴胡皂苷D 可减少肝癌实体瘤小鼠瘤组织TGF-β1 的分泌、降低小鼠肿瘤血管通透性,在本实验剂量范围内体内外对肝癌细胞生长均无影响,但能增加阿霉素对荷瘤小鼠的治疗效果,提示柴胡皂苷D 与一般疏肝解郁药物一样,单独治疗癌症难以显效,需与抗癌药物联用才能发挥作用。
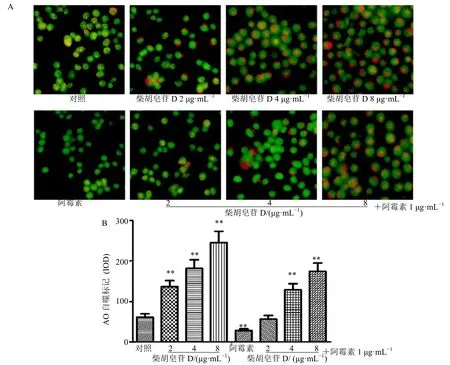
图5 柴胡皂苷D 对H22 细胞自噬的影响 (±s,n=3)Fig.5 Effect of saikosaponin D on autophagy in H22 cells (±s,n=3)

图6 柴胡皂苷D 对H22 细胞Oatp1b1 蛋白表达的影响(±s,n=3)Fig.6 Effect of saikosaponin D on protein expression of Oatp1b1 in H22 cells (±s,n=3)
靶向治疗理念对肝癌治疗药物的研发起了很大推动作用,由于癌症发病机制复杂,目前已发现的癌症驱动基因已达500 多种,即使同一种癌症也很难定位统一的驱动基因[19],传统化疗仍是肝癌等肿瘤的主要治疗方法。通过中药引经药及其活性成分引导肿瘤化疗药物直达肿瘤部位,从而提高肿瘤化疗效果,避免了检测癌症驱动基因使用肿瘤靶向药物的麻烦和高额费用,为肿瘤靶向治疗提供了简便、有效的治疗方法。柴胡及其活性成分柴胡皂苷作为中药引经药的代表成为了肝病靶向导引研究的热点之一。有研究表明,柴胡能提高拉米呋啶对乙肝病毒的治疗效果,使肝细胞损伤明显恢复、病理改变趋于正常,且能减少肝脏网状纤维增生[20]。另有研究发现柴胡皂苷能增加肝内蛋白质合成,升高肝糖含量,降低大鼠血浆胆固醇、三酰甘油和磷脂水平,加速血液清除胆固醇,为柴胡及其活性成分柴胡皂苷作为肝病治疗的引经药提供了实验依据[21]。王宗明等[22]发现柴胡皂苷D 可以抑制哺乳动物雷帕霉素靶基因(mammalian target of rapamycin,mTORC)信号传导通路诱发肝癌细胞自噬性死亡,党锋等[23]研究发现柴胡皂苷D 能通过抑制上皮间充质转化(epithelial-mesenchymal transition,EMT)和细胞干性阻止人结直肠癌细胞SW480 迁移和侵袭,从另一角度解释了柴胡引经作用的机制。本研究发现,柴胡皂苷D 在体外呈剂量依赖性增加H22细胞Oatp1b 的表达,逆转阿霉素诱导H22细胞Oatp1b1 表达的降低;在体内抑制小鼠H22肝癌实体瘤HA、LN、PCol-I、Col-IV 的分泌,改善阿霉素组H22肝癌实体瘤细胞外基质沉积,为柴胡及其活性成分柴胡皂苷引经作用增加了新的机制。
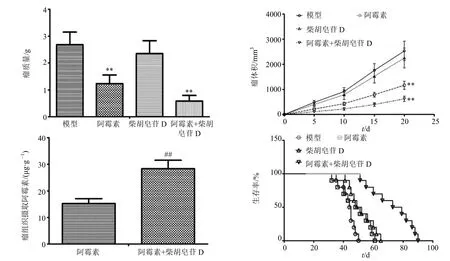
图7 柴胡皂苷D 对H22 肝癌实体瘤生长及阿霉素治疗效果的影响Fig.7 Effect of saikosaponin D on tumor growth in H22 solid tumor-bearing mice and therapeutic action of doxorubicin
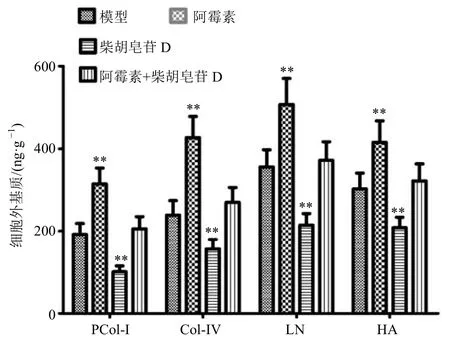
图8 柴胡皂苷D 对H22 肝癌实体瘤细胞外基质的影响(±s,n=10)Fig.8 Effect of saikosaponin D on extracellular matrix of H22 solid tumor (±s,n=10)
肿瘤的发生发展和肿瘤微环境密不可分,细胞外基质(extracellular Matrix,ECM)可为肿瘤细胞提供结构支架及细胞因子和生长因子,从而促进肿瘤细胞增殖、迁移和分化,与临床不良预后相关[24]。自噬是细胞利用溶酶体对自身细胞器进行分解,从而回收利用大分子物质的一种高度保守细胞生物学行为,有利于细胞适应不利的生活环境、维持机体内环境稳态,虽然在已完成恶性转化的肿瘤细胞中对维持肿瘤细胞基础代谢和保持细胞活性起重要作用,其功能的维持也是机体阻止肿瘤发生的重要途径。有研究表明,自噬与ECM 的合成和降解失衡密切相关,细胞自噬功能降低导致的线粒体功能受损是ECM 累积的一个重要机制[25]。梁晓强等[26]证明了柴胡的引经作用与其抑制ECM 纤维连接蛋白(fibronectin,FN)有关,为中药引经药靶向ECM 提供了依据。结合体外研究发现柴胡皂苷D 能增加细胞自噬和改善线粒体功能的结果,认为柴胡皂苷D 维持自噬和线粒体功能,继而促进Oatp1b1 的表达和降低肿瘤细胞外基质沉积,从而增加化疗药物在肿瘤部位的分布应该是其引经的重要机制。
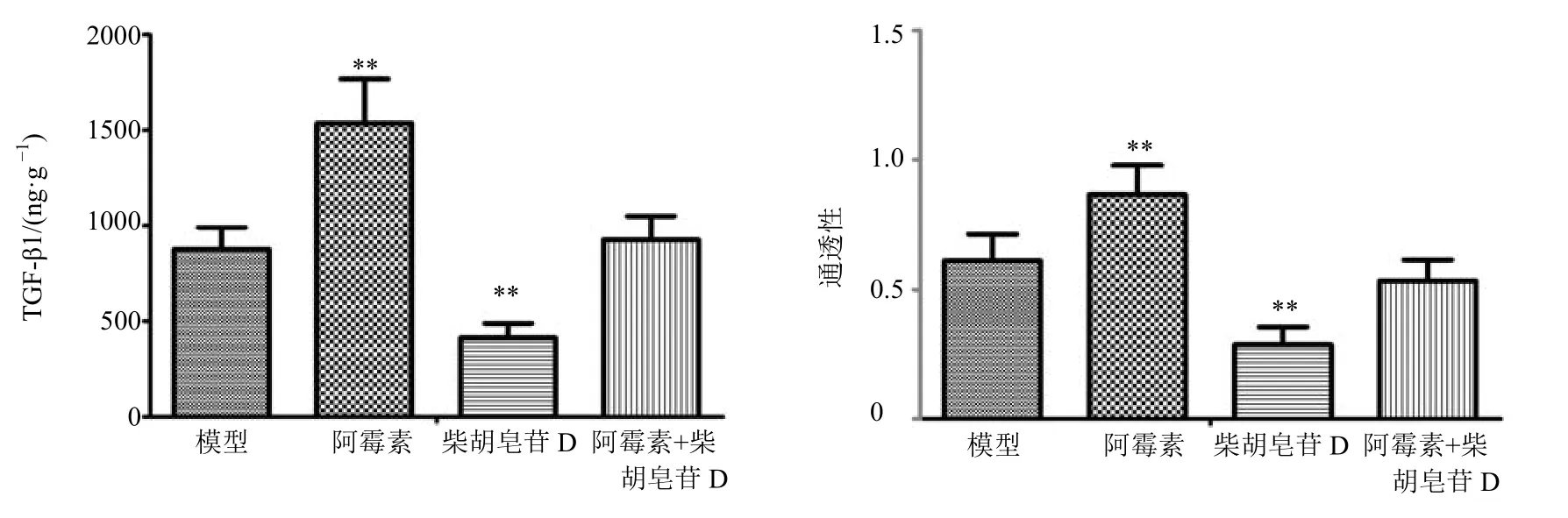
图9 柴胡皂苷D 对H22 肝癌实体瘤组织TGF-β1 分泌及血管通透性的影响Fig.9 Effect of saikosaponin D on TGF-β1 secretion and vascular permeability in H22 solid tumor-bearing mice
综上所述,柴胡皂苷D 能维持细胞自噬和线粒体功能,促进Oatp1b1 的表达和降低肿瘤细胞外基质沉积,从而对阿霉素治疗小鼠肝癌起到靶向导引作用。柴胡皂苷D 的这种靶向导引作用对肝癌化疗药物可能具有普遍性,有可能成为简单有效的肝癌化疗药物靶向导引工具与辅助材料。
利益冲突所有作者均声明不存在利益冲突