锑掺杂对Mn-Ce/TiO2催化剂脱硝性能的影响
王献忠,吴彦霞,梁海龙,陈 鑫,陈 琛,晏根平,戴长友,陈玉峰
(1.萍乡学院江西省工业陶瓷重点实验室,江西 萍乡 337055;2.中国建筑材料科学研究总院陶瓷科学研究院;3.瑞泰科技股份有限公司)
氮氧化物(NOx)是大气污染的主要来源之一,它不仅会引起光化学烟雾、酸雨,造成臭氧层的破坏等环境问题,还会严重威胁人类的健康。因此,实现NOx的减排及治理是目前环境保护的一个重要课题。选择性催化还原(SCR)脱硝技术以其成熟高效、稳定廉价等优点而被广泛应用于固定源NOx的脱除。催化剂是SCR脱硝技术的核心。目前,商业SCR催化剂主要是V2O5-WO3TiO2或V2O5-MoO3TiO2催化剂,其活性温度窗口为300~400 ℃,可减少硫酸铵盐在催化剂表面的沉积,减轻了硫对催化剂的毒害作用。该催化剂需要将反应床布置于脱硫除尘前,以满足活性温度窗口。在实际应用中,该工况条件下烟气中含有高浓度的粉尘、碱金属等有害物质,会冲刷催化剂表面,造成催化剂的磨损、堵塞,甚至导致催化剂的中毒失效,大大缩短催化剂的使用寿命。为了避免粉尘和SO2对催化剂的毒害作用,延长催化剂的使用寿命,减少对设备的改造,与现有的锅炉系统相匹配,可以将反应床布置于脱硫除尘装置之后。但这样布置的缺点是烟气温度会大大降低(<150 ℃),现有的商业钒系催化剂将无法适用,因此,有必要开发出一种低温高效、稳定性好的新型SCR催化剂。
现有的低温SCR催化剂研究主要集中在过渡金属氧化物上,如Mn,Fe,Co,Cu等。其中,Mn基催化剂的低温活性最好。Wu Zhaobiao等[1]采用溶胶-凝胶法制备的MnOxTiO2催化剂具有良好的低温活性。Kapteijn等[2]系统地研究制备方法及前躯体对MnOx催化剂脱硝活性的影响,发现单位面积MnO2的活性最高。与纯氧化锰类催化剂相比,锰基复合氧化物表现出更加优异的脱硝性能。CeO2因其出色的储氧能力及氧化还原特性,有利于NO和NH3在催化剂表面的吸附和反应[3],受到研究者的普遍关注。Imamura等[4]研究了Ce的掺入对于O在MnOx上迁移的影响,发现少量Ce的掺入就能对MnOx上O2的状态产生显著的影响,认为低温下Ce能够给MnOx提供O2,从而提高MnOx的催化活性。Liu Zhiming等[5]制备的Mn-CeTiO2催化剂在150 ℃时对NOx的脱除效率达90%以上。
虽然锰系催化剂具有较高的低温脱硝活性,但是在有H2O和SO2存在的情况下,催化剂中毒,其脱硝效率明显降低。因此,如何提高锰系催化剂的抗中毒能力是低温脱硝研究的重点和难点。有文献报道,Sb2O3具有良好的低温活性和抗H2O、SO2毒化的性能,可以作为助剂改善催化剂的性能。Phil等[6]研究了不同元素(Sb,Se,Cu,S等)对硫酸铵盐的排斥性,元素Sb显示出最高的排斥性,将其负载于V2O5TiO2催化剂,可提高催化剂低温抗硫能力。曹政等[7]采用浸渍法制备了V2O5-Sb2O3TiO2催化剂,Sb2O3的加入不仅能增强V2O5TiO2的催化活性,而且能明显提高催化剂的抗H2O和SO2毒化性能。
1 实 验
1.1 原料及试剂
50%硝酸锰溶液[Mn(NO3)2]、六水合硝酸铈[Ce(NO3)3·6H2O]、TiO2粉,均为分析纯,由国药集团化学试剂有限公司生产。醋酸锑[Sb(CH3COO)3],分析纯,由阿拉丁试剂(上海)有限公司生产。
1.2 催化剂的制备
1.2.1 Mn-CeTiO2催化剂的制备将一定量的Mn(NO3)2和Ce(NO3)3·6H2O用一定量的去离子水溶解,制得活性组分前躯体溶液。称取适量的TiO2粉,浸渍于上述溶液中,磁力搅拌3 h,于105 ℃下干燥12 h,然后在马弗炉中500 ℃焙烧3 h,冷却后破碎,筛选出不同粒径颗粒备用。制备的催化剂标记为Mn-CeTiO2,MnCe摩尔比为3∶1。
1.2.2 Mn-Ce-SbTiO2催化剂的制备将一定量的Mn(NO3)2,Ce(NO3)3,Sb(CH3COO)3用一定量的去离子水溶解,制得活性组分前躯体溶液。称取适量的TiO2粉,浸渍于上述溶液中,磁力搅拌3 h,于105 ℃下干燥12 h,然后在马弗炉中500 ℃焙烧3 h,冷却后破碎,筛选出不同粒径颗粒备用。将得到的催化剂标记为Mn-Ce-SbTiO2(x∶y),MnCe摩尔比为3∶1,x∶y表示SbTiO2摩尔比,分别为1∶10,2∶10,3∶10。
1.3 催化剂的表征
采用德国布鲁克公司生产的D8 Advance型X射线衍射(XRD)仪进行催化剂的晶相表征,测试条件为:管内电流40 mA,管内电压40 kV,以Kα为放射源、Cu为靶,扫描范围2θ为10°~80°,步幅0.02°。
采用美国Quantachrome公司生产的Autosorb-iQ型物理吸附仪进行催化剂的N2吸附-脱附测试,表征催化剂的比表面积及孔结构;先将一定质量(0.25~0.3 g)的样品于240 ℃加热抽真空预处理2 h,再于液氮(-196 ℃)条件下进行测试。比表面积采用多点BET方程计算,孔径和孔体积采用BJH法测算。
采用美国麦克公司生产的Auto Chem II 2920型化学吸附仪进行催化剂的NH3程序升温脱附(NH3-TPD)表征。先取粒径为0.3~0.45 mm的催化剂50 mg,在纯He气氛中500 ℃预处理1 h,降温至50 ℃,通入流量为30 mLmin的NH3体积分数为2%的NH3He混合气30 min,然后以升温速率为10 ℃min程序升温至550 ℃,TCD记录信号值。
采用美国麦克公司生产的Auto Chem II 2920型化学吸附仪进行催化剂的H2程序升温还原(H2-TPR)表征。先取粒径为0.3~0.45 mm的催化剂50 mg,在纯Ar气氛中300 ℃预处理0.5 h,降温至50 ℃,然后在H2体积分数为10%的H2Ar混合气(流量为20 mLmin)气氛下以升温速率为10 ℃min程序升温至900 ℃。该过程中的H2Ar混合气消耗量由TCD检测。
1.4 催化剂的活性评价
催化剂的脱硝活性评价采用内径为14 mm的不锈钢固定床连续流动反应器进行,通过加热电炉控制反应温度,试验装置如图1所示。模拟气体经质量流量计计量后进入混合器。模拟气体中O2,NOx,NH3,SO2(选用),H2O(选用)的体积分数分别为6%,0.05%,0.05%,0.03%,10%,N2为平衡气,催化剂的用量为3 mL,气体总流量为1 Lmin,体积空速为20 000 h-1。使用德国德图公司生产的Testo350型烟气分析仪测定NO入口浓度(ψ入口)和经过催化剂后NO出口浓度(ψ出口),按式(1)计算NO转化率。催化剂的脱硝活性以NO转化率为评价指标。试验过程中,每一温度点均稳定反应10 min。
NO转化率=(1-ψ出口ψ入口)×100%
(1)

图1 试验装置示意
2 结果与讨论
2.1 XRD表征
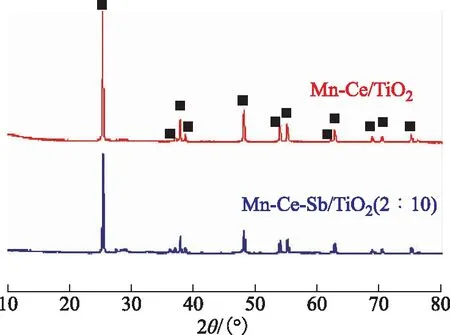
图2 Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂的XRD图谱■—锐钛矿型TiO2
2.2 N2吸附-脱附表征
催化反应的速率主要取决于催化剂与反应物的接触面积以及催化剂的表面活性位等。因此,对催化剂进行N2等温吸附-脱附试验,研究催化剂的比表面积、孔体积以及孔径等微观结构。表1为Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂的N2吸附-脱附表征结果。由表1可以看出:与Mn-CeTiO2相比,Mn-Ce-SbTiO2(2∶10)催化剂的比表面积增加,由Sb掺杂前的87.21 m2g增加到96.01 m2g;孔体积由Sb掺杂前的0.19 cm3g增加到0.23 cm3g。一般而言,比表面积是影响催化剂活性的重要因素,主要由内表面积决定。在SCR反应过程中,反应气体首先吸附在催化剂表面活性位上,形成活性态过渡产物,之后反应生成吸附态产物,最后从催化剂表面吸附位脱附,生成最终产物。较大的比表面积和孔体积可以提供较多的活性中心位,增加反应气体间的接触机会,从而有利于SCR反应进行[10]。此外,Mn-Ce-SbTiO2(2∶10)催化剂的孔径由Sb掺杂前的6.43 nm减小到5.95 nm。较小的孔径提供了丰富的孔隙结构,有利于延长传质过程中气体的接触时间,促进SCR反应的充分进行。
表1 Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂的比表面积和孔结构参数

表1 Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂的比表面积和孔结构参数
催化剂名称比表面积∕(m2·g-1)孔体积∕(cm3·g-1)平均孔径∕nmMn-Ce∕TiO287.210.196.43Mn-Ce-Sb∕TiO2(2∶10)96.010.235.95
2.3 NH3-TPD表征
根据Eley-Rideal和Langmuir-Hinshelwood两种SCR反应机理,NH3都要被吸附在催化剂的表面上,然后与气体中的NO或者吸附在催化剂表面上的NO反应。因此,在低温NH3-SCR反应中,NH3在催化剂表面的吸附和活化是影响脱硝效率的关键[11]。通过NH3-TPD测试可以表征催化剂对NH3的吸附能力及表面酸强度[12]。图3为Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂的NH3-TPD曲线。由图3可知,Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂在测试温度范围内仅检测到一个中温脱附峰,未见强酸性位脱附峰。Mn-CeTiO2催化剂的脱附峰在200~375 ℃之间,Mn-Ce-SbTiO2(2∶10)催化剂的脱附峰在250~400 ℃之间,二者均归属于催化剂表面中强B酸性位上NH4+的脱附。在NH3-TPD脱附试验中,NH3脱附峰的总面积和强度均能反映催化剂表面的相对NH3吸附量,即催化剂对NH3的吸附能力[11]。Mn-Ce-SbTiO2(2∶10)催化剂在整个测试温度范围内出现的NH3脱附峰的面积明显大于Mn-CeTiO2催化剂。Sb的掺入提高了催化剂的酸性,大大增加了催化剂表面的酸性位点,有利于促进NH3在催化剂表面的吸附和活化,提高催化剂在低温条件下的SCR活性[13]。
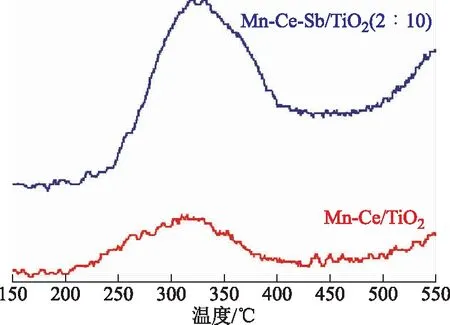
图3 Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂的NH3-TPD曲线
2.4 H2-TPR表征

图4 Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂的H2-TPR曲线
H2-TPR常用来测试催化剂的氧化还原性能,Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂的H2-TPR曲线见图4。由图4可知:Mn-CeTiO2催化剂的H2-TPR曲线仅在540 ℃左右出现一个强的氢气还原峰,这可能是由于MnOx和CeOx之间存在较强的相互作用力,从而使得还原峰的温度较高[14];而Mn-Ce-SbTiO2(2∶10)催化剂的H2-TPR曲线在430 ℃和525 ℃左右出现两个连续的氢气还原峰,对应于MnO2→Mn2O3→Mn3O4→MnO的过程。在Mn-Ce-SbTiO2(2∶10)催化剂中,可能是由于少量的Sb物种在催化剂中分散性较好,所以并没有发现明显的Sb物种的还原[15]。Mn-Ce-SbTiO2(2∶10)催化剂在430 ℃处开始消耗H2,比Mn-CeTiO2催化剂低了近110 ℃。这表明,与Mn-CeTiO2催化剂相比,Mn-Ce-SbTiO2(2∶10)催化剂中的MnOx更容易被还原为低氧化态,促进低温氧化还原反应的进行。根据文献报道[14],在SCR反应过程中,反应速率主要取决于催化剂氧化还原能力的大小。催化剂的低温还原峰的面积越大,表明催化剂表面的活性氧化物种数量越多,催化剂的催化活性越高。Mn-Ce-SbTiO2(2∶10)催化剂的低温还原峰的面积相对较大,也是该催化剂具有较高的低温脱硝活性的原因之一。
2.5 Sb/TiO2摩尔比对催化剂脱硝活性的影响
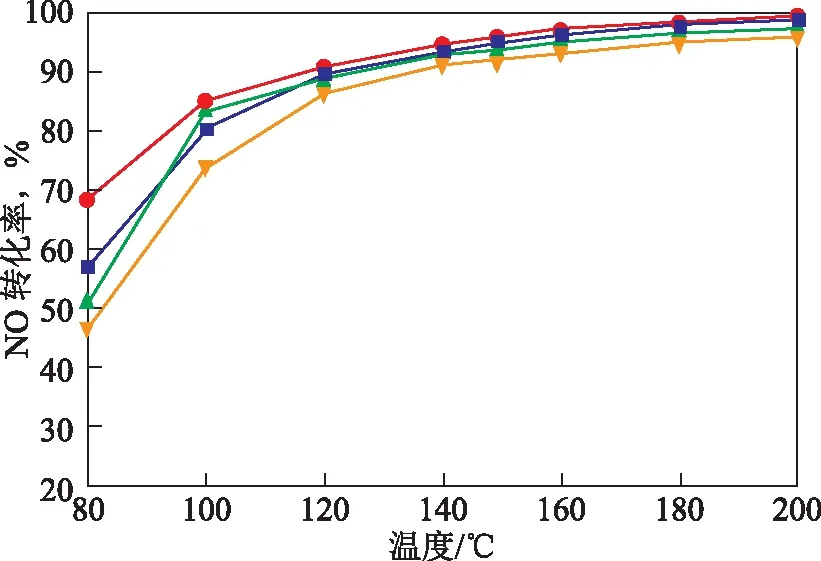
图5 SbTiO2摩尔比对Mn-Ce-SbTiO2催化剂活性的影响■—Mn-Ce-SbTiO2(1∶10); ●—Mn-Ce-SbTiO2(2∶10); ▲—Mn-Ce-SbTiO2(3∶10);
2.6 H2O和SO2对催化剂脱硝活性的影响
在实际生产中,H2O和SO2均是烟道气的重要组分,因此,在H2O和SO2存在的条件下,考察催化剂催化性能的稳定性是很有必要的[17]。在180 ℃下,通入质量分数分别为10%和0.03%的H2O和SO2,考察H2O和SO2对Mn-CeTiO2和Mn-Ce-SbTiO2(2∶10)催化剂脱硝性能的影响,结果见图6。在通入H2O和SO2之前,反应已经稳定了0.5 h,两种催化剂均已获得最佳脱硝活性。由图6可知:通入H2O和SO2后,两种催化剂的脱硝活性均出现了不同程度的降低;Mn-CeTiO2催化剂在通入H2O和SO2之前,脱硝活性维持在94%左右,通入H2O和SO2后,在反应时间为260 min时,其脱硝活性迅速降低为44%左右;而Mn-Ce-SbTiO2(2∶10)催化剂具有较强的抗硫性能,通入H2O和SO2后,在反应时间为260 min时,脱硝活性由98%降低至72%左右。催化剂脱硝活性下降的原因是:通入H2O和SO2之后,SO2与还原剂NH3反应生成的硫酸铵和硫酸氢铵在催化剂表面不断累积,堵塞了催化剂的部分孔道、覆盖了催化剂的表面活性中心;H2O的存在,使得TiO2上的羟基和SO2发生反应,促进了硫酸铵盐的形成。此外,催化剂组分被硫酸化,是造成催化剂失活的另一原因。

图6 H2O和SO2对催化剂脱硝活性的影响●—Mn-CeTiO2; ▲—Mn-Ce-SbTiO2(2∶10)

