优思弗辅助阿拓莫兰治疗婴儿胆汁淤积症的效果
刘 晖,徐 岳,吴 薇(.南通大学附属常州儿童医院消化感染科,常州 3003;.南通大学附属常州儿童医院儿童内镜中心,常州 3003;3.南通大学附属常州儿童医院新生儿科,常州 3003)
婴儿胆汁淤积症(IC)是由于婴儿胆汁生成障碍或/和胆汁流动障碍所致的一种疾病,又名胆汁淤积综合征,是新生儿或婴儿常见的病症。肝组织坏死及肝内、外胆管疾病均可导致淤积[1]。IC常发生于婴儿巨细胞病毒感染、肝内外胆管发育异常、遗传代谢疾病和胃肠外营养等情况,常可见黄疸、尿色深、瘙痒以及佝偻病串珠等病症。生长曲线可见婴儿明显生长缓慢,常伴吮吸反射减弱、肝功异常及瘀点瘀斑,严重者可导致肝衰竭、多器官功能障碍综合征、凝血障碍等疾病,严重影响婴儿的生长与健康[2]。研究表明[3],目前婴儿IC的发生率为2‰~4‰,根治婴儿IC的难度较大,规律服药、控制病情、对症治疗和改善肝功能是临床治疗的主要目标。优思弗是一种熊去氧胆酸药物,可抑制胆固醇的重吸收,降低胆固醇向胆汁中的分泌,降低其饱和度;同时是与水结合力强且无毒的药物,既保护了肝脏细胞,又可替代与脂质结合的毒性胆汁酸[4]。研究证实[5],通过亲水性及细胞保护性的熊去氧胆酸替代毒性胆汁酸,治疗IC效果显著。但优思弗不能补充IC体能缺乏的谷胱甘肽,故单独用药保肝作用并不理想。阿拓莫兰是一种还原肽类保肝药,其主要成分谷胱甘肽可激活体内硫醇基酶,促进代谢;同时可与多种有毒物质结合,产生减毒保护效应[6]。但目前对优思弗辅助阿拓莫兰治疗IC的报道有限,因此本研究拟通过优思弗辅助阿拓莫兰治疗IC,旨在改善患儿的临床症状与肝功能指标,提高临床治疗效果,降低毒性和不良反应。
1 资料与方法
1.1一般资料 选取我院收治的78例IC婴儿。纳入标准:①均符合《2015年胆汁淤积性肝病诊断治疗专家共识》[7]与《2015年ESPGHAN联合建议:婴儿胆汁淤积评估指南》[8];②先天性胆道闭锁者行肝门-空肠吻合术(Kasai)手术;③遗传代谢疾病针对病因干预治疗。排除标准:①先天性胆汁酸合成障碍者;②肝衰竭者;③过敏者;④临床资料不全者;⑤中途退出者。按照入院ID用随机数字表法均分为对照组和观察组,每组39例。2组患儿的基本资料比较差异无统计学意义(P>0.05),具有可比性,见表1。

表1 2组患儿的基线资料比较
1.2方法 对照组患儿给予门冬氨酸钾镁(潘金南,匈牙利吉瑞大药厂,进口药品注册证号H20130590,规格:10 mL)静滴,溶于50 g·L-1葡萄糖注射液50~100 mL中缓慢静滴,每日1次。同时给予优思弗胶囊(Dr.Falk Pharma GmbH,进口注册证号 H20150365,规格:250 mg),按照10 mg·kg-1口服,每日2次,连续治疗14 d。观察组患儿在对照组治疗的基础上给予阿拓莫兰(重庆药友制药有限责任公司,规格:0.6 g,国药准字 H50021524)静脉滴注,按照0.15 g·kg-1缓慢静滴,每日1次,连续治疗14 d。
1.3观察指标 (1)采用《2015年ESPGHAN联合建议:婴儿胆汁淤积评估指南》[8]中IC症状评分标准评估2组患儿的临床治疗效果,其中总有效率=100%-无效率,并对患儿的临床症状进行评分;(2)采集2组患儿在治疗前、治疗7,14 d后的静脉血,使用日立全自动生化仪检测肝功能指标:谷丙转氨酶(ALT)、总胆红素(TBIL)、直接胆红素(DBIL)、总胆汁酸(TBA)、γ-谷氨酰转移酶(γ-GGT)、谷草转氨酶(AST)和碱性磷酸酶(ALP);(3)使用中国西安核仪器厂的XH-6020型γ放射免疫计数器,采用放射免疫分析法测定静脉血中肝纤4项[透明质酸(HA)、层黏连蛋白(LN)、Ⅲ型前胶原(PCⅢ)及Ⅳ型胶原(cⅣ)]水平;(4)记录并比较2组患儿的毒性和不良反应发生情况。

2 结果
2.12组患儿治疗前后的临床症状评分比较 治疗前,2组患儿的各项临床症状评分比较差异无统计学意义(P>0.05);治疗14 d后,2组患儿的各项临床症状评分均明显降低(P<0.05),且观察组的各项临床症状评分均明显低于对照组,差异均有统计学意义(P<0.05),见表2。

表2 2组患儿治疗前后的临床症状评分比较
2.22组患儿的临床治疗效果比较 治疗14 d后,观察组患儿的临床总有效率为89.74%,明显高于对照组的71.79%,差异有统计学意义 (P<0.05),见表3。

表3 2组患儿的临床治疗效果比较
2.32组患儿治疗前后的肝功能指标比较 治疗前,2组患者的肝功指标ALT、ALP、AST、TBIL、DBIL、TBA和γ-GGT水平比较,差异无统计学意义(P>0.05);治疗7,14 d后,2组患儿的肝功指标ALT、ALP、AST、TBIL、DBIL、TBA和γ-GGT水平均明显降低,且观察组的肝功指标各水平均明显低于对照组,差异有统计学意义(P<0.05),见表4。

表4 2组患儿治疗前后的肝功能指标比较
2.42组患儿治疗前后的肝纤4项指标比较 治疗前,2组患者的肝纤4项指标HA、LN、PCⅢ和cⅣ水平比较差异无统计学意义(P>0.05);治疗14 d后,2组患儿的LN水平比较差异无统计学意义(P>0.05);治疗后2组患儿的HA、PCⅢ及cⅣ水平均明显降低,且观察组低于对照组,差异有统计学意义(P<0.05),见表5。

表5 2组患儿治疗前后的肝纤4项指标比较
2.52组患儿治疗期间的毒性和不良反应发生情况比较 在治疗期间,观察组患儿的毒性和不良反应发生率为12.82%,明显低于对照组的33.33%,差异有统计学意义(P<0.05),见表6。
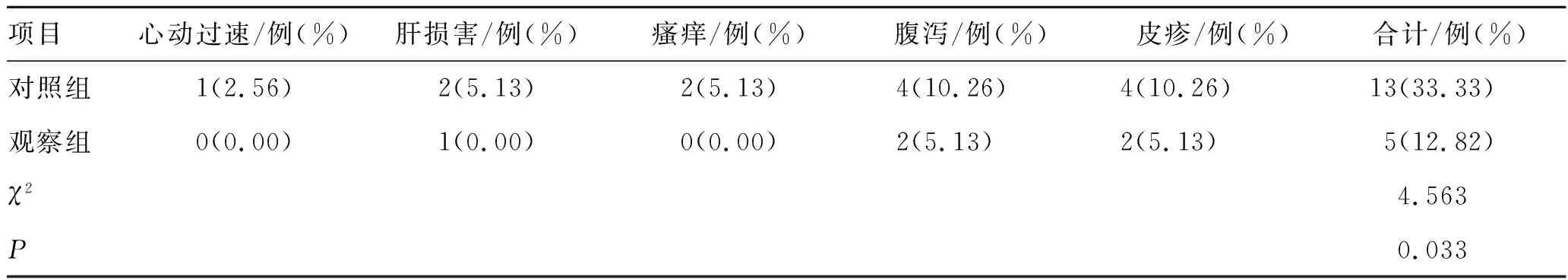
表6 2组患儿治疗期间的毒性和不良反应发生情况比较 (n=39)
3 讨论
健康婴儿的胆固醇在肝内经各种酶的参与在最早期形成了胆汁酸,随后在肠道内被细菌降解,生成胆汁酸,此时大多数胆汁酸与甘氨酸(Dly)和β-氨基乙磺酸储存在胆汁中。早期胆汁酸结合β-氨基乙磺酸后,分泌至肝外胆管和肠道。而大部分结合的胆汁酸被重吸收入肝,仅0.4 g·d-1排出体外[3]。但是由于多种疾病,如病毒感染、肝内胆管发育不良、胃肠外营养、Alagille-Watson综合征等,导致IC发生[9]。此时,随胆汁排出的胆汁酸、总胆红素、总胆固醇等被潴留,甚至反流,进而使其血浓度升高,出现相应的皮肤瘙痒、黄疸及瘀点瘀斑等症状。同时IC患儿肠内胆汁酸缺乏,大便为灰白色,以及肠内胆汁酸减少造成脂肪吸收障碍,导致患儿生长速度明显缓慢甚至停滞;同时也会伴有维生素缺乏导致的佝偻病、肌肉萎缩、胃肠道出血、皮肤黏膜角化等。如果原发病所致IC,患儿则出现肝局灶性坏死、肝功紊乱;严重者可发展为佝偻病串珠及肝功能衰竭[10]。严重影响了婴儿期患儿的正常生长,威胁其生命。目前,临床上以控制患儿症状、改善肝功能为主要治疗目标,若IC患儿经规律服药和综合保肝治疗后,约70%以上的患儿病情可得到较好控制[11]。因此,IC患儿及时接受规范化对症保肝治疗,对改善患儿症状至关重要。
门冬氨酸钾镁是治疗IC的常用药,其成分为门冬氨酸钾盐和镁盐的混合物,对IC具有一定的防治效果。门冬氨酸参与三羧酸循环作用显著,同时可促进氨气(NH3)和二氧化碳(CO2)的代谢,降低其血浓度[12]。再者,其非特异性的保肝作用尚不明确,可能与其维持正常能量代谢有关。研究证实[13],钾镁抗胆汁淤积的活性显著,具有较好的治疗效果。而在临床使用中,常将其溶于50 g·L-1葡萄糖注射液中静脉滴注。但由于婴儿肝肾发育不成熟,药物代谢能力低,毒性和不良反应明显,故其综合效果并不理想。优思弗是一种利胆药,患者口服后,抑制其体内胆固醇的重吸收,同时减少其向胆汁的分泌量,降低饱和度,此机制可用于消除结石[13]。当患儿口服后,与水结合力强的无毒的药物成分既保护了肝脏细胞,又可替代与脂质结合的毒性胆汁酸。药代动力学研究表明[14],优思弗首过清除率可达60 %,半衰期为3.5~5.8 d,对患儿治疗效果明显,代谢压力低,同时不良反应发生较少。近年来发现,阿拓莫兰是一种还原肽类保肝药,其主要成分谷胱甘肽可激活体内巯基酶(SH),促进代谢,同时与多种有毒物质结合,产生减毒保护效应。药理学研究表明[15],阿拓莫兰可有效补充机体缺乏的谷胱甘肽,具有解毒作用,保肝效果显著。优思弗与阿拓莫兰联用既可控制病情、改善症状,又可减少不良反应,提高治疗的综合效果。本研究结果显示,优思弗辅助阿拓莫兰治疗IC患儿,可明显降低患儿的临床症状评分,同时治疗效果显著。治疗14 d后,复查患儿肝功能,其各项指标均显著改善,尤其肝细胞损伤明显减轻,恢复良好,胆汁淤积明显减少,提示患儿的肝功能恢复良好。进一步复查患儿的肝纤4项情况,LN水平无明显变化,表明LN在肝硬化前期的肝纤维化过程中尚未达到肝硬化程度的显著积累,而HA、PCⅢ及cⅣ水平显著降低,表明肝细胞受损得到缓解及肝内已生成纤维量减少,提示联合治疗效果显著。患儿不良反应的发生情况显著低于对照组,是因为2种药物自身均无特殊性和不良反应,同时改变了阿拓莫兰的静滴途径,有效减少了患儿的药物代谢负担和不良反应的发生。
综上所述,优思弗辅助阿拓莫兰治疗IC患儿的临床效果明显,可有效恢复肝功能,改善临床症状,毒性和不良反应低,值得临床推广。

