初诊肺腺癌患者PET/CT显像的心肌代谢特征及影响左心室心肌代谢增高的因素分析
王 丽 武姣彦 杨敏福*
(1. 国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院核医学科,北京 100021;2. 首都医科大学附属北京朝阳医院核医学科,北京 100020)
心血管疾病和恶性肿瘤是严重危害人类健康的最重要的两种疾病,两者有共同的危险因素,如吸烟、衰老、肥胖、久坐的生活方式、压力和炎症水平增高等,同时恶性肿瘤本身也是心血管疾病的一个危险因素[1-2]。许多患者在肿瘤确诊初期已有亚临床或伴临床表现的心血管疾病,后者可能导致抗肿瘤治疗方案的改变甚至中断[3]。因此,及时发现心血管系统的异常,探索其潜在机制并及时干预对于肿瘤患者的精确分层、个体化治疗和预防心脏毒性具有重要意义。
氟-18-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)正电子发射型计算机断层扫描显像(positron emission tomography/computed tomography,PET/CT)广泛用于恶性肿瘤的诊断、鉴别、分期和疗效评估等方面[4]。常规肿瘤显像前患者通过禁食4~6 h以上可以减少骨骼肌和心肌的胰岛素依赖性生理性摄取,而葡萄糖的病理性摄取不受影响,因此在进行肿瘤显像的同时有助于一些心血管疾病的诊断,如心血管炎症、动脉粥样硬化疾病和心肌缺血等[5-7]。近期研究[8-10]报道,常规18F-FDG肿瘤显像所示心肌代谢的变化与肿瘤患者抗肿瘤治疗所致心脏毒性的发生相关。然而,在抗肿瘤治疗前患者的心脏代谢是否已发生改变尚未可知。因此,本研究基于常规肿瘤18F-FDG PET/CT显像患者的影像和临床资料,探讨肺腺癌患者抗肿瘤治疗前心血管的代谢情况及其临床意义。
1 对象与方法
1.1 研究对象
选取首都医科大学附属北京朝阳医院2014年6月至2016年10月以肿瘤筛查、诊断和术前分期等为目的而行18F-FDG PET/CT全身显像的182例肺腺癌患者为病例组。按照组间年龄、性别匹配的原则,从同一数据库中选择45名非肿瘤患者作为对照组,这些患者因肿瘤标志物升高或其他可疑恶性肿瘤行PET/CT检查。根据对照组左心室心肌标准摄取值的最大值(maximum standardized uptake value,SUVmax)的第3四分位数(P75),将肺腺癌组患者分为左心室心肌代谢增高组和未增高组。排除标准:①18F-FDG显像与病理确诊肺腺癌的时间间隔大于3个月;②18F-FDG显像前接受了化疗、放疗等抗肿瘤治疗;③伴有其他肿瘤;④既往有心血管疾病史,包括冠状动脉疾病、心力衰竭、心肌病等;⑤伴有系统性炎症疾病或感染疾病史;⑥伴有糖尿病;⑦研究所需的关键临床资料或影像资料缺失;⑧18F-FDG图像质量差。对照组纳入标准:①无心血管疾病史;②无恶性病史;③无糖尿病史;④在PET/CT成像上无恶性或炎性发现。本研究获得首都医科大学附属北京朝阳医院伦理委员会的批准(批准文号:2018-科-338)。
1.2 临床资料收集
查阅门诊、住院病历和 PET/CT检查记录单,收集患者的一般临床资料,包括年龄、性别、临床病史、放疗和/或化疗史、PET/CT显像目的、血液生化检查、疾病最终诊断结果;收集患者的心脏相关影像学资料,包括心电图、心脏超声等结果。
1.3 18F-FDG PET/CT显像
在Discovery STE(GE公司,美国)设备上使用标准方案进行PET/CT扫描。显像前患者空腹时间平均为(14.8±0.8) h,18F-FDG注射前空腹血糖平均浓度为(92.5±15.4) mg/dL。静脉注射3.7 MBq/kg18F-FDG后平均(67.5±10.1) min行全身PET/CT显像。CT参数为:140 kV,120 mA。PET参数为:三维模式下采集颅底到股骨中上部图像(2.5 min/床位),之后视临床需求加做头部显像(5 min/床位)。经CT衰减校正的PET图像(体素3.9 mm×3.9 mm×3.3 mm)使用三维有序子集最大期望值法(14个子集,2次迭代)进行重建。在AW Volume Share 2(GE公司,美国)上自动获得集成的PET和CT图像。
1.4 18F-FDG图像分析
两名核医学医师在对患者临床信息不知情的情况下分别测量SUV。所有参数由一名医师进行了两次测量,并由另一名医师进行了一次测量,以评估观察者内和观察者间的可重复性。选择一名医师的第二次测量结果进入最终分析。
在PET和CT融合图像上手动勾画三维感兴趣区(region of interest,ROI)并进行调整,以确保三维图像均包括整个左心室。自动获得左心室心肌葡萄糖代谢标准摄取值的最大值(SUVmax)和平均值(SUVmean)。左心室心肌摄取类型分为4种:(1)无摄取,即左心室心肌整体摄取等于或低于心腔内血液(心血池)的摄取;(2)弥漫性摄取,即左心室心肌整体均有摄取,且大致呈均匀性分布,没有局灶性的或明显的更高摄取;(3)局灶性摄取,即左心室心肌只有局灶性的高摄取,而其余心肌的摄取等于或低于心血池;(4)弥漫摄取基础上的局灶性摄取,即在左心室心肌弥漫性摄取的基础上,某些心肌节段表现为更高程度的摄取。上述摄取类型中,除外基底部“环”或“半环”摄取、侧壁均匀摄取以及乳头肌局灶性摄取显像剂外,局灶性和弥漫性摄取基础上的局灶性摄取被判定为异常摄取[11]。
肺腺癌多发病灶中最大的病灶判定为原发灶。轴位图像测量原发病灶的最大径。根据18F-FDG PET/CT显像确定TNM分期[12]。动脉靶本比值(target-background ratio,TBR)评估动脉18F-FDG的摄取[13]。ROI直径约1cm,包括动脉管壁。颈总动脉TBR=颈总动脉SUVmax/ 颈内静脉SUVmean。升主动脉TBR=升主动脉SUVmax/升主动脉腔SUVmean。动脉TBR定义为升主动脉和颈总动脉血管壁TBR的平均值[14]。依据既往研究[15]分别测量心外膜脂肪组织(epicardial adipose tissue,EAT)、脾脏和骨髓的18F-FDG摄取。
1.5 统计学方法
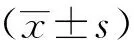
2 结果
2.1 初诊肺腺癌患者临床及代谢特征分析
初诊肺腺癌病例组与对照组之间年龄、性别、体质量指数(body mass index,BMI)、基线血糖,差异无统计学意义(P>0.05)。肺腺癌病例组高血压、吸烟的比例及肌酐浓度高于对照组,血脂浓度(包括总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和三酰甘油)低于对照组,差异有统计学意义(P<0.05),详见表1。
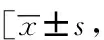
表1 肺腺癌组与对照组的临床特征及代谢分析Tab.1 Patients’ characteristics and metabolism analysis in the groups of LAD and control n(%), M(P25,P75)]
2.2 初诊肺腺癌组与对照组左心室心肌18F-FDG的摄取比较
观察者内和观察者间具有良好的可重复性(所有ICC>0.8)。与对照组相比,肺腺癌组患者左心室心肌对18F-FDG的摄取明显增高[4.4 (2.5,8.0)vs3.5 (2.1,5.6),P=0.05](表1,图1)。肺腺癌组有16例患者(8.8%)判定为左心室心肌异常摄取,包括心尖部7例;左室外侧壁和前壁1例;外侧壁2例;间隔心尖部1例;前壁4例;下壁1例(图2);而对照组2例(4.4%)均为心尖部,判定为左心室心肌异常摄取。但组间差异无统计学意义(P>0.05)。动脉、脾脏、骨髓及EAT的葡萄糖代谢在两组间的差异无统计学意义,详见表1。
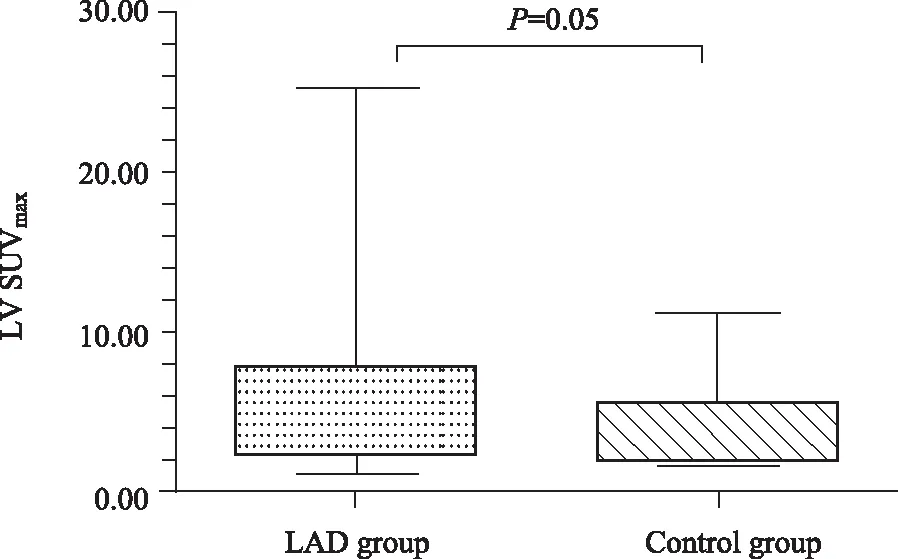
图1 肺腺癌组患者左心室心肌SUVmax显著高于对照组Fig.1 LAD patients had higher LV SUVmax than that of non-oncologic patientsSUVmax: maximum standardized uptake value; LAD: lung adenocarcinoma; LV: left ventricular; LAD group: n=182; Control group: n=45.
2.3 影响肺腺癌患者左心室心肌代谢增高的因素分析
1)单因素分析:筛选出9个变量进入多因素Logistic回归分析,包括空腹时间、三酰甘油(triglyceride,TG)浓度、TNM Ⅰ期、肺腺癌原发病灶SUVmax、EAT-SUVmax、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C-反应蛋白(C-reactive protein,CRP)、纤维蛋白原、左心室舒张末期横径(left ventricular end diastolic diameter,LVEDD),详见表2。
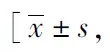
表2 肺腺癌患者中左心室心肌代谢增高组与未增高组的变量比较Tab.2 Comparison of variables between high and low 18F-FDG uptake groups in LAD n(%), M(P25,P75)]
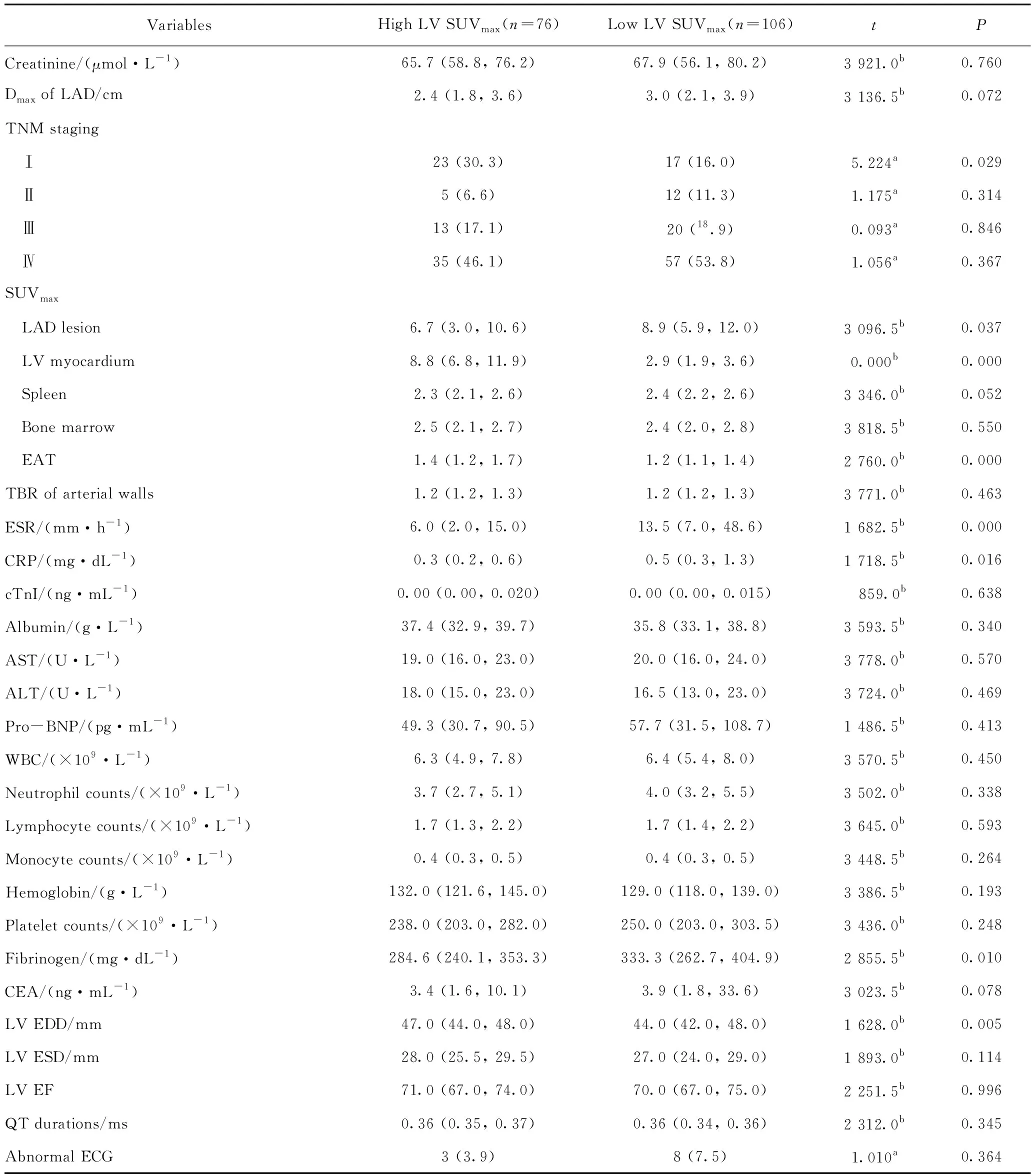
续表2
2)多因素Logistic回归分析:结果显示,EAT-SUVmax与肺腺癌患者左心室心肌SUVmax增高相关(P=0.039),见表3。如图3所示,EAT-SUVmax与左心室心肌SUVmax呈正相关(Spearmanr=0.386,P=0.000 1)。
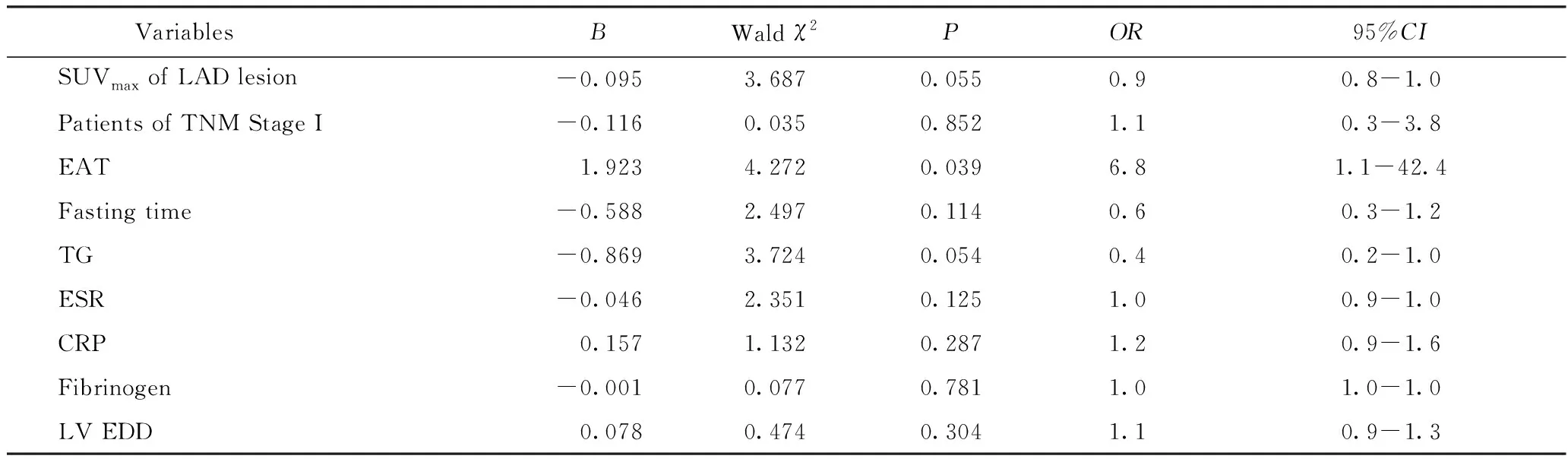
表3 多因素Logistic回归分析肺腺癌患者左心室心肌代谢增高的影响因素Tab.3 Multivariate logistic regression analysis for prediction of increased LV SUVmax in LAD

图3 肺腺癌患者心外膜脂肪组织的代谢活性与左心室SUVmax显著相关Fig.3 The activity of EAT was mildly but significantly correlated with LV SUVmax in LADSUVmax: maximum standardized uptake value; EAT: epicardial adipose tissue; LV: left ventricular; LAD: lung adenocarcinoma.
3 讨论
本研究表明,与对照组相比,肺腺癌患者抗肿瘤治疗前左心室心肌代谢显著增高,心外膜脂肪组织的代谢活性与肺腺癌患者左心室心肌代谢增高呈独立正相关。因此,本研究提示,肺腺癌患者在抗肿瘤治疗前心肌代谢很可能已经发生改变,并与心肌局部的炎症水平相关。
恶性肿瘤治疗导致患者心脏毒性的发生是近年来肿瘤和心血管疾病领域的研究热点和难点,心肌代谢的变化与心脏毒性的关系也引起了人们的关注。近期研究[8-10]显示,霍奇金淋巴瘤患者心脏18F-FDG摄取的增加与左心室功能下降相关,而阿霉素(蒽环类药物)治疗前左心室18F-FDG摄取水平低与蒽环类药物诱导心脏毒性的发生有关,但机制未明[8]。这些结果提示蒽环类药物可以影响淋巴瘤患者心肌对18F-FDG的摄取从而导致心脏毒性的发生[8]。然而,考虑到恶性肿瘤自身即为心血管疾病的危险因素,抗肿瘤治疗前患者心肌代谢是否已发生改变尚不清楚。本研究为此提供了一定的证据。与非肿瘤患者相比,未经治疗的肺腺癌患者左心室心肌的葡萄糖代谢水平趋于更高。有趣的是,本研究的肺腺癌患者左心室收缩功能均为正常水平(左心室射血分数=67.0%~75.0%),因此,笔者推测,在抗肿瘤治疗前,左心室心肌葡萄糖摄取的增加可能预示着心肌损伤的早期阶段或心肌对肿瘤的适应性反应,需进一步研究验证。
本研究显示,8.8%的肺腺癌患者存在左心室心肌局灶性代谢异常,这一比例高于正常对照组,但是本回顾性研究无法阐明相关机制。心脏局灶性代谢异常多见于心肌缺血、心脏负荷急剧增加、病理性心肌肥厚、充血性心力衰竭、心肌炎以及结节病等[6-7]。慢性炎症是肿瘤发生发展的重要机制[16],肿瘤组织可产生炎性细胞因子和炎症细胞,后者进入血液循环可能会导致心脏相关炎症的发生,进而改变心肌代谢。遗憾的是,本研究并没有发现系统性炎症指标(血沉、C反应蛋白)与心肌代谢的改变具有相关性。
在本研究中,一个新的发现是心外膜脂肪组织的代谢活性与肺腺癌患者抗肿瘤治疗前左心室心肌代谢呈独立正相关。心外膜脂肪组织的生理作用包括:为心脏提供机械保护,为心肌提供能量,产生抗炎脂肪细胞因子保护心脏[17]。病理上,心外膜脂肪组织是炎性细胞因子和肌成纤维细胞的来源地[17],因此,心外膜脂肪组织的炎症水平增加很可能会导致心脏局部炎症的发生,进而影响心肌代谢。
本研究存在一些局限性。首先,本研究是回顾性研究,且样本量较少,无法获得病理或组织学特征,从而对患者左心室18F-FDG的摄取水平加以验证,明确其机制。第二,尽管本研究中显像方案采用了长时间禁食(>12 h),但左心室心肌对18F-FDG的生理性摄取可能并未完全被抑制。第三,本研究虽已排除伴有心血管疾病(特别是冠状动脉粥样硬化性心脏病)的患者,但是无法除外研究中纳入无症状性心肌缺血的患者。第四,无法获得对照组患者的血液学指标和超声心动图结果。
综上,本研究表明,肺腺癌患者在抗肿瘤治疗前左心室心肌代谢水平显著增高,可能与心脏局部炎症水平相关。

