听神经病谱系障碍患者人工耳蜗术后长期听力康复效果分析
王杰 张李芳 陈婧媛 陈彪 李永新*
1首都医科大学附属北京同仁医院耳鼻咽喉头颈外科,耳鼻咽喉头颈科学教育部重点实验室(首都医科大学)(北京100730)2北京市人工听觉工程技术研究中心(北京 100730)
听神经病谱系障碍(Auditory Neuropathy Spectrum Disorder,ANSD)亦称为听神经病(Auditory Neuropathy,AN)、听觉同步不良(Auditory Dyssynchrony,AD),最早于1996年有Starr提出,并推测其为由于第Ⅷ对颅神经受损而引起一系列听功能障碍的症状[1]。并在2008年国际听神经病诊断与干预大会指南中正式被命名为听神经病谱系障碍[2]。目前研究结果显示ANSD是一种外毛细胞功能正常,而内毛细胞、听神经突触和(或)听神经功能不良的疾病,具体听力学方面表现为听觉脑干诱发电位(Auditory Brainstem Response,ABR)无反应或严重异常而耳声发射(Otoacoustic Emissions,OAEs)和(或)耳蜗微音电位(Cochlear Microphonic,CM)可引出。甚至,有研究认为,对于OTOF突变所导致的听神经病患者,其耳蜗电图可存在特殊波形[3]。临床特征主要体现为患者能听到声音却不能理解它的意思,其听觉时域信息神经编码功能减弱,以及言语识别能力下降,表现出言语识别率与纯音听阈不成比例的下降[4-7]。
对于ANSD患者,目前其主要的治疗手段为配戴助听器以及人工耳蜗植入手术,两者均能对部分患者起到一定的提高听觉以及言语识别率的作用[8,9]。研究结果显示OTOF基因阳性患儿主要表现为突触及突触前病变,CI植入效果较好[10]。在ANSD病例中,OTOF基因突变是导致遗传性听神经病的主要原因[11],其余病例的CI植入尚需探索。此外,虽然,有学者认为86%的ANSD患儿行CI后听觉言语能力康复效果好[5]。但临床上患儿家长及医生面对特定病例是否决定CI植入尚需更多参考资料,以便建立较合理的期望值。
本研究旨在回顾性研究ANSD病例植入CI患者的术前听力学特征以及术后远期听力康复效果,为临床进一步开展该项工作提供参考。
1 资料与方法
1.1 研究对象
46例2005 年-2018年经我中心诊断为ANSD并行人工耳蜗植入术的患者,其中男性22例(47.82%),女性24例(52.17%),年龄为0-36岁,平均植入年龄3.38岁。符合以下条件的患者诊断为ANSD:1)畸变产物耳声发射(DPOAE)存在和或记录到耳蜗微音电位(CM);2)ABR未引出或严重异常。其中12例规律随访至术后3年的患儿(平均植入月龄为24.67月,标准差为23.25月)依据DPOAE、CM是否引出分为2组,组1:即DP+组,DPOAE可引出,共7耳;组2:即DP-组,DPOAE未引出但CM可记录到,共5耳。
对照组为45例发育结构正常且患有极重度感音神经性听力下降、植入月龄在10~64月(平均植入月龄为30.19月,标准差为14.91月,其分布经非参数检验曼-惠特尼U检验与上述ANSD组患儿月龄无明显差异)的患儿。
1.2 测试方法
1.2.1 术前检查
所有患儿术前由同一组测试者在本底噪声≤30 dB(A)的隔声室内进行全部听力测试,包括多频稳态,听性脑干反应(auditory brain stem response,ABR)阈值及潜伏期,40Hz听觉相关电位,声导抗检查,畸变产物耳声发射,耳蜗微音电位及颞骨CT和内耳MRI影像学检查。
畸变产物耳声发射:患儿在经过水合氯醛镇静后,于睡眠状态进行测试。测试仪器采用美国INTELLIGENT HEARING设备的SMART EP组件,通过给予两个初始信号强度为70 dB SPL,频率比为1.22(即Ll=L2=70 dB SPL,f2/f1=1.22)的纯音,测试信号频率范围为于0.7~6 kHz,每个测试频率结果叠加24次。当2000、3000、4000 Hz 3个频率的信噪比≥3 dB且超出其1倍标准差时为记录到DPOAE,反之则为未记录到。
耳蜗微音电位:患儿在经过水合氯醛镇静后,于睡眠状态进行测试。测试仪器采用美国INTELLIGENT HEARING设备,使用校准后的标插入式耳机(ER3A)经耳道给声刺激,当80dB nHL未引出反应或波形缺失时,则以100 dB nHL clicks用疏波、密波两种方式进行CM s检测。如果在4 ms内记录到极性相反的波形且可通过捏管试验验证则判定为记录到CM,反之则为未记录到[12]。
1.2.2 术后开机及随访
12例ANSD患儿及45例对照组患儿均在术后1个月于我科人工耳蜗中心由同一组经过统一规范化操作的测试人员开机,所有患儿开机过程顺利,均未出现不适表现。所有患儿均定期于我科耳蜗中心由同一组人员进行耳蜗调试。对患儿术后进行听觉行为分级标准量表(categories of auditory performance,CAP)、言语可懂度分级标准量表(speech intelligibility rating,SIR)问卷评估,评估时间为开机后0个月、1个月、3个月、6个月及1年、2年、3年。
2 结果
根据ANSD诊断标准,最终有46例患者入组,其中,男性22例,女性24例,年龄为0-36岁,平均年龄3.46岁。其中18例为单侧发病,占39.13%。表1为其听力学检查DPOAE、CM的基本情况。74耳均有DPOAE结果,其中36耳可记录到有意义的DPOAE,38耳未记录到,阳性率48.65%;9耳CM未查,可记录到重复的CM有61耳,4耳未记录到,阳性率93.85%。CM的引出率更高。

表1 ANSD患者DPOAE及CM引出情况Table 1 The situation of DPOAE and CM in ANSD patients
在所有患者中,7例患者影像学检查结果异常,其中,3例为听神经发育不良,1例为双侧前庭导水管扩大,1例为Mondini畸形,余双侧外中内耳均无明显异常。46例患者中,术后规律随访且随访时间达一年以上者共有16例患者。但其中4例为单侧ANSD患者,CI手术侧为非ANSD侧,故最终12例规律随访的ANSD患儿纳入最终结果。故最终12例规律随访的ANSD患儿纳入最终结果。这12例患者中,7例患者DPOAE可引出(其中3例患者CM未查,余均可记录到CM),5例患者DPOAE不可引出但CM可记录到。图一显示为12例患儿术后平均随访结果。从图1可以看出对于12例患儿,其听觉能力评估问卷CAP平均得分在开机一年后增长较一年内缓慢。对于评价言语情况的问卷SIR来说,其平均得分在开机后3个月内无明显增长,在开机后3个月到1年的时间增长较多,而在1年以后其增长速度逐年下降。如图2和图3所示,与结构正常且不伴有ANSD的极重度感音神经性听力下降儿童相比,其CAP和SIR问卷长期术后得分差异不明显。而AP问卷得分的差异较SIR问卷得分的差异略大。

图1 ANSD患儿CAP及SIR问卷随随访时间平均得分标准差Fig.1 The average score of CAP and SIR in ANSD patients(±s)
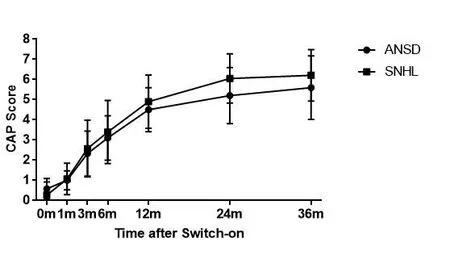
图2 ANSD患儿及极重度SNHL患儿人工耳蜗植入术后CAP问卷随随访时间得分标准差Fig.2 The average score of CAP in ANSD patients and SNHL patients(±s)

图3 ANSD患儿及极重度SNHL患儿人工耳蜗植入术后SIR问卷随随访时间平均得分标准差Fig.3 The average score of SIR in ANSD patients and SNHL patients(±s)
根据DPOAE是否引出,分为DP+组和DP-组,分别比较两组的CAP和SIR的得分。如图2和图3所示,两组差异并不明显,同时在开机三年的时候两组的分数达到了相近的水平。

图4 DP+组与DP-组CAP问卷平均得分标准差的比较Fig.4 The comparation of CAP scores in DP+group and DP-group(±s)

图5 DP+组与DP-组SIR问卷平均得分标准差的比较Fig.5 The comparation of SIR score in DP+group and DP-group(±s)
3 讨论
本研究中,DPOAE在48.65%的耳被记录到,但有一半以上ANSD耳中未引出,这可能于DPOAE的引出受中耳状况的影响。因为在未记录到DPOAE的38耳中,226Hz声导抗为B、C、正压型共9耳。本文作者在行ANSD听力学特征的研究结果显示:当未引出DPOAE时,并不能说明外毛细胞功能完全消失,可能是其部分功能受损,导致释放的声能降低,而不能被记录到[13]。因此,本文中38耳未引出DPOAE,并不能说明其不为听神经病,可能是由外毛细胞功能部分受损或者中耳功能对其的影响等因素造成。而CM是产生于耳蜗毛细胞的极化和去极化过程中的电位,属于神经前反应,从外耳道或头皮可记录到,主要由耳蜗外毛细胞的活动引起,另外一部分可能是由内毛细胞引起[14]。本研究中DPOAE引出率为48.65%,CM引出率为93.85%,这与Mo等学者的研究结果相似[15]。
此外,本研究结果中ANSD患儿人工耳蜗植入术后效果与同年龄段不伴有畸形的极重度感音神经性听力下降患儿术后听力康复效果未见明显差异,该结果与Breneman等人的研究一致[16]。其原因可能为样本量过小,而对于突触后病变对其的影响没有表现出来。
本研究的12例患者中,4例患者在开机3年后,CAP评分达满分,可以和认识的人打电话;2人在开机3年后SIR达到满分,即其口述的连贯言语可被所有聆听者听懂,即使是在日常语境中,患儿的言语也很容易被聆听者理解,取得了较好的效果。而这个结果较Liu等[17]报道的结果差(经过10-84个月的随访,60%的患儿CAP问卷最终达到满分,90%SIR问卷得分在3分以上)。该差异可能由于随访时间差异所致。本回顾性研究病例的平均随访时间为36个月,且平均约2岁(24.67月)时植入CI,随访时间最长36个月,远较Liu等[17]报道的随访时间10-84个月明显短。但本研究中仍然有2人在术后三年CAP评分达3分,另外3人术后3年SIR达3分,均达到了可鉴别环境声、连贯的言语可被聆听者听懂,但需聆听者了解对话主题,同时集中注意力并结合唇读,效果明显差于达到满分的患儿。就ANSD患儿术后CAP和SIR得分趋势及分数而言,虽然DPOAE未引出组和DPOAE引出组的结果基本相近,但由于样本量较少,未进行统计学分析,只能初步推测ANSD患儿人工耳蜗术后长期效果可能与DPOAE是否引出可能没有相关性。因此,对于ANSD患儿人工耳蜗植入术后效果具有个体差异。这可能与基因型,病变位置为突触前抑或突触后等因素有关而与DPOAE是否引出可能无关。
本研究使用两种问卷通过对ANSD人工耳蜗术后患儿听觉能力和言语可懂度进行评估来评价患儿的听觉言语康复效果。患儿在开机一年内听觉及言语能力均有显著提高,而在1-3年时,其增长较一年内缓慢,提高程度较一年低。就个体而言,ANSD患儿人工耳蜗术后效果具有明显的个体差异,其可能的原因与基因型、病变部位等有关,因此对于ANSD患儿需要建立合理的期望值。而本研究中ANSD患者与正常人工耳蜗术后患儿听觉言语发育趋势基本一致,这可能因为ANSD样本量过小,对于突触后病变对人工耳蜗植入术后效果的影响未能表现出来。后续研究应该增加样本量,并对于达到可进行言语测试的患儿进行言语测试来评估效果,并结合基因型来探讨其术后效果的影响因素。

