慢性乙型肝炎治疗新药相关研究进展及思考
聂青和 龙振昼
空军军医大学(第四军医大学)唐都医院感染病科/全军感染病诊疗中心,国家重点学科 (陕西 西安, 710038)
全世界大约有2.57亿慢性乙型肝炎病毒(HBV)感染者,由于HBV感染目前仍无法获得完全治愈,这些HBV感染者面临严重肝病并发症及肝癌的威胁,甚至导致每年超过88.7万人死于HBV相关疾病。大约40%以上的肝细胞肝癌(HCC)与慢性乙型肝炎(CHB)有关,HCC在世界范围内的癌症相关死亡率中排第2位。在HBV的治疗方面,乙型肝炎疫苗对已经存在的HBV感染没有任何效果;被各国批准用于CHB的抗病毒治疗用药则分为两大类:一类是长效干扰素(PEG-IFN),另外一类是口服的核苷(酸)类似物(NAs)。具体的用药策略包括单药或者联合用药,联合用药还包括药物的序贯用药。
现有的核苷(酸)类似物(NAs)药物要达到完全抑制HBV复制这个目标基本没有什么问题。想要达到临床治愈的目标,在某些特定人群中使用PEG-IFN联合NAs也已经取得了比较满意的效果,尽管各国报道的治愈率不太一致。而想要达到完全治愈,也就是彻底清除肝细胞内的闭合、共价、闭合环状DNA(cccDNA)的目标,以目前的条件来看,几乎是不可能的。正因为如此,即使成功地抑制了HBV复制的患者,仍然有发生HCC的风险,特别是有肝硬化背景的患者。
1 HBV的生活史研究进展
HBV完整的生活史包括黏附、进入、脱壳、入核、cccDNA产生、转录、翻译、衣壳化、病毒组装和分泌等。对HBV生命周期的探索,尤其是在涉及到病毒的生源论、体内平衡和cccDNA库的更新等领域的认识不足,是治愈CHB研究的主要障碍所在。
近年来,随着科学技术的进步,也有一些HBV理论研究的突破。比如,2012年发现的牛磺胆酸钠共转运多肽(NTCP),是 HBV进入肝细胞所必须的受体,使人们乐观地认为治愈CHB的目标不久就会实现[1]。NTCP和原代人肝细胞、人肝癌细胞系、瞬时转染系统、稳定转化细胞系、人诱导多能干细胞源性肝细胞样细胞等可利用的系统,以及人源化小鼠一起,推动了多样化细胞培养模式的发展,使完整的HBV复制周期的再现成为可能[2]。对HBV的生源论、体内平衡和cccDNA转录模板衰减控制机制的系统研究信息,有助于找出cccDNA复制机制的薄弱环节,进而探索从感染细胞中清除HBV的方法。
HBV感染时的年龄与感染的慢性化密切相关。婴儿期感染HBV的人,超过90%会由急性肝炎发展为终生的慢性病毒感染状态;如果在成年期感染HBV,则有超过90%的人会因为强大的免疫反应而清除感染的细胞,也可能产生中和抗体并提供长期的保护作用。
一旦HBV慢性感染状态确定,患者就有发生慢性肝炎、肝硬化和肝细胞癌的风险。慢性HBV感染的自然史通常包括5个阶段:免疫耐受期(HBeAg阳性、高水平的血清HBV DNA、ALT正常和最轻微的组织病理改变)、免疫清除期(HBeAg阳性、逐渐下降的血清HBV DNA水平、ALT升高和增加的组织病理学改变)、免疫控制期(抗-HBe阳性、低水平的血清HBV DNA、ALT正常和最轻微的组织病理学改变)、变异HBV的免疫清除期(HBeAg阴性、ALT升高、加重的肝炎活动和高水平的血清HBV DNA)和恢复期(HBsAg阴性,伴或不伴抗-HBs阳性)。这5个阶段的HBV复制水平、病毒抗原表达和肝脏的炎症活动都是不一样的,在治疗的时候要采取不一样的策略。
每年大约有1%的慢性HBV感染个体会发生HBsAg的自发转阴,这为HBV感染的药物和免疫控制提供了可能。然而,慢性和急性HBV感染状态的康复并不意味着HBV的完全清除。因为这些人体内仍然有少量cccDNA阳性的肝细胞长期存在,而这可能是会使一些免疫抑制个体最终发生HBV重新激活、复制[3]。
因此,如果要从感染的细胞中清除HBV的cccDNA,或者控制其表达,需要对cccDNA生源论和体内平衡的机制有更进一步的认识。
2 CHB治愈的策略
CHB的治愈是一个复杂的课题,因为这涉及到HBV感染的控制、HBV及其相关基因的清除,以及HBV相关肝病问题的解决。既往对CHB治愈的关注点主要集中在HBV感染的治愈,包括HBV的清除、控制病毒复制,以及诱导宿主的免疫反应去清除感染HBV的细胞,从而防止HBV感染向其他健康细胞的扩散等。HBV感染治疗的多种需求催生了多种治愈模式的概念。
2.1 治愈模式的概念
2.1.1 完全治愈 血清中检测不到HBsAg,清除了体内所有的HBV DNA(包括cccDNA和与肝细胞内的基因整合的HBV DNA等),完全治愈很难通过现有的检测手段来确定。
2.1.2 临床治愈 指持续的血清中HBsAg和HBV DNA检测不到,伴或不伴乙肝表面抗体的产生,而肝细胞内还存在低水平的cccDNA和与宿主基因整合的HBV DNA。
2.1.3 部分治愈 在一个有限的治疗疗程结束之后,体内可以检测到HBsAg,但是HBV DNA血清中持续检测不到,生化和组织学改变恢复。
由于目前还不可能从所有感染HBV的肝细胞中清除cccDNA库以及整合的HBV DNA,使得临床治愈成为一个更为切实可行的治疗目标。
2.2 HBV治愈的相关研究领域 2019年,美国国立卫生研究院(NIH)制定了新的“治愈”CHB的战略计划,强调要侧重于3个关键领域的研究。
2.2.1 HBV的基础研究 包括HBV的生物学、发病机制、免疫、再激活、传播的病毒和宿主因素,以及与其他肝炎病毒合并感染的影响等。
2.2.2 开发共享的研究工具和资源 比如实验设计、方法的开发和标准化,动物模型的建立,疾病进展研究、母婴传播的过程和生物标志物的检测等。
2.2.3 改进治愈和预防CHB的策略 如阻断HBV复制、诱导抗HBV免疫反应、清除被HBV感染的细胞等。
3 CHB治疗新药进展
3.1 CHB新药的临床试验 目前的抗病毒治疗并不能治愈CHB,主要是因为cccDNA库的持续存在,这种HBV的转录模板是病毒感染的过程中在肝细胞核内形成的。现有的被批准用于治疗CHB的抗病毒药物包括聚乙二醇干扰素-α(PEG-IFN α-2b, 1991和PEG-IFN α-2a, 2005)和6种核苷(酸)类似物,它们分别是拉米夫定(Lamivudine, 1998)、阿德福韦酯(Adefovir dipivoxil, 2002)、恩替卡韦(Entecavir, 2005)、替比夫定(Telbivudine, 2006)、替诺福韦(Tenofovir, 2008)、丙酚替诺福韦TAF(Tenofovir allafenamide, 2016)[4]。
以上是经美国FDA批准的抗HBV药物。美国以外,2017年韩国也曾上市一款乙型肝炎新药马来酸贝西福韦(Besifovir dipivoxil maleate, BSV)[5],也是一种抑制HBV DNA多聚酶的药物,研究认为48周的用药效果与替诺福韦相当,但对肾和骨骼的安全性似乎更好。
其他研发中的药物尚没有一种进入Ⅲ期临床试验。HBV进入抑制剂Myrcludex B 和Morphothiadin、JNJ 56136379、ABI-H0731等衣壳抑制剂仍处于临床Ⅱ期。干扰和破坏病毒RNA的小干扰RNA(Small interfering RNA, SiRNA)药物如VIR-2218,能结合病毒mRNA而防止其翻译成病毒蛋白的反义分子药物如IONIS-HBVRx,HBsAg分泌抑制剂如REP 2139和REP 2165,单克隆抗HBsAg抗体GC1102和RIG-1/NOD-2兴奋剂都处在Ⅱ期临床试验中,免疫调节剂如Toll样受体兴奋剂、细胞凋亡-1抑制剂和一些治疗性的疫苗也在用于增强固有和适应性免疫以控制HBV感染,目前还处在临床Ⅰ期。目前,一些临床试验也在评估联合治疗的协同或额外效果[6]。
2020年8月,国际乙型肝炎基金会(Hepatitis B foundation)网站更新了CHB新药的进展,尽管没有太大的突破,但是CHB新药的研究还是有一些好的消息。比如3个CHB新药的出现:治疗性疫苗VTP-300进入临床Ⅰ期,新型肽段GV1001和口服微生物组药物CP101进入临床前研究。部分新药研究也有一定的进展,如衣壳抑制剂ABI-H2158进入临床Ⅱ期,治疗性疫苗VBI-2601从临床前研究进入临床Ⅰb/Ⅱa期研究,第二代衣壳抑制剂ABI-H2158和RNAi药物JNJ3989(ARO-HBV)均进入临床Ⅱ期研究。虽然还未有新药进入CHB临床Ⅲ期研究,但未来可期,新药联合现有药物——NAs和PEG-IFN α的研究仍在继续,一些高临床治愈率的进展预示着新老药联合的可行性,相信不久的将来,全面临床治愈时代将会来临[7]。
3.2 乙型肝炎新药的分类
3.2.1 直接抗病毒药 直接抗病毒药(Direct-acting antivirals, DAAs)的作用原理主要是靶向病毒并干扰HBV复制过程,包括干扰和破坏病毒RNA的沉默RNA类药物(siRNAs)、干扰HBV进入肝细胞的进入抑制剂、干扰HBV DNA蛋白形成的衣壳抑制剂、干扰HBsAg产生的HBsAg抑制剂,以及与病毒mRNA结合以防止病毒蛋白形成的反义RNA药物等。
3.2.2 间接抗病毒药物 设计原理主要是靶向人体的免疫系统,来诱导免疫细胞、细胞因子等来攻击HBV。曾经最热门、一直被人们寄予厚望的治疗性疫苗就属于这一类药物,这是把疫苗技术用作激活人体的免疫系统的一种治疗理念;激活先天免疫系统的化合物如Toll样受体激动剂,属于先天性的免疫防御途径;而诱导程序性细胞死亡(凋亡)的化合物,则属于宿主作用的治疗途径[8]。此外,还有基因编辑在药物设计上的应用类药物、HBsAg单克隆抗体、PD-L1及其抑制剂、T细胞免疫治疗、MicroRNA、FXR激动剂、反义锁核酸技术、新型肽段、核酸直接杀伤HBV感染细胞、口服微生物制剂等(表1)。
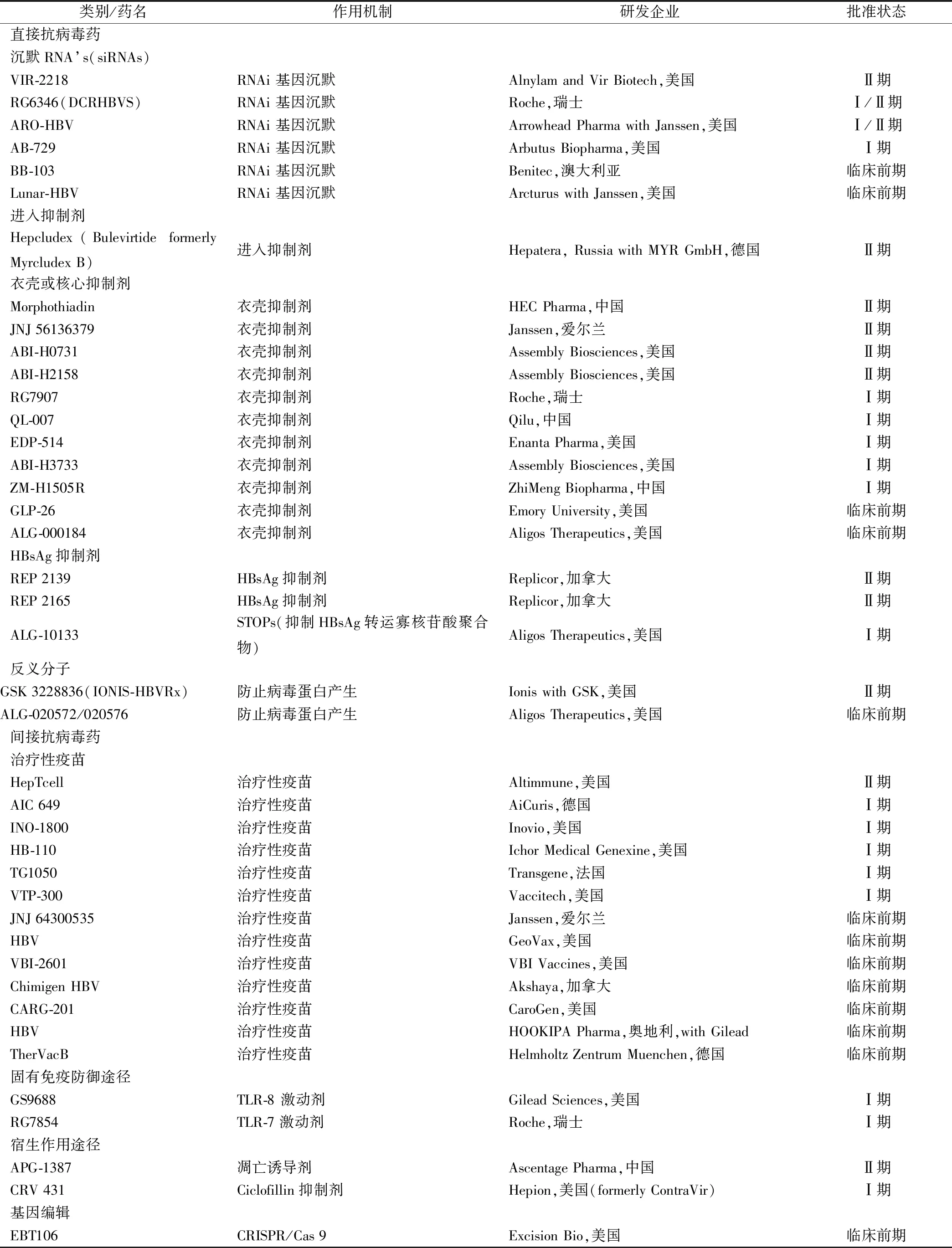
表1 目前经批准在研的各种乙型肝炎新药(更新至2020年8月)
3.3 部分新药简介
3.3.1 ALN-HBV02(Vir-2218) VIR-2218为皮下注射药物,是使用乙型肝炎在研全新靶点的RNAi技术,即RNA干扰类药物,目前处于临床Ⅱ期研究阶段。欧洲肝病学学会(EASL)最近公布了两项VIR-2218的研究进展。其中,临床前研究显示VIR-2218靶向HBV基因组的高度保守区域,在体外试验中证实有针对HBV的泛基因型效应。同样,VIR-2218在AAV-HBV小鼠模型中显示出有效、持续的抗病毒活性。这些数据将是VIR-2218用于治疗HBV感染患者的有力证据。最新的摘要还同时公布了VIR-2218的在健康受试者身上进行的临床Ⅰ期研究结果,研究显示VIR-2218支持皮下注射给药,在健康受试者中表现出良好的药代动力学特性,目前正在进行评估VIR-2218对HBV感染患者的疗效研究。
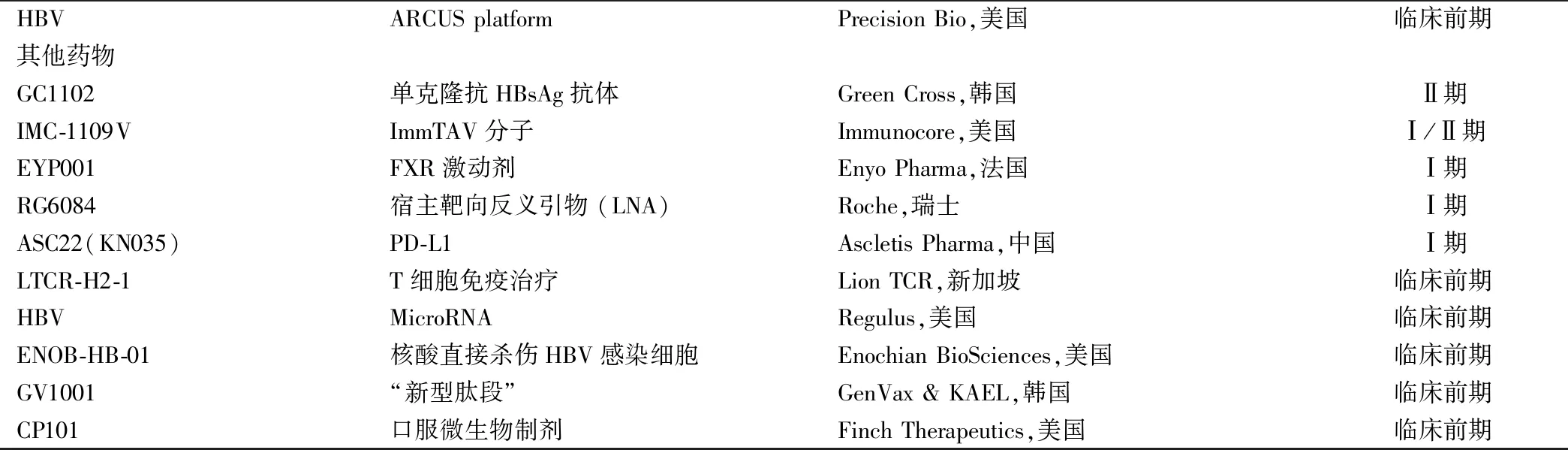
续表1
3.3.2 Hepcludex(Bulevirtide) Hepcludex是病毒进入抑制剂(原名Myrcludex B),开发用于治疗慢性HBV和丁型肝炎病毒(HDV)感染患者,该药能抑制肝细胞表面的HBV/HDV受体NTCP,并防止再生细胞的感染和病毒在肝内的传播。2020年8月4日,德国MYR Pharmaceuticals生物技术公司宣布,欧盟委员会(EC)已授予其先导药物Hepcludex(bulevirtide)在欧盟地区的有条件营销授权(CMA)用于成人慢性HDV感染和代偿性肝病的治疗。此次CMA批准是基于2个Ⅱ期研究(MYR202和MYR203)的结果,数据显示Hepcludex治疗丁型肝炎期间,显著降低了病毒血症并改善了肝功能,同时具有良好的耐受性和安全性。目前正在开展一项评估Hepcludex长期治疗的Ⅲ期HDV研究,以及一项评估Hepcludex与聚乙二醇干扰素联合应用的Ⅱ期HDV研究,而用于CHB的研究则处于Ⅱ期临床试验中。
3.3.3 VTP-300 VTP-300是利用疫苗技术的异源初免-增强方案(heterologous prime-boost regimen)的病毒载体ChAdOx-MVA的3种全长HBV抗原,诱导机体产生有效的特异性免疫应答,主动打破原有免疫耐受状态,实现诱导应答过程,从而清除体内HBV。这是一种新型的HBV治疗性疫苗,已显示可在小鼠中诱导强大而广泛的抗HBV CD8+和CD4+T细胞和抗体反应。该药临床Ⅰ期首位受试者完成了用药。
3.3.4 VBI-2601 VBI-2601是一种新型重组蛋白免疫治疗候选药物,目前正在进行对CHB的治疗研究。该药侧重于诱导和维持广泛有效的针对HBV的免疫力,通过多种关键作用机制靶向B细胞和T细胞免疫力的独特潜力,包括中和HBV,通过Pre-S1免疫阻断肝细胞感染,并能通过免疫介导的方式清除感染HBV的肝细胞。
3.3.5 ABI-H2158 第二代衣壳抑制剂ABI-H2158已进入临床Ⅱ期研究,该药物已于2020年5月21日完成登记。该药临床Ⅰ期研究结果显示,ABI-H2158治疗的受试者的HBV DNA和HBV RNA水平均有较快速的下降,该药具有较强抗HBV活性,受试者均表现出对ABI-H2158较好耐受性。
3.3.6 GV1001 GV1001是一种新型肽段,是抗原提呈细胞的树突状细胞把外来肽(GV1001)通过吞噬细胞作用引入到细胞内,在细胞内经过溶酶体的溶酶作用而分解。这时,被树突状细胞的MHC受体分解的肽的一部分提呈在T细胞上,提呈过程是通过MHC受体和T细胞受体(T cell receptor, TCR)相结合的过程中形成。被树突状细胞提呈的抗原(GV1001)可诱发T细胞的活性和增殖,被激活的T细胞在血液循环中识别癌组织的癌细胞中高表达的端粒酶,并选择性地清除癌细胞。GV1001除了癌症以外,在前列腺增生症及阿尔茨海默病等多种适应证中证明了抗炎、抗氧化、调节激素作用等附加效果。
3.3.7 CP101 CP101是一种研究性口服微生物组药物,最初旨在预防复发性复杂梭菌感染(rCDI),目前也在评估其治疗慢性HBV感染的能力。CP101旨在恢复微生物组的组成和功能。有研究表明,微生物组功能障碍可能会介导CHB,多项独立的临床研究表明,微生物群移植可清除长期抗病毒治疗后HBeAg仍为阳性的CHB患者中活跃的HBV。
3.3.8 IMC-I109V 基于T细胞受体(T cell receptor,TCR)改造的ImmTAC平台,ImmTAC全称Immune mobilising monoclonal TCRs Against Cancer,即抗肿瘤免疫激动单克隆T细胞受体,它本质上属于一类新型的双特异性生物大分子,是由工程化改造的TCR以及抗CD3的scFv组成。在传染病方面,该公司将其TCR技术平台应用于病毒或细菌(ImmTAV或ImmTAB),IMV-I109V即对应的CHB的相关新药。EASL2020最新摘要公布了该药临床前研究的研究进展,结果显示ImmTAV分子可有效、特异性地消除感染HBV的细胞。其中主要的ImmTAV分子——IMC-I109V现已通过临床前研究数据支持首次人体试验。这些数据提供了新颖的免疫治疗策略的证据,该策略旨在为慢性HBV感染患者实现快速的功能性治愈。
4 CHB治愈的思考
在一项对黑猩猩的研究中显示,在急性HBV感染的自愈过程中,尽管同时也有非细胞途径参与清除HBV,但几乎所有感染的肝细胞均能被CD8+T细胞所清除。通常只有小部分感染HBV的细胞会最终存活下来,但感染之后所产生的抗HBs能够防止新的细胞继续感染。类似的机制几乎自然地发生在每年成千上万的急性HBV感染人类当中[9]。这种HBV清除的状态,目前还没有可以利用的治疗方法能够在慢性HBV感染患者当中实现。这个结果提示,治疗HBV感染不一定需要完全清除病毒才能够获得长期的病毒控制。
尽管如此,治愈性的HBV治疗药物对慢性HBV感染者来说,可能是达到理想目标的更好办法。如果能诱导出类似于急性HBV感染或部分慢性HBV感染自愈患者的类似反应,对于患者来说,或许是一个更安全的治疗策略。
对于CHB的治愈,cccDNA的清除是最直接和有效的策略。目前的抗病毒药即使长期服用,也不能清除cccDNA,甚至在体外试验和动物模型中都无法做到。通过对细胞因子水平的动态观察发现,α干扰素可诱导APOBEC依赖的HBV DNA脱氨基作用,这引发了是否能导致cccDNA持续减少的关注[10]。而使用CRISPR/Cas9或其他基因编辑的方法直接靶向cccDNA,在实验研究中显示出有前途的结果,但如何精准定位肝细胞、靶向失败后的效应,如何避免等问题,依然让人担心一些不可预料的后果[11]。这些风险和困难的存在,使得靶向病毒或宿主蛋白的方法在影响cccDNA的形成、稳定和表达等方面,仍然需要进一步研究。目前基础研究的进展使得了解HBV完整的复制过程成为可能。我们认为这些成果将有助于CHB的治愈,而cccDNA的清除可能是唯一有潜力达到安全、持久的HBV感染治愈的策略。

