胸腹部孤立性纤维性肿瘤CT和MRI影像学特征及诊断价值
江汉大学附属湖北省第三人民医院放射科(湖北 武汉 430030)
秦 涛 刘良进* 曾艳妮 汤 珩 豆永升 余 勇
孤立性纤维性肿瘤(solitary fibrous tumors,SFTs)是一种少见的间叶来源性梭形细胞肿瘤[1]。本病最初被认为起源于胸膜间皮细胞,后经病理学及免疫组织化学证实SFTs起源于树突状间叶细胞,具有分化特性。具体表现在向纤维母细胞、肌纤维母细胞、血管外皮细胞及血管内皮细胞分化[2]。SFTs临床特征表现为无明显特异性,任何年龄阶段均可发病,常见病位包括胸膜、鼻腔、口腔及腹膜。临床症状表现有无痛性肿块、副肿瘤综合征、低血糖及甲状腺功能低下[3]。胸腹部SFTs较其他类型常见,恶性常伴有核型异常[4]。SFTs极容易误诊,因此术前诊断与鉴别显得尤为重要。CT、MRI现已广泛用于诊断胸膜部各类疾病,其诊断价值受到肯定。本研究选取我院2013年1月至2018年12月收治的胸腹部SFTs患者,分别使用CT及MRI进行诊断,现将研究结果报道如下。
1 资料与方法
1.1 一般资料 随机选取我院2013年1月至2018年12月收治的胸腹部SFTs患者80例,其中男性47例,女性33例,年龄18~69岁,平均年龄(52.59±10.25)岁,病程1~6年,平均病程(3.26±1.57)年。症状:咳嗽12例、低血糖10例、胸痛24例、咳痰30例、副肿瘤综合征4例。
诊断标准:(1)CT诊断标准:参考第五届中国肿瘤学术大会暨第七届海峡两岸肿瘤学术会议、国际肿瘤细胞与基因治疗学会会议、第二届中日肿瘤介入治疗学术会议(2008年)制定的关于胸腹部孤立性纤维性肿瘤相关标准。(2)MRI诊断标准:参考2013版WHO软组织肿瘤新分类新增肿瘤中关于MRI诊断胸腹部孤立性纤维性肿瘤相关标准。
纳入标准:知情同意;病理确诊;成年患者;对比剂不过敏;接受手术患者。
排除标准:近期内有过腹部手术患者;妊娠期、哺乳期患者;胸腔播散或种植患者;合并其他肿瘤患者;ICU患者;脓毒症患者。
1.2 方法 所有患者先后行CT及MRI。CT检查:仪器选择飞利浦64排CT诊断仪,扫描架孔径≥70cm,0.5°变化,每秒1排探测速度。垂直扫描最低速度≤2.5mm/s,最高速度≥50mm/s。球管最大电流≥500mA,最小电压≤80kV。层厚7mm,螺旋距1.0。选取患者仰卧位进行全腹部冠状扫描确定兴趣区域,进行常规扫描。注射碘海醇对比剂(由扬子江药业公司提供,生产批号:11112821)后进行增强扫描,碘海醇流速为3mL/s,用量为1.5mL/kg。建立标准图像矩阵,开启双定位模式。层间距3mm。
MR检查:休息24~48h接受MRI检查,仪器选择GE signa HDxt 1.5T磁共振诊断仪。择体部线圈行横断面常规扫描,建矩阵256×256,层厚8mm,层间距0.8mm。T2加权成像,TR范围2500~400ms,TE值90s。注射钆喷替酸葡甲胺对比剂(由北京北陆药业股份有限公司提供,生产批号:H20013088),剂量为30mL,流速为2mL/s,行三期增强扫描,扫描参数:FSE T2WI TR 1800ms,TE 68ms,FSPGR TR 200ms。
病理检测:经腹部腔镜手术治疗获取肿瘤组织2cm×2cm送实验室检查。病理良恶性诊断标准:参考WHO软组织肿瘤(2006年)病理学分类中关于SFTs诊断标准。良性:有明显的良性肿瘤形态学表现,且呈良性发展过程。恶性:细胞生长活跃,分布密集。核分裂多见,高倍视野>4个。出现肿瘤性坏死。
1.3 图像处理与分析 所有患者CT及MRI片由3名经验丰富的影像学医生审阅。主要对病位、规模、形态及边界、囊变、密度、钙化、出血、钙化、密度、良恶性等情况进行判断。
1.4 统计学方法 采用SPSS 23.0软件统计分析,以表示,比较采用独立样本t检验,计数资料比较采用χ2检验,检验水准以P<0.05表示数据比较结果差异有统计学意义。
2 结 果
2.1 80例胸腹部SFTs病理诊断结果分析 由表1可知,80例SFTs患者共检出97枚肿瘤。其中病位在肺内、胸膜、腹膜、后腹膜分布分别为40.21%、29.90%、23.71%、6.18%。平均肿瘤直径(15.68±2.69)cm,恶性肿瘤17例,比例为17.53%。
2.2 80例胸腹部SFTs患者CT、MRI与病理诊断结果比较 由表2可知,CT共检出83枚肿瘤,病位为肺内36例、胸膜20例、腹膜18例、后腹膜6例。MRI共检出96枚肿瘤,病位为肺内31例、胸膜24例、腹膜20例、后腹膜4例。MRI诊断胸腹部SFTs病位、肿瘤检出、肿瘤良恶性准确性显著高于CT(P<0.05)。
2.3 CT和MRI影像学特征分析 CT胸腹部SFTs特征:肺内肿瘤影像学表现为包膜相对完整。有肺内质肿瘤块影,边缘相对光滑,密度均匀。无分叶征集毛刺征,平均CT值(39.84±2.69)HU,平均肿瘤直径(16.59±3.879)cm。强化影像显示肿瘤轻度不均匀,无明确性肿大淋巴结影。胸膜病位肿瘤呈椭圆形或卵圆形,边缘清楚。仅有1例患者均布肿瘤与受压肺组织分界不清。一期增强扫描动脉期有明显血管样强化征,1例小片钙化病灶。腹膜病位边缘轻度强化,密度均匀,包膜完整。
MRI胸腹部SFTs特征(图1):肺内肿瘤信号相对均匀,包膜显示完整且光滑,T1、T2低信号,增强后有中度延时性强化现象。胸膜病位T2信号多变,分别表现为高、略高及低信号。高信号反映肿瘤同粘液样变区,略高信号反映了肿瘤细胞密集,低信号则为致密胶原纤维。高信号中片状及结节状是其典型表现。增强扫描发现病灶动脉期及实质期病灶呈中度渐进性强化。腹膜病位T1、T2低信号。
2.4 CT与MRI诊断SFTs的ROC曲线分析 MRI诊断胸腹部SFTs的AUC为0.741,CT诊断胸腹部SFTs的0.621,CT和MRI联合诊断SFTs的AUC为0.846(表3、图2)。

表1 80例胸腹部SFTs病理诊断结果分析[n(%)]

表2 胸腹部SFTs患者CT、MRI与病理诊断结果比较(%)
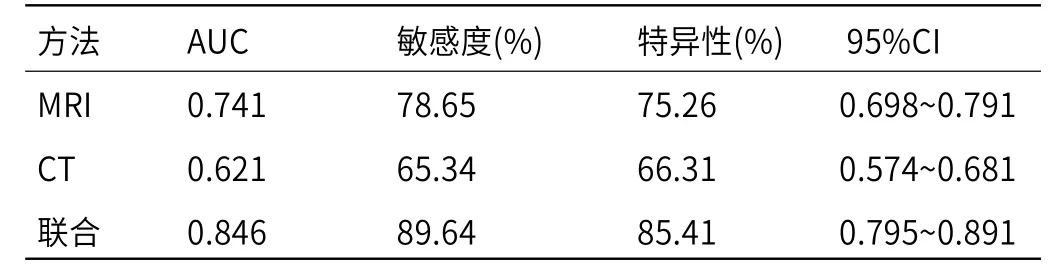
表3 CT与MRI的诊断SFTs的ROC曲线分析
3 讨 论
SFTs形态因病位不同而不同,胸腔内以孤立性肿瘤为主[5-7];表现为隆起于胸膜,呈息肉向腔内生长[8]。颅内SFTs多见于脑膜,与脑实质界限清晰。位于内脏器官及软组织的SFTs多为孤立性实质性肿瘤,呈圆形或不规则形状,边界清楚,颜色灰白[9-12]。SFTs形态学可见肿瘤细胞疏密相间分布。细胞密集区排列以束状、旋涡状为主;间质区以纤维组织增生为主。毛怡等[13]研究发现,SFTs组织学中有少部分病例肿瘤富于血管,且血管壁较薄,有分支状及裂隙状出现。超微镜下染色质致密,内有大量胶原蛋白,呈现纤维母细胞特点。SFTs临床及影像学表现无明显特异性,目前临床主要依靠病理形状学及免疫表型进行诊断。有研究认为,CT及MRI能发现SFTs病位、反映形态可作为指导临床治疗的重要方法[14]。64排CT能较好覆盖胸腹部,采集相关数据,方便建立多平面及多角度的影像,有助于手术定位。MRI能清晰分辨SFTs结构及侵袭范围,反映黏液样变及包膜等具体情况。MRI对较成熟型纤维组织有较准确的诊断价值。亦有研究表明,CT反映肿瘤内钙化方面有独特优势,较MRI准确[15]。
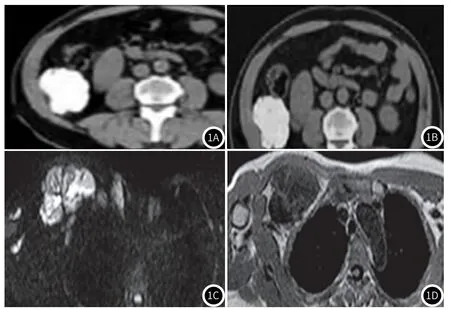
图1 CT和MRI影像学特征分析。1A-1B:CT 增强扫描门静脉期与延迟期影像,可见肿瘤边界清晰,未见压迫影像(右上腹);1C-1D:MRI影像T2高信号、T1略高信号,内见“树枝状”(右胸壁下)。

图2 CT与MRI的诊断SFTs的ROC曲线分析
本研究结果显示,MRI诊断胸腹部SFTs病位、肿瘤检出、良恶性准确性显著高于CT;MRI诊断价值高于CT,而联合诊断优于单CT、MRI。同时CT及MRI的影像学特点不同:CT影像学特征主要以均匀密度或略低密度为主,增强扫描则表现为肿瘤不均匀强化,瘤内可见血管影,MRI特征主要以T2高信号、T1高信号为主,排列呈编织状;由于SFTs无特异性极容易与其梭形细胞肿瘤进行鉴别诊断:⑴血管外周细胞瘤。SFTs与血管外周细胞瘤组织学及免疫组织化学特性相似,超微结构也有重叠部分。但血管外周细胞瘤无明显胶原纤维或间质玻璃样变区域,MRI能有效对其鉴别。⑵间皮瘤。SFTs与间皮瘤在形态及表达间皮标志相似,但间皮瘤有石棉接触史,伴有多发病灶、侵占肋骨。如某病例同时见到胸膜斑,则建议将其诊断为间皮瘤。⑶纤维肉瘤。SFTs与纤维肉瘤均有双向分化趋势,CT影像学特征相似,易误诊为恶性SFTs。
综上所述,CT与MRI均是胸腹部孤立性纤维性肿瘤重要诊断方法,但MRI在灵敏性、特异性及准确性方面优于CT,而CT在反映钙化病灶上优于MRI;MRI无辐射危险,较CT安全,可借助多序列检测方案提高对孤立性纤维性肿瘤组织分辨率,故推荐联合诊断。

