基于cGAS-STING信号通路调控小分子化合物的研究进展*
寇盟,蔡幸婷,李达谅
(福建师范大学生命科学学院,福建 福州 350117)
cGAS-STING信号通路作为先天免疫重要的组成部分,在抵抗病原体的入侵过程中发挥着重要的作用。cGAS通过识别病原体DNA激活先天免疫反应,产生一系列抗病毒作用因子,从而抵御病毒感染[1]。越来越多的证据表明,cGAS的过度活化是自身免疫炎症性疾病发生的诱因。细胞中DNA主要存在于细胞核和线粒体中,在某些病理条件下,自身DNA进入细胞质并在细胞质中积累,从而持续性激活cGAS-STING信号通路,诱发自身免疫性疾病的发生[2],而抑制cGAS-STING级联反应可以缓解自身免疫性疾病患者的症状。研究表明,巨噬细胞处理坏死的肿瘤细胞过程中,巨噬细胞cGAS-STING通路应答肿瘤细胞DNA,激活机体抗肿瘤免疫反应。此外,cGAS-STING和细胞衰老、癌症之间的调控关系已相继被揭示[3,4]。因此,开发调控cGAS-STING信号通路的小分子药物对病毒感染、自身免疫性疾病和肿瘤等疾病的治疗具有重要意义。本综述总结了近年来靶向调控cGAS-STING信号通路的小分子化合物抑制剂及激动剂,为靶向cGAS-STING通路的临床用药提供借鉴。
1 cGAS-STING 信号通路
1.1 环GMP-AMP合成酶cGAS
cGAS属于核苷酸转移酶(Nucleotidyltransferase,NTase)家族,包含1个核苷转移酶结构域和2个DNA结合结构域,其中核苷酸转移酶结构域是cGAS识别DNA并催化产生2’3’-cGAMP的必需结构域[5]。在没有DNA刺激的情况下,cGAS以自我抑制的状态存在,当细胞质中出现异常的dsDNA分子时,包括DNA病毒以及逆转录病毒的核酸或者细胞核及线粒体损伤产生的DNA,cGAS会与其结合,形成一个2∶2的复合物[6]。这导致了cGAS活性位点的构象改变,从而诱导转化三磷酸鸟苷(GTP)和三磷酸腺苷(ATP)形成2'3'环GMP-AMP(cGAMP)[7]。cGAMP作为第二信使,与位于内质网膜上的接头蛋白STING结合,使其构象发生变化,进而激活STING[8],接着STING从内质网通道进入高尔基体中,在这个过程中,STING的羧基末端招募并激活TANK结合激酶 1(TANK-binding kinase 1,TBK1),激活的TBK1会磷酸化干扰素调节因子3(interferon regulatory factor 3,IRF3),活化的IRF3易位到细胞核中并诱导I型IFN的表达[9]。同时,STING通过IκB激酶(IKK)的活性来激活转录因子(NF-κB),使NF-κB进入细胞核,与IRF3等转录因子共同作用,诱导干扰素和炎性细胞因子如TNF、interleukin 1β(IL-1β)、IL-6的表达[6]。
1.2 DNA识别通路的接头蛋白STING
STING又称为TMEM 173/MITA或ERIS,属于细胞内质网膜上跨膜接头蛋白,是I型干扰素产生过程中的重要接头蛋白,通过识别2'3'-cGAMP来激活下游信号通路[10]。在结构上,STING由氨基端的4个跨膜结构域和梭基末端结构域(Carboxyl-terminal domain,CTD)组成,并通过TM1-4锚定在内质网膜上[11]。C末端尾(Carboxy-terminal tail,CTT)与c-di-GMP结合结构域(c-di-GMP binding domain,CBD)相结合使STING在内质网(ER)上处于非活性状态[12],当cGAMP与STING结合后,引起了STING构象改变,从而导致STING通过ER与高尔基体中间区(ERGIC)进行运输[13,14]。最近,低温电子显微镜揭示了cGAMP激活STING的机制[15],cGAMP结合到STING的配体结合域导致了相对于跨膜结构域180个构象的改变,使得STING寡聚化和易位。这种STING的易位使C末端能够插入位于支架和二聚化结构域[15]以及相邻TBK1亚基的激酶域之间的TBK1的凹槽中[16]。STING寡聚作用对TBK1的激活至关重要,因为它可以使相邻的TBK1分子发生反式自磷酸化,而由于几何分子的限制,这一过程在其他情况下是不可实现的[9]。TBK1使STING的C末端磷酸化[16],为IRF3提供了一个对接位点,使被TBK1磷酸化激活的IRF3形成二聚体,并在激活后进入细胞核,与靶基因启动子结合,激活包括I型干扰素在内的基因转录[17]。I型干扰素会诱导干扰素刺激基因(ISGs)的表达,在抗病毒应答中起关键作用。
由于cGAS-STING信号通路对于机体先天免疫的重要性,接下来本文将从以下2方面进行介绍。
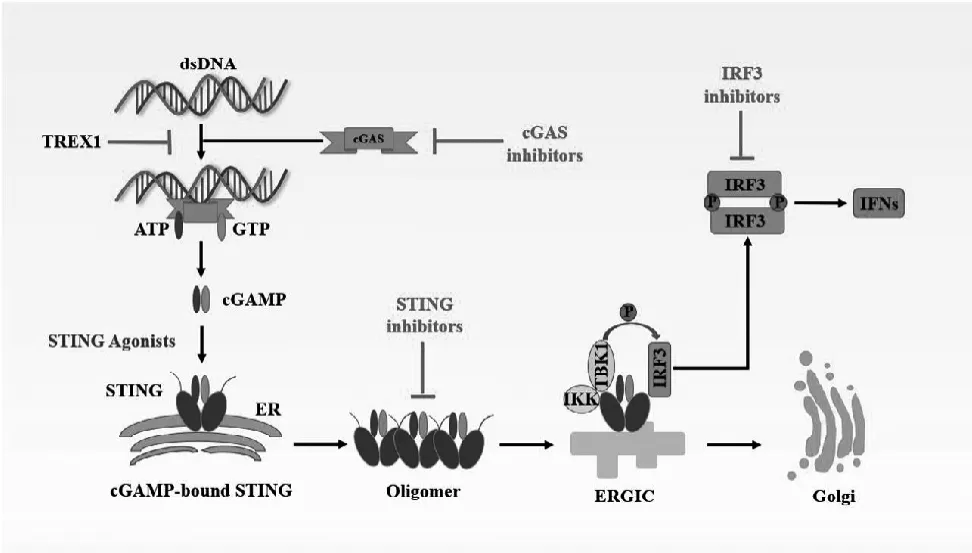
图1 cGAS-STING通路
2 cGAS-STING通路的直接调控
2.1 cGAS的小分子抑制剂
细胞中DNA通常被严格限制在细胞核和线粒体中,病毒侵染进入细胞质中病毒DNA具有很强免疫刺激性[18],能被cGAS快速检测到,从而引发抗感染的免疫反应[19]。然而,自身DNA也会在细胞质中积累,造成cGAS慢性激活,导致严重的自身免疫性疾
病,目前尚无有效的治疗方法。在由TREX1的功能丧失引起的系统性红斑狼疮(SLE)和Aicardi Goutières等炎性疾病模型中,cGAS的敲除能够有效地挽救这些致死性的自身免疫疾病,使其成为治疗这些疾病的理想靶点[2]。因此,越来越多的研究小组致力于开发cGAS抑制剂。以往的cGAS抑制剂的药物化学性质和生物学效应在其他综述中已详细讨论,在这里仅进行归纳不再进行综述[20]。cGAS的抑制剂见表1。
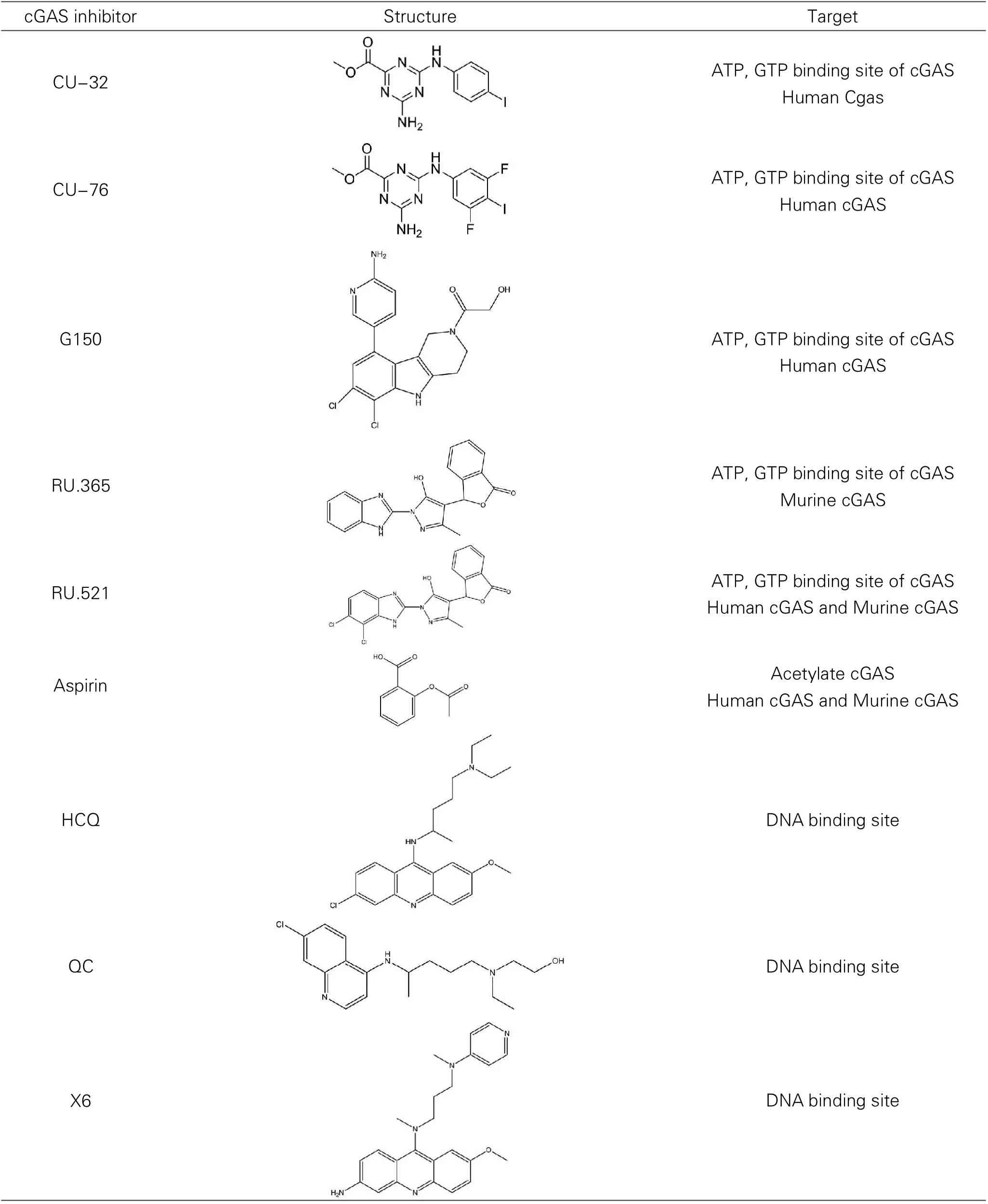
表1 cGAS小分子抑制剂
最近报道了2种人类cGAS(hcGAS)抑制剂,Rosaura等人[21]基于hcGAS的蛋--蛋白接口(proteinprotein interface,PPI)为靶点,针对cGAS/dsDNA复合物的药物文库进行高通量筛选来识别新的hcGAS小分子抑制剂。研究表明,CU-32和CU-76选择性地抑制人类细胞中的DNA通路,对RIG-I-MAVS或Toll样受体通路没有影响。2种化合物都呈剂量依赖性,IC50分别为CU-32[IC50=(0.66±0.10)μm]和CU-76[IC50=(0.27±0.06)μm]。这类小分子为开发具有潜在治疗应用的hcGAS抑制剂提供了一个新的化学支架,也为研究人类细胞中cGAS生物学和cGAS相关疾病提供了有效的小分子化学探针。
2.2 STING的小分子调节剂
2.2.1 STING的小分子抑制剂
STING的持续活化已被认为与单基因自炎性疾病的发病机制有关,如Aicardiu-goutieres综合征和STING相关性血管病变,起病于婴儿期[22]。最近,越来越多的证据表明,STING在一系列更复杂的炎症疾病中起致病作用[23],因此,STING是一个有吸引力的治疗干预靶点。STING抑制剂的药物化学性质和生物学效应在其他综述中已详细讨论,在这里不再进行综述[24]。STING 的抑制剂见表2。
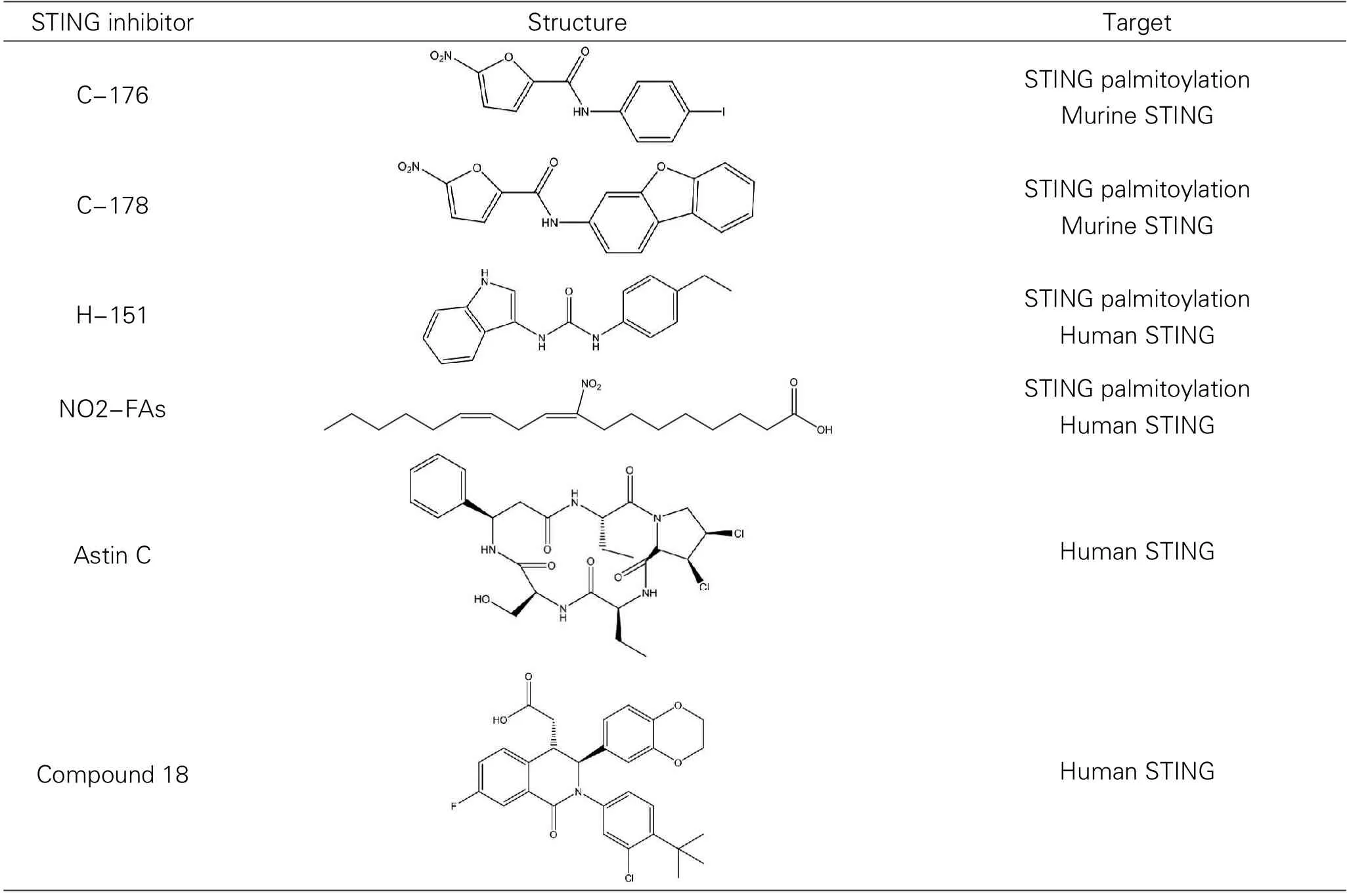
表2 STING小分子抑制剂
2.2.2 STING的小分子激动剂
激活cGAS-STING通路可以增强机体的免疫应答。最近发现了几种STING的激动剂,见表3。
Shi等人[25],通过基因组采集和生物合成的方法,发现新的含肉桂酰基的非核糖体肽(Cinnamoylcontaining nonribosomal peptides,CCNPs),从而从公共细菌基因组数据库中识别出51个假定存在的CCNP基因簇。在对菌株进行优先排序后,发现了一类新的C C N P 型糖肽, 命名为吉他霉素(kitacinnamycins),其中kitacinnamycins 8对STING表现出较强的激活能力。
Ramanjulu等人[26]使用放射标记的cGAMP和hSTING进行了竞争结合实验,报道了一种新型的氨基苯并咪唑(ABZI)的STING激动剂,该激活剂对STING亚基具有一定的结合亲和力,二聚后通过连接剂4碳丁烷(di-ABZI)使其结合的亲和力明显增强。此外,在人类PBMCs样本中,对di-ABZI诱导剂量依赖性激活STING和分泌产生的IFN-β进行分析评估半最大浓度(EC50)为130 nM。该小组已经在具有免疫能力的同基因结肠肿瘤小鼠中测试了STING的激动剂di-ABZI的抗肿瘤活性,静脉给药后结果显示肿瘤体积在彻底持久地消退。同样,最近一篇研究报道中的化合物24b,是一种氨基苯并咪唑的衍生物(EC50值为0.287μm),对建立的同系结肠肿瘤小鼠经静脉给药后也展现了显著的抗肿瘤作用[27]。 Pan等人[28],通过高通量细胞的表型筛选,鉴定了一种口服的非核苷酸的作用于人类和小鼠的STING的小分子激动剂,称为MSA-2。在同基因小鼠肿瘤模型中,皮下和口服MSA-2均耐受良好,可刺激肿瘤中IFN-β的分泌而诱导肿瘤消退,具有持久的抗肿瘤免疫,并能够协同抗PD-1的治疗。实验和理论分析表明,MSA-2在溶液中以互转化单体和二聚体这2种形式存在,但只有二聚体形式能够与STING结合并激活STING。因此,用合成共价模型对MSA-2二聚体进行了验证,发现MSA-2二聚体确实是STING的强有力的激动剂。此外,还发现在酸性肿瘤微环境中,MSA-2的细胞效能随着细胞外酸化而增强。以上这些特性都证明了MSA-2是一个适用于临床应用的有价值的STING激动剂。
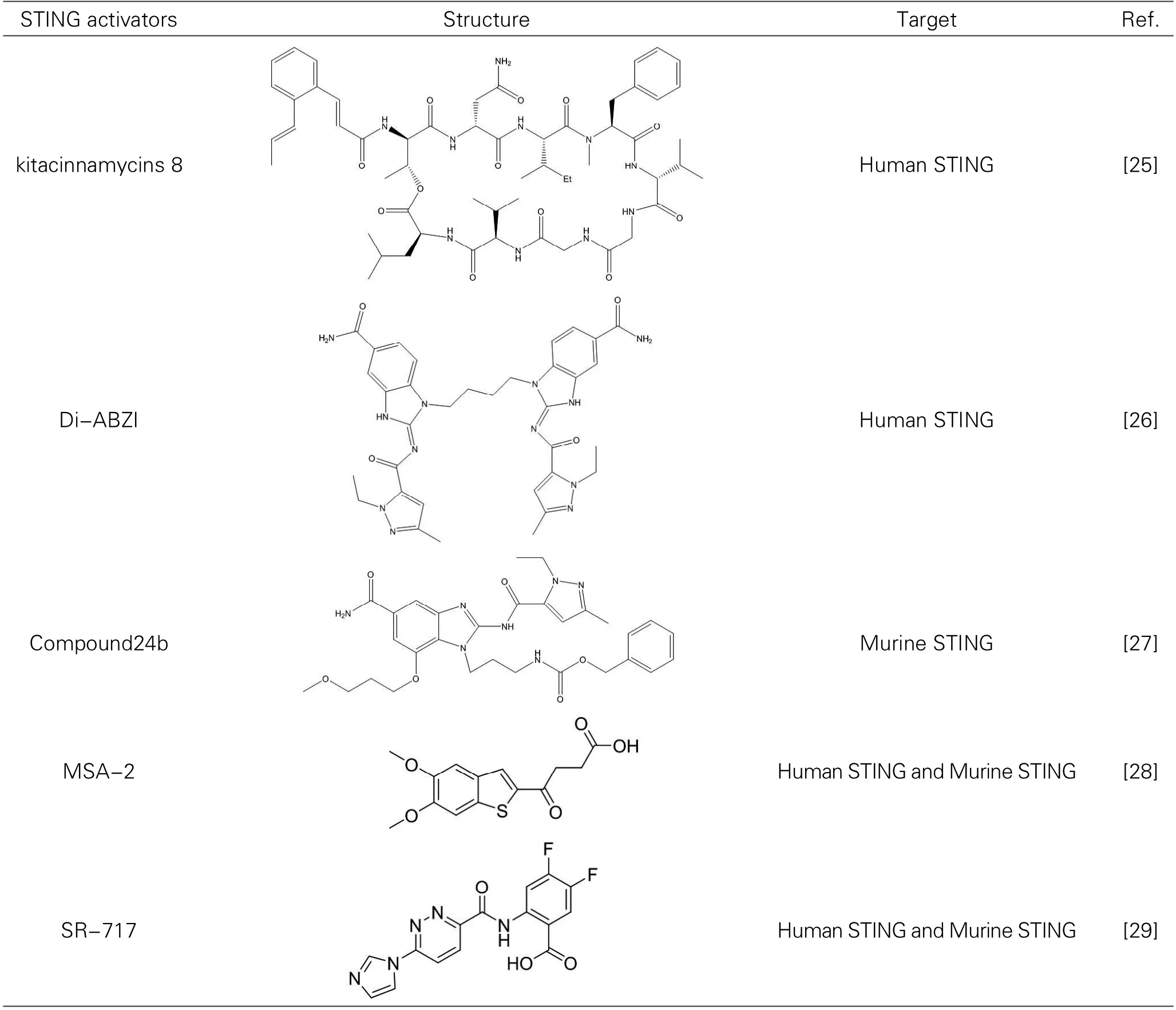
表3 STING小分子激动剂
Emily等人[29]使用cGAS-STING通路靶向细胞表型筛选方法来鉴定功能性非核苷酸STING小分子激动剂,发现了小分子SR-717,SR-717用0.18 nm共晶结构与h-STINGR232结合,是一种能够模拟cGAMP与STING结合方式的小分子激动剂,能够诱导STING的“封闭”构象。通过对重组人和小鼠STING (hSTING和mSTING)的蛋白热转移进行分析,SR-717可直接与靶点结合产生活性,展现跨物种活性和人类等位基因特异性。因此,SR-717表现出抗肿瘤活性和促进相关组织中CD8+ T细胞、自然杀伤细胞和树突状细胞的活化的功能,并促进了抗原的交叉启动。SR-717以STING为靶点诱导了相关基因的表达,包括程序性细胞死亡配体1(PD-L1),这对于临床试验具有重要的意义。
2.3 IRF3的小分子抑制剂
雷公藤红素(Celastrol,化学结构见图2)是从药用植物雷公藤中分离出来的最有效的生物活性分子之一,因其对包括系统性红斑狼疮和Aicardian -Goutieres综合征,或其他干扰素疾病在内的各种慢性疾病的潜在治疗价值而闻名。然而雷公藤红素潜在的作用机制尚不清楚。我们课题组发现雷公藤红素在体内外抑制干扰素调节因子3(IRF3)的激活,从而下调由细胞质DNA引发的干扰素反应。并且观察到雷公藤红素可以有效地抑制外源DNA诱导的IFN反应,IC50值为(145.7±23.6)nm。此外,用雷公藤红素治疗可显著改善TREX1-/-自身免疫性疾病小鼠模型的自身免疫表型,包括心肌炎、干扰素异常反应和自身抗体的产生,以及T细胞的过度激活。因此,雷公藤红素可抑制自身DNA介导的免疫反应,并具有治疗自身免疫性疾病以及干扰素相关疾病的潜力[30]。
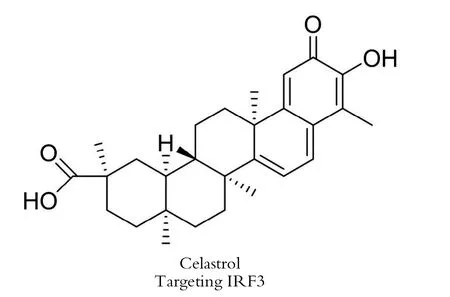
图2 雷公藤红素化学结构
3 cGAS-STING信号通路的间接调控
3.1 靶向BAF间接调控cGAS-STING信号通路
Guey等人[31]在各种细胞系中发现了BANF1编码的自整合障碍因子1(BAF)的下调可以引发强烈的干扰素应答。BAF是一种染色质结合蛋白,在有丝分裂结束时对核膜重组至关重要。研究者们通过使用单分子全内反射荧光(smTIRF)显微镜实时可视化监测发现BAF可以动态取代瞬时结合到cGAS单体上的dsDNA。这种机制抑制了cGAS-STING信号通路的激活,限制了异常的免疫反应,因此,通过抑制BAF来激活cGAS-STING信号通路,可能是一种有效的抗肿瘤策略。
Wanil Kim等人[32]发现Obtusilactone B(化学结构见图3)是一种丁醇内酯衍生物,纯化自珍珠绣线菊,可以作为BAF的小分子抑制剂,通过抑制牛痘相关激酶1(VRK1)介导的-碍-自整合因子(BAF)的磷酸化来调控BAF。其与BAF的特异性结合抑制了VRK1介导的BAF磷酸化和随后的DNA核膜解离,从而使BAF失活。另外,Seong-Hoon Kim等人[33]从豆科丛中分离到brazilin(化学结构见图3),证明它在体外和体内都抑制了BAF的磷酸化,同样通过抑制VRK1介导的BAF磷酸化从而使其失活。因此,有证据表明Obtusilactone B和brazilin可以作为一种间接调控cGAS-STING信号通路的候选小分子化合物。
3.2 靶向HER2间接调控cGAS-STING信号通路
Wu等人[34]通过双荧光素酶检测系统筛选到了酪氨酸激酶受体HER2(又称ErbB-2或Neu),发现HER1能有效抑制cGAS-STING信号通路。抑制机制主要是通过HER2胞内的结构域(ICD)与STI紧结合结合,同时活化后的HER2能够招募下游蛋白激酶AKT1,将AKT1引入STING后,在S510位点磷酸化TBK1,进而阻碍了STING与TBK1复合物的形成和TBK1 K63连接泛素化,从而衰减了STING信号。HER2减弱了由细胞质DNA传感引起的抗病毒防御,因此通过抑制HER2可能有效地激活cGAS-STING信号通路。
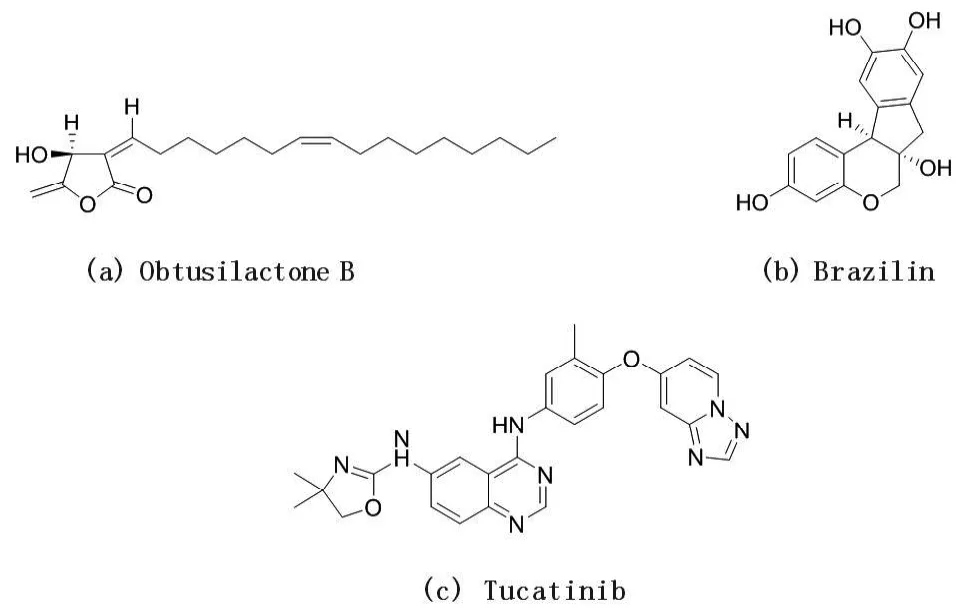
图3 间接调控cGAS-STING信号通路的候选小分子化合物
Kulukian等人[35]报道了一种新型的、高选择性的可口服靶向HER2的小分子抑制剂tucatinib(化学结构见图3),在生化和细胞信号转导实验中,tucatinib以纳米级效价抑制HER2激酶活性。故,可以通过tucatinib抑制HER2,进而间接调控到cGAS-STING信号通路。
4 结论与展望
近年来相关研究已经证明了cGAS-STING通路在抵抗细菌、病毒入侵和肿瘤生成方面的重要作用,因此,靶向cGAS-STING信号通路激活先天免疫,增强机体的免疫性能被科学领域认为是治疗癌症的希望。但cGAS-STING通路的异常激活,是引发炎症和自身免疫性疾病的主要诱因,如心血管疾病、炎症性肠病、系统性红斑狼疮、关节炎和牛皮癣等,因此研究开发cGAS-STING信号通路的有效且有选择性的激动剂和抑制剂药物是一项重要的任务。
同时,发现间接调控该通路的小分子化合物也将成为研究的热点,最近核小体抑制cGAS的机制[36-40]和环状RNA抑制cGAS-STING信号通路[41]被相继报道,鉴于此调节核小体和环状RNA的小分子可能会成为调控cGAS-STING信号通路的候选药物。
目前,在发现靶向cGAS-STING信号通路的药物方面有着较大进展,但是在对该通路的认识和调控能力方面还处于初级阶段,我们仍面临着许多的问题和挑战。在微生物感染和自身免疫性疾病的背景下,细胞质中的cGAS如何选择性的感知危险DNA,从而被有效激活的疑问仍然存在。cGAS活性的调控因子以及cGAMP是如何结合并诱导STING的激活,目前还没有明确的线索。STING是如何转运和降解以及激活下游激酶和转录因子的机制,还需要更深入的研究。
我们期望在未来可以看到在针对性调节cGASSTING信号通路的激活等各个方面有突破性的进展,并出现更多有效的药物用于临床治疗。

