全氟辛烷磺酸盐对小胶质细胞活化及放射损伤后海马记忆功能影响
王 媛,刘艳杰,颜 南,王正东,王梦露,沈超男
1.沈阳医学院附属中心医院 干诊内科,辽宁 沈阳 110024;沈阳医学院 2.医学应用技术学院;3.基础医学院;4.公共卫生学院,辽宁 沈阳 110000
放射线会激活小胶质细胞表达炎性因子,促进炎性反应,诱导神经元损伤和凋亡[1]。全氟辛烷磺酸盐(perfluorooctane sulphonate,PFOS)是一种常用的表面活性剂。有研究报道,PFOS已成为一种新型的持久性污染物,可在人体中富集,对神经系统产生毒性作用[2]。另有研究发现,PFOS会通过调节小胶质细胞诱导炎性反应,引起神经元损伤,通过海马体的脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)及其下游的酪氨酸激酶受体(tyrosine kinase receptor B,TkrB)诱导神经毒性[3]。但是,PFOS对放射后海马体损伤的影响尚不清楚。本研究旨在探讨PFOS对小胶质细胞活化及放射后海马体损伤的影响。现报道如下。
1 材料与方法
1.1 实验材料 清洁级雌性昆明(KM)小鼠40只,体质量(30±2)g,购自北京维通利华实验动物技术有限公司。放射源钴(60Co,GWXJ80型),水迷宫视频跟踪分析系统(泰盟科技有限公司,中国),酶联免疫吸附试剂盒和TUNEL凋亡试剂盒(碧云天公司,中国),免疫荧光染色抗体(Abcam公司,美国),PVDF膜(Bio-Rad公司,美国)。ECL试剂盒(Amersham,美国),显微镜以及激光共聚焦显微镜(Olympus,日本)。
1.2 实验分组 将40只小鼠随机分为对照组、放射组、PFOS组和放射+PFOS组,每组各10只。放射组和放射+PFOS组小鼠通过60Co照射,根据参考文献[4],将小鼠固定在距放射源80 cm的操作台上,通过铅孔垂直照射,避开眼睛等器官,照射剂量为15 Gy,隔天照射,进行2次,累积30 Gy。PFOS组与放射+PFOS组根据参考文献[5],使用PFOS干预,于照射前3 d和1 d腹腔注射PFOS,剂量为10 mg/kg,其他各组小鼠注射等量生理盐水。
1.3 水迷宫实验 建模后第7天通过水迷宫视频跟踪对小鼠空间记忆能力进行检测,逃避潜伏期越长、穿越平台次数越低提示神经功能损伤越严重,记忆力越差[6]。
1.4 酶联免疫吸附法检测炎性因子 小鼠进行水迷宫实验后,眼眶取血,2 000 r/min离心20 min,取上层血清,根据试剂盒的说明加入抗体和显色剂,利用酶标仪检测450 nm下的吸光度,通过标准曲线计算肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)的水平。
1.5 TUNEL染色检测海马神经元凋亡 小鼠颈脱臼处死,取出海马组织,然后将海马体固定、透化、切片,操作过程按照试剂盒说明书进行。然后将其放置于TUNEL溶液中,37℃下孵育1 h。洗涤后加入Converter-POD溶液孵育30 min,之后依次进行显色、DAPI染色细胞核、封片。通过检测荧光反应计算凋亡率。
1.6 双标免疫荧光染色 将固定的海马切片进行双标免疫荧光染色,通过CD11B对小胶质细胞进行标志性染色,然后对BDNF和TrkB进行染色。切片中首先加入红色荧光标记的anti-CD11B4(1∶200稀释)在4℃下避光孵育过夜,然后分别加入绿色荧光标记的anti-BDNF和anti-TrkB(1∶200稀释),在室温下避光孵育1 h。通过甘油封片,立即通过激光共聚焦显微镜计算平均光密度并拍照。

2 结果
2.1 各组小鼠水迷宫实验结果比较 与对照组比较,放射组、PFOS组、放射+PFOS组逃避潜伏期显著延长,穿越平台次数显著降低,差异有统计学意义(P<0.05)。与放射+PFOS组比较,放射组、PFOS组逃避潜伏期显著缩短,穿越平台次数显著增加,差异有统计学意义(P<0.05)。见表1。

表1 各组水迷宫实验结果比较
2.2 各组海马神经元凋亡情况比较 对照组海马神经元凋亡率为(3.15%±0.56%),显著低于放射组的(13.47%±2.15%)、PFOS组的(9.15%±1.84%)、放射+PFOS组的(24.61%±5.28%),差异有统计学意义(P<0.05)。放射+PFOS组海马神经元凋亡率显著高于放射组和PFOS组,差异有统计学意义(P<0.05)。见图1。

图1 TUNEL染色检测各组海马组织神经元凋亡情况(a.对照组;b.放射组;c.PFOS组;d.放射+PFOS组;TUNEL×200)
2.3 各组炎性因子水平比较 与对照组比较,放射组、PFOS组、放射+PFOS组的TNF-α、IL-1β水平显著升高,差异有统计学意义(P<0.05)。放射+PFOS组TNF-α、IL-1β水平显著高于放射组和PFOS组,(P<0.05),差异有统计学意义(P<0.05)。见表2。
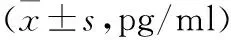
表2 各组炎性因子水平比较
2.4 各组小胶质细胞BNDF、TrkB表达水平比较 与对照组比较,放射组、PFOS组、放射+PFOS组BDNF和TrkB水平均显著升高,差异有统计学意义(P<0.05)。放射+PFOS组BDNF、TrkB水平显著高于放射组和PFOS组,差异有统计学意义(P<0.05)。见表3。

表3 各组小胶质细胞BDNF和TrkB表达水平比较
3 讨论
放射治疗是治疗原发或继发性颅内肿瘤的重要方法。然而,在手术过程中,放射线会不可避免地对神经元造成损伤。当海马体受到放射线照射后,会出现水肿、神经元凋亡,造成患者记忆功能减退。因此,减少放射线对海马体以及其他脑组织的影响具有重要的意义[7]。PFOS是制冷剂、润滑剂、杀虫剂或阻燃剂的常用成分,不易降解、代谢,具有较强的神经毒性[8],在人体内的半衰期约为5.4年,在职业暴露的人群血液中水平更高。
本研究水迷宫实验结果显示,放射线和PFOS均会影响小鼠的记忆功能,而PFOS联合放射线照射会进一步加剧记忆功能的损伤,且PFOS可加剧放射线诱导的神经元凋亡。Wang等[9]研究表明,PFOS可以通过诱导星形胶质细胞的凋亡影响神经功能。另有研究报道,PFOS可以通过调节PARP和p53通路诱导小胶质细胞的凋亡以及氧化应激反应[10]。本研究中,在PFOS存在的情况下,放射线引起的海马体细胞凋亡及小鼠记忆力损伤会加剧。这提示,对于体内累积了PFOS的患者,进行放射线治疗可能会加剧神经损伤。
小胶质细胞具有双重作用:一方面,小胶质细胞会通过免疫炎性反应及时清除受损神经元并促进神经元存活;另一方面,放射线或PFOS会诱导小胶质细胞分泌炎性细胞因子,引起神经元炎性损伤和凋亡[11-12]。Chen等[13]研究结果表明,PFOS可以通过激活AKT/NF-κB通路促进星型角质细胞活化,诱导IL-1β分泌,引起神经炎性损伤。Yang等[14]研究结果表明,PFOS可通过Ca2+依赖NF-кB信号诱导小胶质细胞活化和TNF-α分泌。Miao等[15]研究发现,米诺环素激活BDNF/TrkB途径可以通过诱导小胶质细胞激活导致神经损伤。本研究结果显示,放射+PFOS组TNF-α、IL-1β、BNDF、TrkB水平均显著升高。这提示,PFOS可能通过BDNF/TrkB途径激活小胶质细胞分泌TNF-α和IL-1β。
综上所述,PFOS通过BDNF/TrkB通路进一步激活小胶质细胞分泌炎性因子,从而加剧放射线引起的小鼠海马体神经元凋亡和记忆功能损伤。

