Notch信号通路介导的自噬改变在多囊卵巢综合征中的作用及机制研究*
任楠楠,周 珊,刘红莉△
(1.西安市人民医院检验科 710004;2.西北妇女儿童医院生殖妇科,西安 710039)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是一种女性常见的生殖内分泌疾病,能够引起卵巢内颗粒细胞和卵泡细胞发育障碍,导致不孕和不良妊娠的结局[1-2]。研究表明,PCOS影响着5%~10%的育龄女性。PCOS主要临床表现为肥胖、血脂异常及胰岛素抵抗(IR)等。目前针对PCOS病理机制的研究较多,主要认为与基因的改变相关,例如一些合成激素分泌相关的基因、炎性因子、脂代谢相关基因及自噬相关基因等[3]。卵巢中的细胞反应可能是PCOS的最初病理机制,进而引起下丘脑-垂体-卵巢轴(hypothalamus-pituitary-ovary axis,HPO)紊乱,激素水平出现异常导致临床症状的产生。自噬是细胞发生的不同于凋亡的程序性死亡,过度的自噬对细胞来说无疑是一种损伤[4]。目前研究发现,卵巢中的颗粒细胞若发生过度自噬,则可能导致PCOS的发生。Beclin1蛋白分子是自噬发生的关键分子,是自噬泡形成的重要组成部分。Beclin1分子表达的水平能够间接反映细胞自噬的状态。调控自噬发生的信号通路较多,mTOR是最经典的一条通路,mTOR对自噬的发生能够起到负面的调控作用[5]。然而对于mTOR上游调控的机制仍未阐明,深入研究PCOS过程中卵巢细胞Notch信号通路的改变,观察Notch信号通路与mTOR相关分子的关系,阐明Notch信号通路对自噬表达水平的影响,将会为PCOS的防治提供理论依据和分子靶点。
1 材料与方法
1.1 材料
SD大鼠(购自空军军医大学动物实验中心);来曲唑(江苏恒瑞医药);HE染色试剂(武汉谷歌生物公司);戊巴比妥钠(北京化工厂);Jagged1(美国Sigma公司);噻唑蓝(MTT)、RMPI-1640培养基(美国Sigma公司);Actin、Beclin 1、mTOR、p70s6k、LC3、Hes1和Notch 1抗体(英国Abcam公司);二甲亚砜(DMSO,美国Gibco公司)。
1.2 方法
1.2.1SD大鼠POCS模型的建立
运用MALIQUEO等[6]的方法,用来曲唑200 μg/d灌胃的方式建立PCOS大鼠模型。将体质量约为200 g的SPF级雌性SD大鼠40只,分为对照组、来曲唑干预组(200 μg/d)、Jagged1处理组、来曲唑+Jagged1处理组。SD大鼠每天保持光照12 h,环境温度控制在20~24 ℃,湿度范围是60%±5%,自由进食和饮水。
1.2.2血清样本及卵巢组织的采集
实验各组SD大鼠末次灌胃给药后禁食过夜,次日称量各组SD大鼠体质量,用2%戊巴比妥钠麻醉后,剥离胸腔,暴露心脏,从心房抽取静脉血,室温放置30 min,2 500 r/min离心15 min,取上清液分装冻存在-80 ℃冰箱中备用。抽取静脉血后,在SD大鼠腰椎背侧用75%乙醇消毒,双侧分别做一1 cm左右的切口,取出SD大鼠的双侧卵巢。一侧用4%多聚甲醛固定,另一侧放于离心管中存入-80 ℃冰箱。
1.2.3激素水平的测定
通过化学发光法对各组SD大鼠血清中的雌二醇(E2)、促卵泡生长激素(FSH)、促黄体生成素(LH)进行检测。具体方法按照试剂盒说明书进行,每组各设两个复孔,保证结果相对偏差在±15%范围内,变异系数小于15%。
1.2.4卵巢HE染色
将在10%甲醛溶液中浸泡24 h以上的卵巢组织,常规石蜡包埋进行组织切片,厚度为3~4 μm,行HE染色:(1)二甲苯脱蜡;(2)乙醇水化;(3)苏木精染色;(4)1%盐酸乙醇分化,自来水冲洗10~20 s;(5)伊红染色;(6)脱水,透明,封片。
1.2.5Hela 细胞培养及MTT检测
Hela细胞常规37℃、5%的CO2、饱和湿度孵箱培养。细胞分为4组:空白对照组、白头翁皂苷B4处理组(20 mg/mL)、Jagged1处理组、Jagged1+白头翁皂苷B4处理组(20 mg/mL)。细胞接种在96孔板中,待细胞完全贴壁处于良好状态下每孔加入20 μL浓度是5 mg/mL的MTT溶液,继续放入细胞培养箱孵育4 h,用移液器分别吸去各孔中的上清液,每孔加入150 μL DMSO,运用酶标仪检测各孔的吸光度值,计算细胞活力。
1.2.6Western blot 检测自噬相关蛋白和信号通路
将4组处理的Hela细分别运用蛋白提取试剂盒提取蛋白样品,运用紫外分光光度计进行蛋白浓度定量,蛋白浓度配平后放入-80 ℃冰箱保存。进行凝胶电泳(恒流条件下实施电压80 V,电泳时间为120 min),电转(恒压条件下实施电流250 mA,电转时间为90 min)。4 ℃一抗(β-actin、Beclin 1、LC3、Hes1、Notch 1)孵育16 h,二抗室温孵育2 h,用ECL发光法显色。各组以β-actin蛋白作为内参。
1.3 统计学处理
2 结 果
2.1 PCOS大鼠模型的建立
与对照组相比,PCOS模型组SD大鼠体质量显著升高(P<0.05),见图1A;PCOS组与对照组相比血清中E2、FSH水平显著降低(P<0.05),见图1B;对照组卵巢呈现大量黄体形态结构,存在不同发育阶段的卵泡:例如窦状卵泡、排卵前卵泡。卵泡颗粒细胞层排列紧密,形态结构正常。PCOS模型组卵巢则显现为病理性的改变,黄体结构较少,并且发现卵泡大量扩张,颗粒细胞层排列稀疏,没有放射冠及卵母细胞存在,存在卵巢间质细胞增生,卵巢呈典型多囊样变性病变,见图1C。
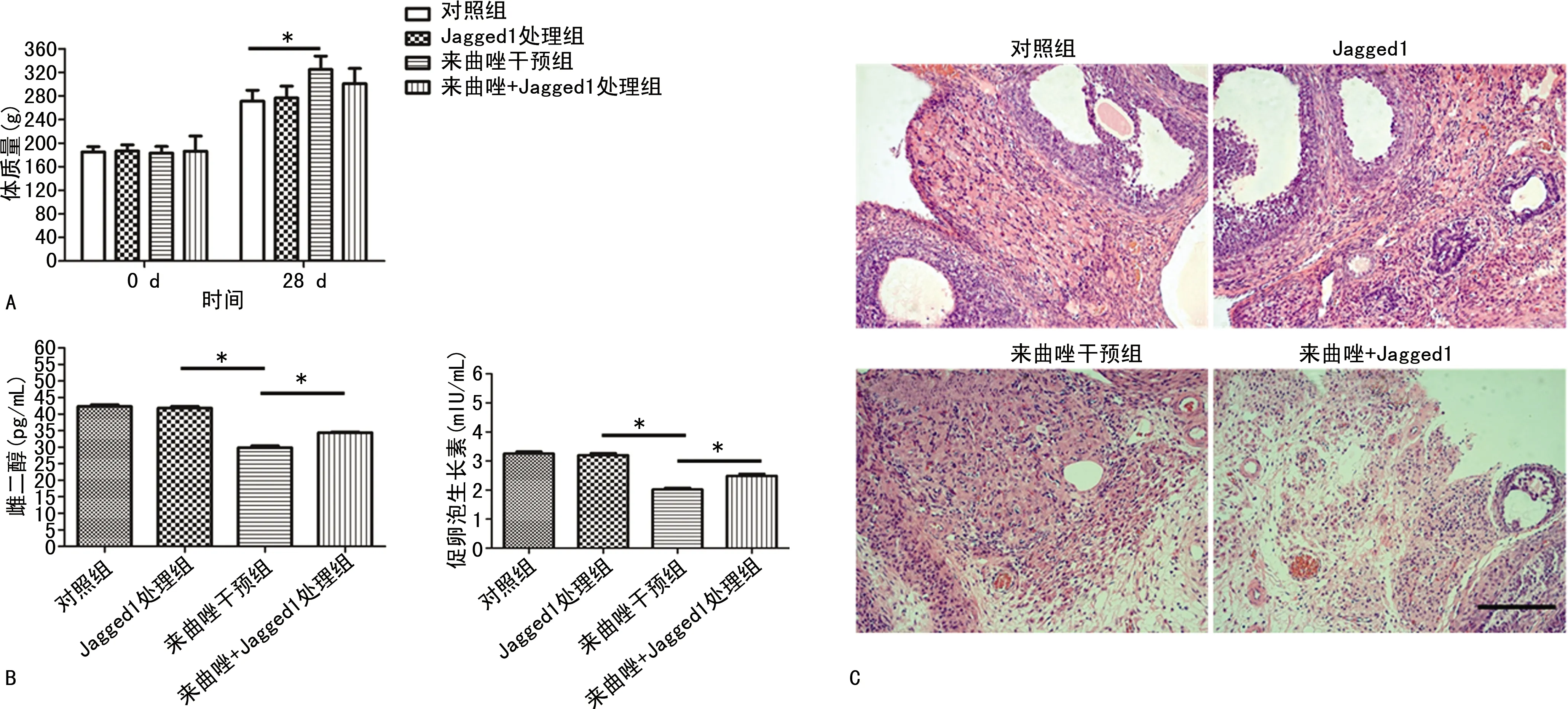
A:PCOS建模过程中各组体质量的改变;B:各组血清中雌二醇及促卵泡生长素的改变;C:HE染色检测各组形态学改变;*:P<0.05。
2.2 PCOS能够诱导自噬的发生
Western blot检测显示PCOS模型组与对照组相比自噬相关蛋白LC3和Beclin1表达水平显著升高(P<0.05),见图2A。RT-PCR检测显示PCOS模型组与对照组相比自噬相关蛋白LC3和Beclin1表达水平显著升高(P<0.05),见图2B。
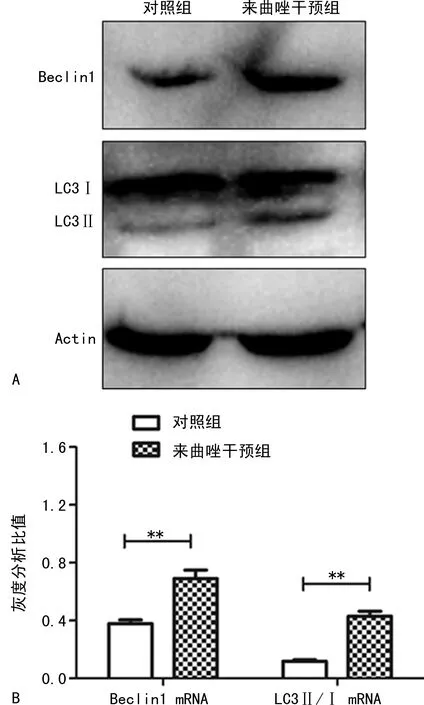
**:P<0.01。
2.3 PCOS能够抑制Notch信号通路的活化
Western blot检测发现PCOS模型组与对照组相比,Notch1、Hes1蛋白处于抑制状态,见图3。
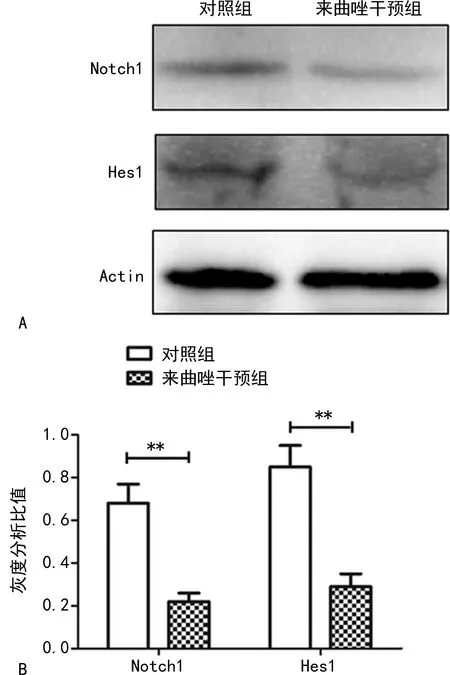
**:P<0.01。
2.4 激活Notch信号通路能够降低自噬的发生,进而抑制PCOS的病理发生
Jagged1干预能够引起Notch信号通路激活,与来曲唑共同处理后发现,来曲唑处理组的自噬相关蛋白表达降低,自噬发生可能受到抑制,同时,Jagged1+白头翁皂苷B4处理组,细胞活力与单纯白头翁皂苷B4处理组增加,见图4。

A:对照组;b:来曲唑干预组;c:Jagged1干预组;d:来曲唑+Jagged1干预组;*:P<0.05;**:P<0.01。
3 讨 论
PCOS是当今影响育龄女性不孕不育的主要疾病,并对机体的内分泌存在一定的影响。其发病机制尚未阐明,本研究首先检测了PCOS模型建立的是否成功,运用目前对于PCOS模型检测的几个指标进行观察:血清中E2、FSH表达水平及卵巢组织的形态学观察[7]。发现PCOS模型组与对照组相比血清中E2、FSH水平显著降低,形态学检测也发现卵巢病理性的改变:黄体结构较少,并且发现卵泡大量扩张,颗粒细胞层排列稀疏,没有放射冠及卵母细胞存在,存在卵巢间质细胞增生,卵巢呈典型多囊样变性病变。诸多的结果表明本研究PCOS模型建立成功。自噬是细胞内的一种生理活动,在细胞各种应激过程中均会表达异常,有研究指出自噬与许多疾病的发生存在着紧密的联系[8]。为了进一步揭示PCOS的发病机制,本研究检测了PCOS卵巢组织中自噬水平的表达情况,Beclin1和LC3分别是自噬发生过程中的关键蛋白分子,两种蛋白水平的改变可以代表细胞自噬的水平[9]。Western blot检测提示PCOS模型组自噬相关蛋白LC3、Beclin1表达水平增高。研究表明,自噬属于细胞的第二程序性死亡,参与细胞多项生理活动,且自噬的发生可能与PCOS关系密切[10-11]。本研究也发现PCOS模型组自噬水平上调,提示自噬的异常表现可能是导致PCOS的病理机制之一。调控自噬发生的信号通路较多,其中最为经典的为mTOR/p70s6k信号通路[12]。本研究为揭示PCOS模型中引起自噬水平升高的分子机制,运用Western blot检测了mTOR/p70s6k信号通路的活化状态,提示PCOS抑制了mTOR/p70s6k信号通路。PCOS很可能是通过mTOR/p70s6k信号通路调节自噬发生的。Notch信号通路与mTOR关系紧密,且参与细胞的免疫、应激、生长、分化及细胞增殖等各项生命活动[13-15]。本研究检测了Notch信号通路相关分子的改变情况,结果提示PCOS能够抑制Notch信号通路上的相关分子Notch1,Hes1,Notch信号通路可能参与了PCOS的病理发生过程。为了进一步验证Notch信号通路在PCOS发病过程中的分子机制和作用,运用Notch信号通路的一种激活剂Jagged1在PCOS建模过程中进行干预,观察Notch信号通路激活后自噬水平和PCOS病理进程的改变。结果发现经过Notch激动剂的干预,PCOS模型建立的过程中病理进程有所缓解,血清中E2、FSH水平与模型组相比有所升高,提示Notch信号通路活化能够改善PCOS的发生。用Western blot检测了Notch信号通路活化后,mTOR/p70s6k信号通路的改变,结果提示,mTOR/p70s6k信号通路与模型组相比处于活化状态。本研究检测了自噬相关蛋白Beclin1和LC3的水平,经过Notch信号通路激活剂干预后,卵巢组织中自噬相关蛋白表达受到抑制。验证了Notch信号通路对自噬具有一定的调控作用,且激活Notch信号通路改善PCOS的发生很可能是通过调控自噬来完成的。
本研究证实了自噬的发生在PCOS发生中的重要作用,进一步揭示了mTOR/p70s6k信号通路及Notch信号通路的改变,阐明了Notch信号通路对自噬的调控作用在PCOS发生过程中的重要意义。为临床上PCOS的治疗和预防提供了重要的分子靶点和理论依据。

