植物对低温胁迫的生理响应及外源脱落酸缓解胁迫效应的研究进展
项洪涛,郑殿峰,何宁,李琬,王曼力,王诗雅
(1.黑龙江省农业科学院耕作栽培研究所,黑龙江 哈尔滨150086;2.广东海洋大学农学院,广东 湛江524088;3.黑龙江八一农垦大学农学院,黑龙江 大庆163319)
植物在自然界中生长和生存,其生育进程中不可避免地会受到低温、干旱、盐碱等极端环境因子的影响,其中温度对植物生长发育影响较大,甚至是导致植物死亡的关键环境因子[1]。低温作为重要的环境因子影响着植物的地理分布和物种多样性,并且对农业可持续发展造成了严重的威胁[2]。在全球气候变暖的背景下,气温变化却比较波动,极端天气频繁出现,作物的低温、寒冻灾害日趋严重,导致产量降低、品质下降[3],且严重时可引起植株死亡,从而给农业生产造成巨大损失[4]。
我国农业生产历史悠久,劳动人民智慧地总结出了多种多样的抵御低温的方法,比如熏烟法、培育抗冷品种、对植物进行低温驯化等不同形式的物理学、育种学和栽培学等方法,这些方法较为有效但又存在明显的弊端。通过挖掘植物自身的抗冷潜力,开启植物体自我保护机制是一种重要的抗逆途径。通过施用外源激素或植物生长调节剂来刺激植物理化过程并提高抗逆能力,已经越来越受到广泛关注。近年来外源脱落酸(abscisic acid,ABA)在我国农业生产中应用越来越多,因其具有抑制作物生长的生理效应,在壮根健苗、促进早熟、稳产增产以及抗逆减灾领域中均有报道,尤其是近年来分子生物学的发展,已经明确了植物抗冷过程中存在着一条明显的依赖内源ABA 途径,这间接说明了施用外源ABA 可能具有很好的抵御低温的效应。因此,通过全面总结植物对低温胁迫的应激反应变化及外源ABA 的缓解效应,对寻找提高植物抗冷、耐冷途径,增强植物抵御低温的能力、挖掘有效的农业措施具有极大帮助,同时对提高农业生产效能也具有重要的现实意义。
1 植物对低温胁迫的生理应激响应
植物的生长发育受内外因素的共同影响,外部因素包括光照强度、光周期和温度变化等,内部因素则有激素水平,理化进程和信号传导等[2]。植物在整个生命过程中不断适应外部环境并通过信号传导调整内外部因素平衡,安全完成一个完整的生命周期活动。但在一个生命周期内,植物的发育进程中不可避免地遭受或强或弱的逆境胁迫,比如干旱、风雹、水淹、低温等。低温对植物的形态结构发展、理化代谢途径、生长发育进程都具有较大影响甚至伤害,低温条件下植物自身会产生复杂的生物化学和生理学上的应激响应,以应对和适应低温环境。植物对低温胁迫的适应性和抵抗能力既受系统发育的遗传基因控制,又受个体发育过程中生理状态制约[5],植物遭受低温胁迫后,会开启一系列应激的自我防护机制,这些保护系统之间相互有机协调,以最大程度降低伤害,具体如图1 所示。
1.1 低温胁迫对植物光合生理的影响
光合作用是植物生长最根本的基础,其以二氧化碳(CO2)和水分(H2O)为反应底物,通过较为复杂的生化过程生成光合碳同化物,是植物体内有机营养和碳架结构的物质来源。Ainsworth 等[6]指出光合作用是植物生长的物质和能量基础,但对冷害也最为敏感。低温胁迫对光合作用的影响很大,主要原因是低温能够通过光抑制影响光合系统,严重的低温胁迫还会导致光氧化被破坏,再者低温会降低植物体内的光合作用酶活性,从而影响光合作用[7]。
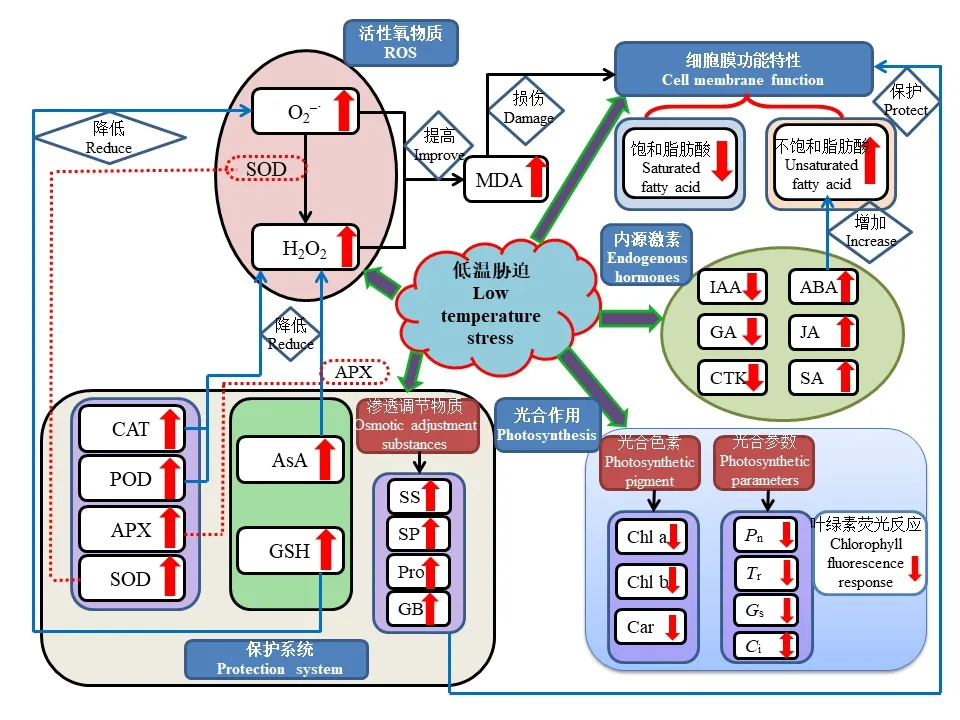
图1 低温胁迫对植物生理代谢的影响Fig.1 Effect of low temperature stress on plant physiological metabolism
1.1.1 低温胁迫对植物光合色素的影响 叶绿素和类胡萝卜素参与光合作用,涉及光能的吸收、传递和转化的相关过程。植物叶绿素包括叶绿素a 和叶绿素b,一份在光反应中心负责将光能转变为化学能,其余叶绿素则负责光能的捕获和传递[8]。低温胁迫可以破坏叶绿体结构,使叶绿素生物合成受阻[9],引起叶片内叶绿素a、叶绿素b 和总叶绿素含量降低、植株黄化[10]。杨碧云等[11]研究表明低温胁迫达到一定强度时,叶绿素a、叶绿素b、叶绿素(a+b)含量、叶绿素a/b 值均呈下降趋势。类胡萝卜素在植物体内可起到保护叶绿素类免受逆境因子影响导致光氧化破坏的作用,低温条件下类胡萝卜素含量也发生明显变化,有报道指出类胡萝卜素含量随着处理温度的下降和处理时间延长而降低[12]。周真珍等[7]表明低温胁迫降低了植物叶片内叶绿素含量,并明确指出两个原因:一是因为低温降低了叶绿素合成酶活性,使叶绿素生物合成受阻,二是原有叶绿体色素氧化分解,引起叶绿素含量减少。叶绿素含量的减少不利于叶绿体对光能的吸收利用[13],影响光能捕获,光合电子传递受阻[14],导致光合能力下降,碳同化受到抑制,植株生长迟缓,产量与质量下降[4]。
1.1.2 低温胁迫对植物光合参数的影响 低温直接影响植物光合器官的结构和活性,也间接影响其光合作用,光合参数可直接反映其光合作用的强弱[15]。光合参数主要包含以下4 项指标:气孔导度(Gs)、细胞间CO2浓度(Ci)、叶片净光合速率(Pn)以及蒸腾速率(Tr)。气孔是植物与大气进行CO2和水汽交换的通道,植物在光下进行光合作用,通过气孔吸收CO2,气孔导度的高低会影响光合作用[16]。CO2是植物进行光合作用的底物,细胞间CO2浓度影响植物的光合速率[7]。而净光合速率是植物光合系统功能的直接体现,也是植物光合系统工作正常与否的判断依据[7]。有报道指出低温导致光合参数受到显著抑制,降低叶片Pn、Gs以及Tr[17],杨晶等[18]也指出随着低温胁迫时间的延长,Pn、Gs以及Tr会持续下降,这与崔波等[19]的研究相同。但不同研究中Ci的变化趋势却不完全相同,郑春芳等[17]指出低温使Ci显著增加,杨晶等[18]的研究结论是Ci会小幅下降,而崔波等[19]的研究表明Ci先下降后上升。光合参数之间进行协同工作,共同抵御低温对光合作用的影响。低温对光合作用最明显的影响就是Pn的降低,Farquhar 等[20]研究认为,低温导致光合速率下降的因素既有气孔因素也有非气孔因素。如果Pn、Gs及Tr同时下降,Ci也相应下降,即气孔因素占主导[19];如果Pn、Gs及Tr下降的同时Ci升高,则是由非气孔因素阻碍CO2的利用,造成Ci的积累所致[21]。
1.1.3 低温胁迫对植物叶绿素荧光反应的影响 叶绿素荧光信号由植物体内发出,并且具有丰富的光合作用信息,这与植物受胁迫程度相关。低温胁迫影响光能的吸收、转换与光电子传递,致使过剩的激发能大量积累于光合系统Ⅱ(PSⅡ)反应中心,进而损伤植物叶片的PSⅡ反应中心,并导致叶片光合作用能力减弱[22]。有报道指出,短时低温胁迫下,植物叶片光合色素含量和构成比例几乎没有变化,但是叶片PSⅡ的有效光化学效率(Fv′/Fm′)和实际光化学效率(ΦpsⅡ)出现明显降低,光化学淬灭系数(qP)的变化也相似,而叶片的非光化学淬灭系数(NPQ)迅速增大[8]。刘蕾蕾等[23]对小麦(Triticum aestivum)的研究表明随着低温持续时间的延长,叶片最大光化学效率(Fv/Fm)、实际光化学效率(ΦpsⅡ)呈先下降后上升的趋势,并指出一般在低温胁迫2~5 d,叶片ΦpsⅡ降至最低。叶片光化学猝灭系数(qP)随低温持续时间的延长呈先下降后升高趋势,并且随温度的降低呈下降趋势,而叶片的非光化学淬灭系数(NPQ)与低温持续时间关系不大,但随着低温强度加剧呈较为显著的上升趋势。
1.2 低温胁迫对植物逆境生理的影响
低温胁迫通常会导致植物的形态和生理生化发生变化,其对细胞内部的生理改变主要有以下4 个方面:活性氧类物质积累、膜质过氧化物含量变化、抗氧化酶活性及非酶抗氧化剂含量变化以及渗透调节物质含量变化。一般来说低温胁迫可以引发植物体内活性氧(reactive oxygen species,ROS)类物质如过氧化氢(H2O2)、超氧阴离子(O2—·)等物质的积累,从而增加植物的氧化应激反应。大量的氧自由基对细胞膜伤害很大,引起膜质过氧化反应,产生大量的丙二醛(MDA),MDA 能够抑制细胞保护酶活性,从而加剧膜质过氧化,同时其本身也是具有细胞毒性的物质,它能够和酶蛋白结合、交联,从而使保护酶失去活性,也就进一步破坏膜结构。一定胁迫程度内,抗氧化酶体系和非酶抗氧化剂能够有效清除ROS 并消除它们的不利影响。同时植物应激低温胁迫也会带来渗透调节物质含量的变化,如脯氨酸、甜菜碱等物质会有所提高,来维持细胞膜的渗透调节功能,从而增强植物体对低温胁迫的抵抗能力[24]。
1.2.1 低温胁迫对植物活性氧物质积累及膜质过氧化的影响 植物代谢所产生的ROS 包括超氧阴离子(O2—·)、氢氧根离子(OH-)、羟基自由基(−OH)、过氧化氢(H2O2)等[25]。活性氧作为植物信号转导中第二信使,在植物生长发育中起重要作用[26]。正常条件下,植物能够维持自身ROS 平衡,但当植物暴露于低温环境下,细胞稳态被破坏并产生过量ROS,如果超量的ROS 未被及时清除便积累在植物体内,会加剧植物细胞膜质过氧化伤害,并对细胞膜系统产生损害[27],干扰作物的生理生化过程,最终制约作物产量和品质[28]。李海燕等[29]研究表明低温胁迫使O2—·产生速率和H2O2含量显著增加,并指出低温时间越长,增加趋势越明显。张爱冬等[30]也指出随着温度降低,植物叶片O2—·产生速率和H2O2含量均呈上升的趋势,这促使细胞膜透性增大,胞内电解质外渗,加剧膜质过氧化作用。MDA 是细胞膜过氧化产物,其含量高低是质膜受损严重与否的重要指标[31],MDA 含量与植物耐寒性间呈负相关,胁迫程度越强,MDA 积累量越多。项洪涛等[32]指出低温导致植物体内MDA 含量增加,并随胁迫强度和胁迫时间的增加而增多。邓化冰等[33]也指出低温能够导致植物叶片MDA 含量显著增加,加剧膜质过氧化程度,导致膜结构破坏,质膜透性加大,电解质外渗,从而影响叶片的生理生化机能。
1.2.2 低温胁迫对植物抗氧化系统的影响 植物在自然选择中进化出多种ROS 清除机制来进行自我防护,通过这些机制来响应氧化应激。植物体内这些抗氧化机制包括保护酶系统和非酶抗氧化剂[24]。当遭遇逆境胁迫时,植物会自动开启保护系统抵御逆境因子带来的威胁,进而尽量维持正常的生理代谢活动,免受损害。保护酶系统主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)。正常情况下,这些酶之间相互配合、衔接,能够自动氧化体内不断产生的活性氧类物质,这些物质的产生和清除处于一种动态平衡的状态,所以植物不会受到伤害。低温胁迫起初诱发抗氧化酶活性上升,但随着胁迫加剧,这些抗氧化酶活性下降,严重的低温胁迫积累了过量的活性氧,使活性氧和防御系统的动态平衡遭到了破坏,从而加剧膜质过氧化作用,产生大量的MDA,进而导致膜系统受到损伤使得植物受到伤害。植物通过SOD、POD 和CAT 三者协同作用,使体内的氧自由基维持在较低水平,可以在一定程度上减缓或防御低温胁迫。项洪涛等[34]研究指出低温可导致植物体内SOD、POD 和CAT 活性先升高后下降,短时期内可清除多余的ROS,但随着低温胁迫时间的延长,这种保护机能逐渐下降甚至崩溃,这与李春燕等[35]的报道相似,其指出低温处理一段时间后保护酶活性表现出持续下降的趋势,并表明这种持续下降的现象是低温对作物造成了不可恢复的伤害。非酶抗氧化剂主要有抗坏血酸(AsA)和谷胱甘肽(GSH),AsA 具有清除H2O2、OH-等功能,而GSH 是重要的活性物质,其能够帮助保持免疫系统不被破坏,并且具有抗氧化作用和整合解毒作用,防止细胞膜过氧化,从而保证细胞膜完整并行使正常功能[4]。有报道指出,随着低温强度的增加,AsA 和GSH 都呈先增加后降低的变化趋势[36],说明达到一定低温阈值后,即超出了AsA−GSH 循环的调节适应能力后,二者含量迅速降低,还原能力下降,植物受害加重。郑春芳等[17]指出AsA−GSH 循环是调控植物响应低温的重要途径,并表明低温胁迫降低了AsA 和GSH的含量。
1.2.3 低温胁迫对植物渗透调节物质含量的影响 植物在遭受冷害的同时还会受到水分胁迫和渗透胁迫,一些具有保水作用的渗透调节物质,如脯氨酸、甜菜碱、可溶性糖和可溶性蛋白等物质会大量增加,以维持细胞的渗透平衡,减小低温伤害[37]。脯氨酸含量与植物胁迫之间存在正相关关系,它可以通过维持细胞膨胀或渗透平衡来赋予植物胁迫耐受性,从而稳定膜结构,防止电解质泄露,使活性氧的浓度维持在正常范围内,在植物抗胁迫中发挥着重要作用[24]。植物体内可溶性物质如可溶性糖和可溶性蛋白,能够提高细胞液浓度,增加细胞持水组织中的非结冰水,是重要的渗透调节物质,其含量的增加有利于提高植物的抗寒性[5]。甜菜碱(GB)是一种水溶性生物碱,无毒无害且广泛存在于动植物中,可以调节细胞渗透压以维持生物膜及蛋白质结构和功能的完整,具有较好的抗逆功能[38]。植物受到低温胁迫后,体内的渗透调节物质含量都会有所增加,共同抵御低温胁迫,维持正常的生理代谢,这在水稻(Oryza sativa)[34]、玉米(Zea may)[24]、紫花苜蓿(Medicago sativa)[38]、豇豆(Vigna unguiculata)[27]、丝瓜(Luffa cylindrica)[30]以及马铃薯(Solanum tuberosum)[7]等多种作物中得到广泛验证。
1.3 低温胁迫对植物细胞膜组分和结构的影响
细胞膜是植物体细胞及细胞器与外界环境之间进行物质和能量交换的场所,同时也是细胞感应外界环境中各种逆境胁迫信号的细胞结构[39]。细胞膜系统的稳定性与植物抗逆性存在密切关系,其稳定性和流动性是细胞生命活动的基础,也是形成植物抗逆能力的关键[40]。细胞膜的结构是一种动态平衡体系,构成细胞膜磷脂双分子层中的脂肪酸成分及其饱和水平与膜稳定性密切相关,细胞膜的稳定性得益于细胞膜膜质的流动性[41]。当植物细胞受到低温胁迫达到一定的相变温度时,脂膜会由流动性的液晶相转变为僵硬的凝胶相,引发膜质的脂肪酸链由无序排列变为有序排列,这阻碍了膜的正常生理功能,会导致膜透性增大,细胞液外渗,最终导致细胞死亡[40−42]。膜质相变程度与不同脂肪酸含量及比例关系密切,通常认为植物的膜质相变温度降低是由于不饱和脂肪酸含量的增高,进而增加了脂肪酸链的不饱和程度,不饱和程度越大,膜的流动性越大,稳定性越好,使植物耐寒性得到提高[39,41]。当受到低温胁迫时,许多植物体内会产生较多不饱和度较高的脂肪酸(亚麻酸、油酸、亚油酸等)来抵御低温[4]。相关报道也指出随气温下降膜质组分中饱和脂肪酸减少,不饱和脂肪酸特别是亚油酸大幅增加,使膜质相变温度下降,对于保持膜流动性和正常生理功能有重要作用[40],类似的研究结果在绣线菊(Spiraea salicifolia)[40]、小麦[42]、结缕草(Zoysia japonica)[39]等植物中都有报道。
1.4 低温胁迫对植物内源激素水平的影响
植物激素是植物生长发育的重要调节物质,对逆境产生响应的激素信号分子,广泛参加作物生理过程的调控[43]。ABA、水杨酸(SA)和茉莉酸(JA)是非生物胁迫反应的重要影响因素。ABA 作为一种能够提高植物抗逆能力的“非生物应激激素”,既是植物响应非生物胁迫的信号,也是引起植物体内适应性调节反应和基因表达的重要因子,参与非生物胁迫下的调控应答[44]。SA 和JA 介导的信号传递途径与植物抗性密切相关,细胞内增加的SA 能激活抗氧化酶系统,使冷应答基因的表达量上调,从而减少细胞膜的氧化损伤,增强植物的抗寒能力[45]。JA 作为信号分子参与调控植物的生长发育及低温、干旱等非生物胁迫,有报道指出外源茉莉酸甲酯(methyl jasmonate,MeJA)能够诱导热激蛋白家族转录,通过增加抗氧化剂合成、降低脂氧合酶活性从而增加植物抵御冷害能力,说明JA 信号途径参与了植物对低温的响应与适应过程[46]。生长素(IAA)、赤霉素(GA)和细胞分裂素(CTK)是植物体内重要的生长类激素,对植物生长和发育起重要作用。其中IAA 和GA 广泛地参与到植物抗低温系统中,GA 被认为与植物抗寒性有关,但是作用效果不如ABA 明显[31]。李春燕等[35]研究表明低温处理能促使植物体内ABA 含量增加、GA 含量降低。项洪涛等[34]也表明当植株受到低温胁迫时,生活力下降,内源激素水平发生明显变化,主要表现为ABA 大量增加,IAA 和GA 含量减少,ABA/GA 和ABA/IAA 提高,抑制作物生长发育,降低损耗,各激素之间协同作用抵御低温胁迫。而刘学庆等[31]研究指出,低温胁迫后,植物体内的ABA、IAA 和GA 的含量都呈先增高后降低的变化趋势,这与植物的品种特性及低温处理的时间有关。
1.5 低温胁迫对植物重要冷反应基因表达的影响
植物的抗寒过程是一个由多个转录因子或多种信号途径相关基因相互平行或交叉协作,共同调控的复杂网络,最终产生结构和生理物质的变化,从而增强植物的抗寒能力[47]。近年来,基因表达的变化成为植物提高抗冷性理化机制的研究热点。低温引起植物生长停滞,涉及光合能量生成的许多基因被下调,这可能是为了防止光氧化损伤的更大风险。脂肪酸脱氢酶(fatty acid desaturase,FAD)是植物膜质中不饱和脂肪酸合成的关键酶,负责调控脂肪酸不饱和度[48]。研究表明低温胁迫诱导拟南芥(Arabidopsis thaliana)AtFAD8 基因[49]、大豆(Glycine max)GmFAD3 基因[50]、紫苏(Perilla frutescens)FAD3 基因[48]的表达,进而提高植株体内不饱和脂肪酸含量,保持细胞膜的稳定性,增强了植物抵抗冷害的能力。随着研究的不断深入,人们对以CBF(C-repeat-binding factors)转录因子为核心的低温信号通路有了更为清晰的认识,CBF家族成员串联排列在拟南芥第4 条染色体上,分别命名为CBF1(DREB1B)、CBF2(DREB1C)和CBF3(DREB1A)。报 道 指 出 过 量 表 达CBF1、CBF2 和CBF3(DREB1A)均能大幅提高植株的抗冻性,并显著诱导植株体内COR(Cold-regulated)基因的表达[51]。在拟南芥野生型植株中,过表达CBF基因能够显著增强植株的抗冻性。同样,CBF1 和CBF3 基因敲减的植株对冻敏感。然而,CBF2 突变体(cbf2)植株则表现抗冻的表型,基因表达分析发现,CBF2 负反馈调控CBF1 和CBF3 的表达。将拟南芥中CBF基因过表达到其他植物中同样能够增强其抗冻能力,暗示着CBF 在植物响应低温过程中是非常重要而且保守的[52]。CBF的基因表达同时受转录激活因子和抑制子的调控。现在已知的正调控因子有ICE1(inducer of CBF expression 1)、ICE2 和CAMATA(calmodulin-binding transcription actieator)蛋白[52]。ICE1 蛋白能够结合到CBF3 的启动子区调节CBF3 基因的表达。ice1-1 突变体对低温敏感,而过表达ICE1 基因则导致植物抗冻。ICE2 是ICE1 的同源基因,能够通过调节CBF1 的表达正向调控植物对低温的响应[52−53]。冷害胁迫下,植物体内CBF3 表达增加可以使总可溶性糖含量增加,包括蔗糖、棉子糖、葡萄糖和果糖[54],进而维持细胞的渗透平衡,缓解低温胁迫。
2 外源ABA 缓解植物低温胁迫的效应
植物内源激素调控植物的生长及对逆境的应答[55]。ABA 是20 世纪60 年代发现和鉴定出的一种植物内源激素,在植物对胁迫耐受性和抗性中发挥着重要作用。外源激素通过改变内源激素水平调节植物生理代谢,低温胁迫下外源ABA 能够促进植物体内ABA 的合成和运输[56],进而调控植物的抗逆性。
2.1 低温胁迫下外源ABA 缓解光合生理的效应
低温胁迫对植物最直接的影响就是光合功能下降,一般认为低温破坏叶片细胞中叶绿体的结构,导致叶绿素降解,影响光能捕获、转化及分配,光合电子传递受阻、光合机构遭到破坏、碳同化受到抑制,最终导致叶片光合能力下降。喷施外源ABA 后,作物叶片的保护机能提高,过多的自由基可以被及时清除,以减少细胞膜质过氧化产物的生成,并降低自由基对叶绿体的破坏,在促进光合色素合成的同时,保护光合色素结构,使叶片中叶绿素和类胡萝卜含量处于较高水平,最终保护光合系统[57]。祁利潘等[58]指出低温条件下喷施低浓度的ABA 能够提高PSⅡ的光化学效率(Fv/Fm),李平等[59]报道外源ABA 能有效防御低温伤害,其可减缓叶片光合作用的下降和叶绿素荧光的淬灭,提高作物存活率。黄宇等[60]的研究指出喷施外源ABA 能减缓低温下叶片Pn、Gs、Tr及Ci,提高叶片的光合能力,进而提高植物幼苗的抗冷性。田礼欣等[61]也指出喷施适当浓度的外源ABA 能够显著缓解由低温胁迫导致的作物叶片Pn、Gs及Tr的下降幅度,提高Fv/Fm和Fv/Fo,降低Fo水平,进而提高幼苗叶片的光合能力,提高PSⅡ反应中心活性,促进物质积累,提高玉米幼苗的耐冷性。
2.2 低温胁迫下外源ABA 调控抗逆生理的效应
外源ABA 具有调控植物的抗逆生理的功能,在抵御低温胁迫方面具有多条路径,其核心机制是减少活性氧类物质的积累,降低膜质过氧化程度,减少其对细胞膜的损失,保障细胞膜的正常渗透调节功能以维持正常的生理代谢。主要应激反应是增强抗氧化酶活性,增加非酶抗氧化剂含量,提高渗透调节物质的含量,以调节MDA含量降低、减少H2O2等ROS 物质的积累。项洪涛等[34]报道指出外源ABA 能够提高低温胁迫时植物体内SOD、POD 以及CAT 的活性,并可同时提高脯氨酸、可溶性糖等可溶类物质的含量,抵御低温伤害。李平等[59]指出低温条件下,外源ABA 能够降低叶片内MDA 的积累,缓解胁迫。方彦等[62]指出外源ABA 能提高作物氧化酶活性,同时减缓膜质过氧化物MDA 的积累,具有提高作物抗寒性的诱导效应,Xiang 等[63]表明低温条件下外源ABA能提高水稻叶片内脯氨酸、可溶性糖和可溶性蛋白含量,有效提高SOD、POD 和CAT 活性,增强水稻的抗冷性。蒲高斌等[64]指出低温胁迫下外源ABA 能有效提高西瓜(Citrullus lanatus)幼苗叶片中SOD 和CAT 活性、降低MDA 的积累,维持膜的完整性,同时促进渗透保护物质脯氨酸和可溶性糖的增加,增强植株的抗寒性,同时也表明这是外源ABA 有效提高西瓜幼苗抗冷性、减轻低温对西瓜苗伤害的主要生理基础。
2.3 低温胁迫下外源ABA 调控细胞膜组分及结构的效应
抗冷能力较高的植物之所以有这样的特性,从膜脂结构的角度来看,一是因为在长期对低温的适应过程和自然选择过程中,其本身形成了具有较多不饱和脂肪酸的状态,这由遗传基因决定,二是因为在应激低温的理化反应中,能在细胞膜中优先积累较多的不饱和脂肪酸并使之迅速参与膜的结构以适应抵御低温环境的生理需求[65]。膜质中脂肪酸不饱和度对于植物的低温适应性尤为关键,调整脂肪酸的不饱和度是植物适应低温胁迫的重要方式[66],较多的不饱和脂肪酸能维持细胞的流动性,为跨膜蛋白质和酶功能发挥提供适宜的环境[67]。王军虹等[65]指出低温条件下,外源ABA 能够使小麦体内的不饱和脂肪酸明显提高,并表明其原因是ABA 的喷施有利于亚麻酸(18:3)的积累,进而提高抗寒力。付翀等[68]也表明外源ABA 能相对提高亚麻酸(18:3)的含量,进而提高作物的抗冷能力。徐琛[69]的研究也证实了外源ABA 能提高低温条件下作物体内不饱和脂肪酸含量,增强作物的抗寒性。
2.4 低温胁迫下外源ABA 调控内源激素水平的效应
内源激素在植物生长和生存的各个生物学进程均发挥着关键作用,目前已经发现乙烯(ethylene,ET)、油菜素内酯(brassinolide,BR)和茉莉酸(JA)可通过CBF 信号通路影响植物的低温耐受性[2]。前人研究指出各类激素间有相互拮抗和相互促进的关系,各种激素之间的动态平衡是调节植物生长和生存的关键所在[34],段娜等[70]指出内源激素水平及激素间的平衡变化对植物应激非生物胁迫起到重要作用。通常认为内源ABA 与植物抗逆关系最为密切,有报道指出ABA 是应激低温的重要信号因子,对细胞的微管结构具有保护功能,低温胁迫下植物大量快速积累ABA,发挥保护功能[43]。黄杏等[71]指出低温条件下施用外源ABA 改变了作物体内激素水平,ABA含量增加、GA 含量降低。李馨园等[43]也表明低温胁迫能促进作物内源ABA 水平提高,外施ABA 可以更进一步加强内源ABA 的合成,加强各种生理生化保护机制,提高植物的抗冷性。Xiang 等[63]指出低温条件下,叶面喷施外源ABA 促进叶片内源ABA 含量增加,同时降低了IAA 和GA 的含量,并指出外源ABA 提高了作物抵御低温的机能。
3 结论与展望
我国地大物博,幅员辽阔,南北跨度大,各地区生态环境迥异,气候条件差别大,这对农业生产要求更为严格和复杂。虽然全球气候变暖,但我国北方夏季突发低温情况反而有加剧的趋势,南方的倒春寒天气也时有发生,这对农业生产极为不利,如何抵御突发的气象灾害来稳定农业生产是一个重大的并且持续的科学问题。
低温对作物产量影响巨大,严重时甚至可以导致绝产。目前,研究学者已经逐步掌握了植物抵御低温的生理机制,在此基础上顺延摸索缓解或抵御低温的措施,外施植物生长物质来提高植物的抗逆能力已经达成广泛共识,通过化控方法抵御逆境胁迫虽然取得了一些成效,但还是较为片面,而且更大程度上是缓解,而没有达到安全度过突发低温的短暂时期,这还需要广大农业科研工作者继续挖掘新方法,探索新途径。一是通过现有掌握的植物抗逆生理机制,合成新的、效果更好的调节剂,或者开发新的调节剂复配产品,使得应用效果更好;二是根据试验和生产实践发现更多的抗低温品种,通过育种手段,逐代筛选,育成高抗且高产优质的植物新品种,同时也可以通过全基因组关联分析快速鉴定与深入挖掘耐低温的相关基因,结合多组学联合分析等技术更加方便地解析调控机理,从分子水平提高植物耐寒性,最终应用于育种改良达到提高作物耐寒性的目的,实现灾年稳产、平年丰产的生产目标。

