裸果木幼苗根系形态和生理特征对水分胁迫的响应
黄海霞,杨琦琦,崔鹏,陆刚,韩国君
(1.甘肃农业大学林学院,甘肃 兰州730070;2.甘肃林业职业技术学院,甘肃天水741020;3.甘肃农业大学资源与环境学院,甘肃 兰州730070)
干旱是影响干旱、半干旱区植被恢复成败的关键因素[1]。干旱胁迫对植物形态和生理特征的影响已成为植物生态学研究的热点问题之一,尤其是土壤水分状况与植物根系之间相互关系的研究越来越受到关注。年均降水量是裸果木分布的首要限制因子[2],随着全球气候逐渐变暖,我国干旱、半干旱区发生极端干旱事件的情况也更加频繁[3]。当植物遭遇干旱胁迫时,根系最先感应到信息,并能通过改变自身形态特征、分布状态和生理特性来适应变化后的水分环境[4−5]。因此,可以通过研究水分胁迫下根系形态特征和生理生化特性的变化对植物根系的水分响应进行定量描述,并揭示荒漠植物根系对干旱环境的适应性。
裸果木(Gymnocarpos przewalskii)属于石竹科裸果木属,呈亚灌木状,是亚洲中部荒漠区分布较为稀有的第三纪孑遗种,属古地中海旱生植物区系,对地中海气候变化和旱生植物演化过程的研究有重要的科学价值[6],也是构成石质荒漠植被的优势种之一。因其分布区生态系统脆弱、结实率低、种子小、有性繁殖困难及人类活动干扰等原因,导致种群数量不断下降,生境缩小或破碎化[7],与现代分布区相比,裸果木在未来气候条件下的适生区将明显缩小[2]。但相关研究显示,裸果木通过长期的演变已经表现出对荒漠环境的适应性,预测其生态位将处于一个较为干旱的环境空间,年均降水量为40~200 mm,水分蒸发率为3%~15%[8]。在自然环境中,幼苗根系的形态建成是决定幼苗存活、定居及自然更新的关键因素,同时其主要受限于土壤水分状况。因此,本研究通过水分控制试验,研究裸果木幼苗根系形态参数和生理指标的变化规律及差异性,探明水分胁迫下幼苗根系的形态和生理响应机制,为揭示裸果木幼苗的抗旱机理提供科学依据,也为其苗木培育中水分有效调控提供参考依据,促进荒漠区的植被恢复进程。
1 材料与方法
1.1 试验材料
从甘肃安西极旱荒漠国家级自然保护区南片自然分布的裸果木种群采集种子。于2017 年11 月中旬,采用发芽盒进行播种育苗,播种前用10%的84 消毒液浸泡种子3 min 后,用蒸馏水冲洗干净。育苗基质配比为泥炭土∶蛭石∶珍珠岩=2∶2∶1,播前用2000 倍液多菌灵溶液对基质消毒,每盒种植10 穴,每穴3~5 粒,深度1 cm。播后于人工气候箱中进行培养,温度为25 ℃,光照时间为14 h·d−1,光照强度为3600 Lx,湿度为60%,每2~3 d 浇适量水。当幼苗株高长至6 cm 左右时,将其移植到规格为24 cm×35 cm(口径×高)的花盆中,每盆移栽3 株,于室内管理,2018 年5 月初移至防雨棚内进行水分管理,定植后保留1 株生长健壮的幼苗作为供试材料。
1.2 试验方法
于2018 年6 月中旬对幼苗进行水分处理:对照(CK,土壤含水量控制在田间持水量的45%~50%)、轻度水分胁迫(LD,土壤含水量控制在田间持水量的30%~35%)、中度水分胁迫(MD,土壤含水量控制在田间持水量的15%~20%)、重度水分胁迫(SD,土壤含水量控制在田间持水量的5%~10%)。每个处理10 个重复。干旱胁迫处理前进行统一灌水,待土壤水分自然消耗至设定的土壤含水量时,采用称重补水法进行控水,使各处理含水量维持在设定范围内。于2018 年9 月底采集根样,进行根系形态和生理指标的测定和分析。
1.3 测定指标和方法
1.3.1 根系形态指标的测定 采用数字化扫描仪(Epson Perfection V700 Photo,中国)对裸果木幼苗根系进行扫描,并用WinRHIZO Basic 2800a 根系分析系统得出根长、根直径、根表面积。将根系分为粗根(d≥1 mm)及细根(d<1 mm),采用烘干法,测得根系和地上部分生物量,结合测得的总根长、总根表面积,计算比根长、比根表面积和根冠比等形态特征参数[9]。

1.3.2 根系生理指标的测定 参照高俊凤[10]的方法,分别用阿贝折射仪(WYA−2WAJ,上海)测定自由水(free water,Va)和束缚水(bound water,Vs)含量、TTC 法测定根系活力、水合茚三酮法测定脯氨酸(proline,Pro)含量、考马斯亮蓝G-250 染色法测定可溶性蛋白(soluble protein,SP)含量、蒽酮−乙酸乙酯法测定可溶性糖(soluble sugar,SS)含量、硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)含量、硫酸钛沉淀法测定H2O2含量、对氨基苯磺酸法测定超氧阴离子(O2−)含量、氮蓝四唑还原法测定超氧化物歧化酶(superoxide dismutase,SOD)活性、愈创木酚法测定过氧化物酶(peroxidase,POD)活性,过氧化氢酶(catalase,CAT)活性测定采用紫外分光光度法[11]。
1.4 数据处理与分析
采用Excel 2007 统计数据并绘图,利用SPSS 17.0 统计分析软件对根系形态指标和生理指标进行单因素方差分析和相关分析。
2 结果与分析
2.1 水分胁迫对裸果木幼苗根系形态特征的影响
2.1.1 对根系生物量积累及其分配的影响 水分胁迫使裸果木根系生物量降低(图1A)。粗根、细根生物量和根系总生物量均随着土壤水分含量的减少而逐渐降低。轻度胁迫(LD)和中度胁迫(MD)处理的粗根生物量、根系总生物量与对照(CK)相比差异不显著,重度胁迫(SD)下显著降低,降幅分别为64.13%、65.45%。LD 处理的细根生物量与CK 之间差异不显著,而MD 和SD 处理的细根生物量均显著低于CK,分别下降了66.22%、69.42%。根冠比随着干旱胁迫程度的加剧呈上升趋势(图1B)。与CK 相比,LD 处理下根冠比变化很小,MD 和SD 处理下根冠比显著增大,较CK 分别增加了66.08%和107.81%。
2.1.2 对根长和比根长的影响 干旱胁迫处理使裸果木幼苗粗根长度、细根长度、总根长均显著低于CK(图2A),LD 处理分别下降了36.56%、60.99%、53.65%;MD 处理分别下降了53.32%、50.77%、51.53%;SD 处理分别下降了73.37%、62.13%、65.50%,说明粗根长对水分变化最为敏感,细根长度随水分减少出现波动,总根长对严重的水分胁迫响应明显。3 个胁迫处理之间细根长度和总根长差异不显著。随着土壤含水量的下降,裸果木幼苗粗根比根长随胁迫程度的加大逐渐降低(图2B),各处理之间差异并不显著;细根比根长表现出波动的变化趋势,在MD 处理下达到最大值,但与CK 之间的差异均未达到显著水平;总根比根长先降后升,只有LD 处理与CK 之间存在显著差异,下降了43.13%。
2.1.3 对根表面积和比根表面积的影响 土壤水分处理使裸果木幼苗根系表面积发生了显著变化(图3A)。随着胁迫程度的加重,粗根和总根表面积均显著降低,粗根表面积较CK 分别降低了29.37%、46.67% 和68.20%,总根表面积分别下降36.62%、44.69%和65.12%;细根表面积总体呈下降趋势,LD 和MD 处理下细根表面积相较于CK 差异不显著,而SD 处理则显著小于CK,降幅为62.33%。裸果木幼苗粗根比表面积和总根比表面积随土壤水分下降先减小后增大(图3B),但各处理间差异均未达到显著水平。细根比表面积随着土壤含水量的降低呈波动性变化,MD 处理下细根比表面积达到最大,显著高于CK 和LD 处理,分别高出61.23%和199.50%,LD 和SD 处理较CK 变化不显 著。
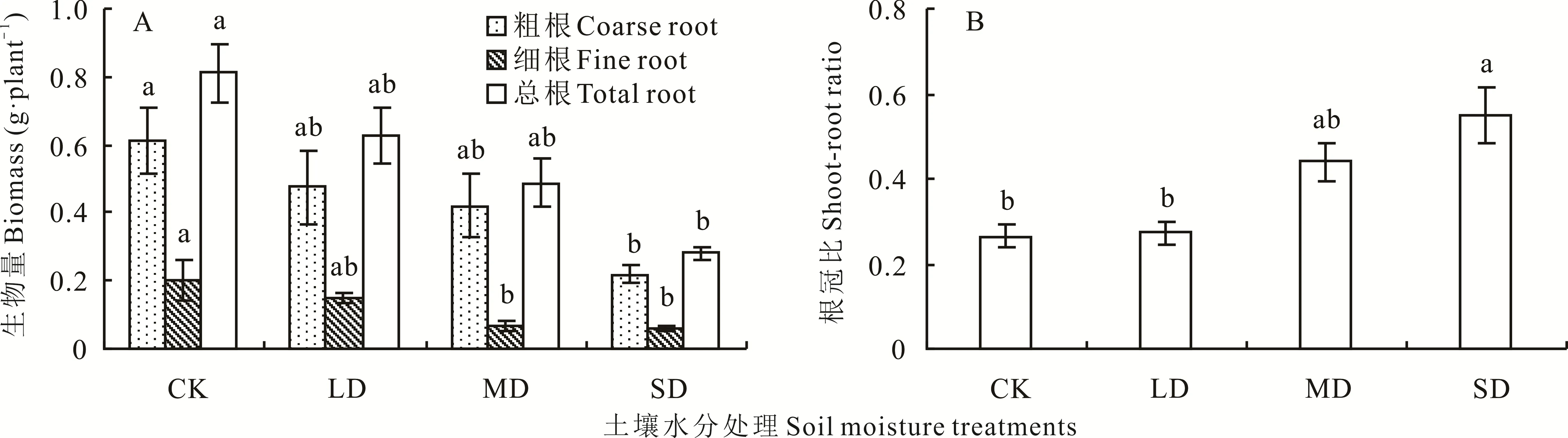
图1 水分胁迫对裸果木幼苗根系生物量和根冠比的影响Fig.1 Effects of water stress on root biomass and root-shoot ratio of seedling of G.przewalskii
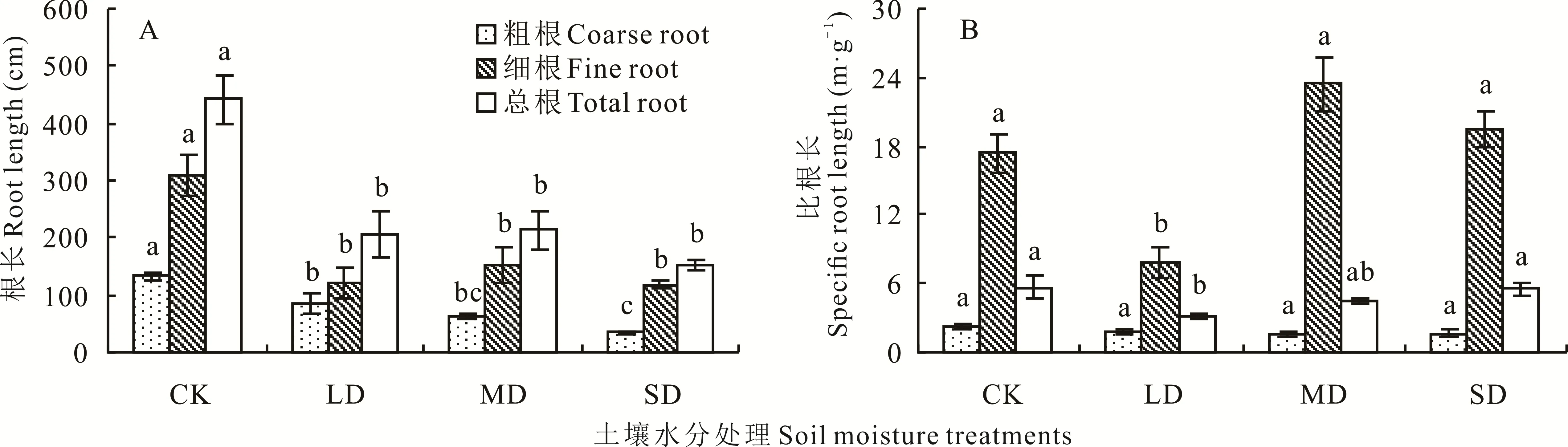
图2 水分胁迫对裸果木幼苗根长和比根长的影响Fig.2 Effects of water stress on root length and specific root length of seedling of G.przewalskii
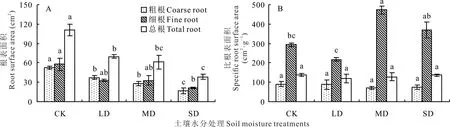
图3 水分胁迫对裸果木幼苗根表面积和比根表面积的影响Fig.3 Effects of water stress on root surface area and specific root surface area of seedling of G.przewalskii
2.1.4 对根直径和根体积的影响 随着土壤水分的减少,裸果木幼苗细根和总根平均直径均随着胁迫程度的增加先升后降(图4A),LD 处理下细根和总根平均直径较CK 显著增大,增幅分别为20.80%和21.40%,MD 和SD 处理与CK 间的差异未达到显著水平;粗根平均直径逐渐增大,与CK 相比,LD 和MD 处理增加不显著,SD 处理增幅(34.71%)显著。土壤水分对裸果木幼苗细根体积和总根体积的影响基本相似(图4B),均随着土壤水分减少而低于CK,LD 和MD 处理的影响不显著,但在SD 处理下降低显著,较CK 分别下降64.51%和58.23%。干旱胁迫处理下粗根体积总体下降,但各水分处理之间的差异不显著。
2.2 水分胁迫对裸果木幼苗根系生理特性的影响
2.2.1 对根系Va/Vs 和根系活力的影响 土壤水分对裸果木幼苗根系的Va/Vs 存在显著影响(图5A)。Va/Vs 随着土壤水分的减少呈现出先减小后增大的趋势,与CK 相比,LD 处理下Va/Vs 下降不显著,MD 和SD 处理的Va/Vs 显著增加,分别为CK 的1.90 和3.17 倍。根系活力能综合反映根系的吸收功能,其大小直接影响根系的生长发育状况。相比于CK,各胁迫处理下根系活力均显著下降,降幅分别为53.20%、55.36%和34.51%。随着水分胁迫的加剧,裸果木幼苗根系活力先下降后上升,在MD 处理下达到最小值(图5B)。LD 与MD、SD 处理间的根系活力差异不显著,SD 处理较MD 显著增大,增幅为46.69%。
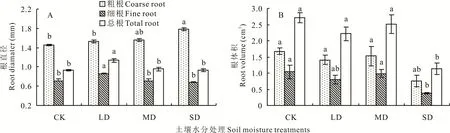
图4 水分胁迫对裸果木幼苗根直径和根体积的影响Fig.4 Effects of water stress on root average diameter and root volume of seedling of G.przewalskii
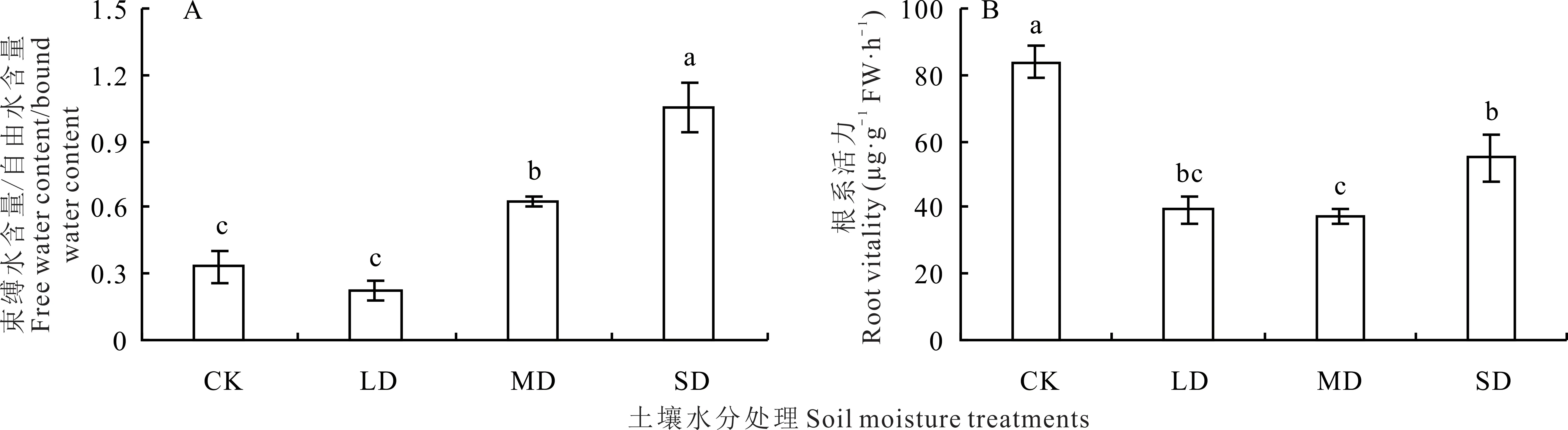
图5 水分胁迫对裸果木幼苗根系Va/Vs 和根系活力的影响Fig.5 Effects of water stress on root Va/Vs and root vitality of seedling of G.przewalskii
2.2.2 对根系渗透调节物质含量的影响 裸果木幼苗根系Pro 含量随着干旱胁迫程度的加剧先下降后增大(图6A)。与CK 相比,LD 和MD 处理下Pro 含量下降不明显。SD 处理下Pro 积累量显著超过其余3 个处理,与CK 相比增加了86.70%。根系SS 含量随着土壤水分的减少先增加后减少(图6B)。但LD、MD 和SD 处理下的SS 积累量均显著高于CK,分别高出70.60%、152.56%和92.01%。水分胁迫处理下,只有LD 与SD 处理之间的差异未达显著水平。随着干旱胁迫程度的增强,根系SP 含量先显著上升,而后略有下降(图6C)。LD、MD 和SD处理下SP 含量均显著高于CK,分别上升了18.28%、33.71%和29.66%。SD 和MD 处理下SP 含量差异不显著,但均显著高于LD 处理。
2.2.3 对根系丙二醛和活性氧含量的影响 裸果木幼苗根系MDA 含量随着土壤水分下降呈持续增大的趋势(图7A)。LD、MD 和SD 处理下MDA 含量均显著高于CK,增幅分别为107.97%、131.26%、231.85%,LD 与MD 处理之间差异不显著。随着土壤水分含量的减少,根系O2−含量表现出先上升后下降的变化趋势(图7B)。LD 处理O2−含量达到最大,为CK 的3.13 倍。MD 和SD 处理下O2−含量较LD 相比显著降低,幅度分别为31.86%和47.18%,但仍显著高于CK。H2O2含量随着胁迫程度的增大持续积累(图7C)。LD、MD 和SD 处理下H2O2含量均显著高于CK,分别上升了28.47%、52.79%和92.75%,而且各水分胁迫处理间差异也达到显著水平。
2.2.4 对根系抗氧化酶活性的影响 随着土壤水分含量的减少,裸果木幼苗根系SOD 活性呈现出先显著增大后减小的趋势(图8A)。胁迫处理的根系SOD 活性均明显大于CK,随胁迫程度增大,分别达到CK 的2.26、4.45 和2.87 倍。LD 和SD 处理间SOD 活性差异不显著,但均显著低于MD 处理。POD 活性随着干旱胁迫的加剧先显著下降后上升(图8B),LD、MD 和SD 处理均显著低于CK,降幅分别为35.61%、72.97%和52.53%。SD处理下POD 活性较MD 相比显著升高了75.61%,但显著低于LD。根系CAT 活性随土壤水分的减少不断增强。LD、MD 和SD 处理显著高于CK,增幅分别为35.85%、62.69%和78.20%。MD 与LD、SD 处理间差异均未达显著水平(图8C)。
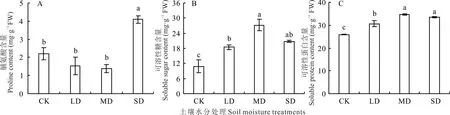
图6 水分胁迫对裸果木幼苗根系渗透调节物质含量的影响Fig.6 Effects of water stress on root osmotic regulation substance content of seedling of G.przewalskii
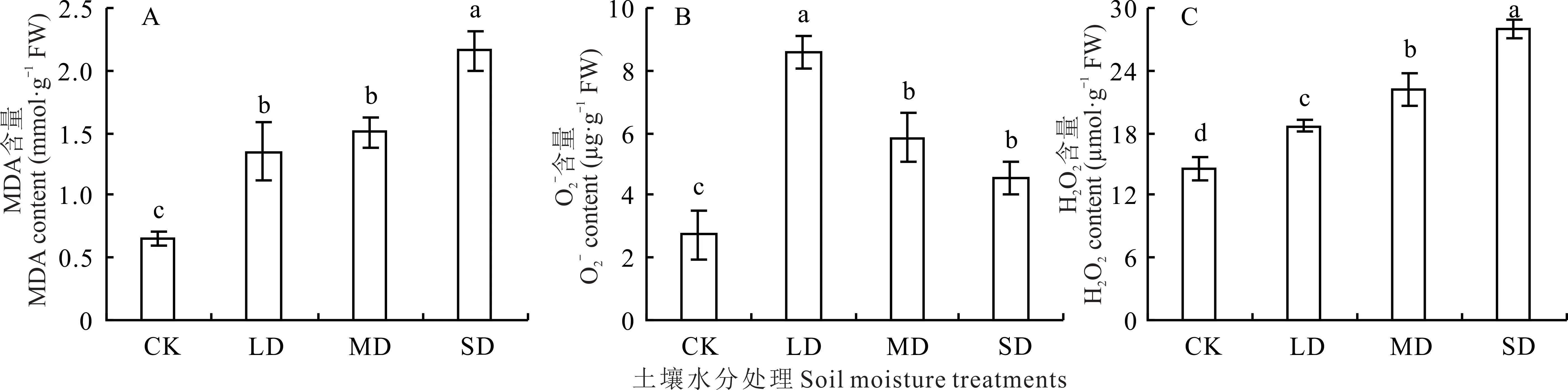
图7 水分胁迫对裸果木幼苗根系丙二醛和活性氧含量的影响Fig.7 Effects of water stress on root MDA and active oxygen content of seedling of G.przewalskii
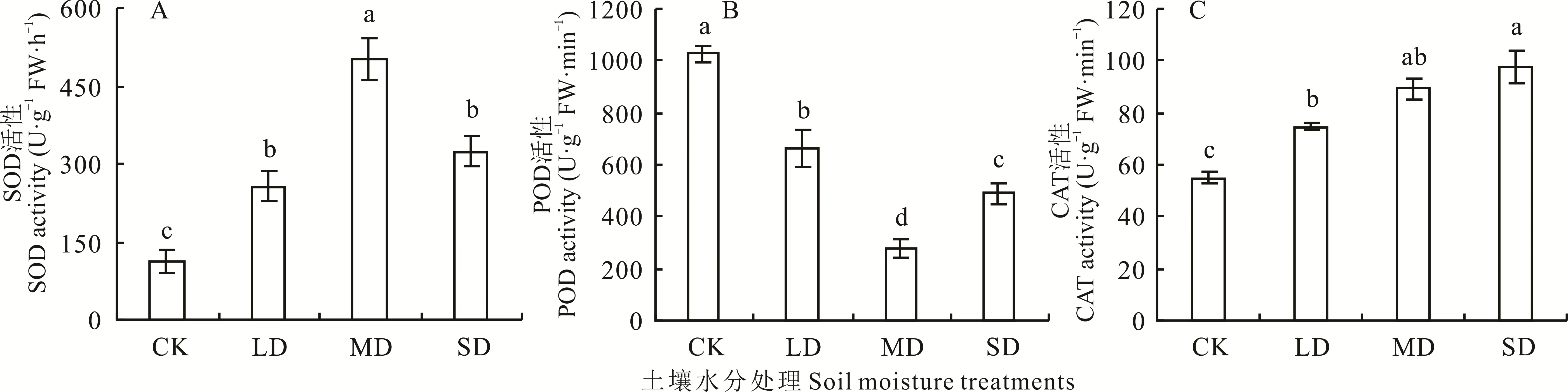
图8 水分胁迫对裸果木幼苗根系抗氧化酶活性的影响Fig.8 Effects of water stress on root antioxidant enzyme activity of seedling of G.przewalskii
3 讨论
植物对土壤水分变化的响应特征和机理是生理生态学领域的研究热点。根系的生长发育在植物响应水分胁迫过程中扮演着重要角色,还会影响植物地上部分的物质积累及形态建成。当植物遭受干旱胁迫时,根系会产生形态和生理等方面的变化来维持其功能行为,适应胁迫后的水分条件[9,12]。
在干旱生境中,植物会改变自身生物量的积累和分配格局。随着土壤水分的减少,植物会减少对非主要功能器官的干物质供给,而提高对根系生物量的分配比例来增强对水分的竞争力[13]。干旱胁迫使红砂(Reaumuria soongorica)[12]幼苗根系生物量和根冠比均显著增大。而在本研究中,水分胁迫处理使裸果木幼苗根系生物量显著降低,表明水分胁迫限制了根系生长,原因可能是水分胁迫使幼苗的光合固碳能力减弱,光合产物合成下降,向根部输送的有机物也减少[14]。根冠比则随干旱的加重呈持续上升的趋势,表明干旱条件下根系生长较地上部分受到的影响小[15],有限的光合产物更多地分配给根系以维持其吸水功能,缓解干旱的影响,与沙漠葳(Chilopsis linearis)[13]表现出类似的生物量分配响应策略。
植物根系形态的变化直接影响其对水分的吸收和利用能力。有研究指出,植物可通过增加根长、根表面积和减小根直径来提高对土壤资源的有效利用,以应对干旱[16−17]。在杉木(Cunninghamia lanceolata)[18]、栓皮栎(Quercus variabilis)[14]的研究中发现轻度胁迫能促进细根长度、表面积、体积的增大,中度和重度胁迫则抑制根系生长。而本研究结果显示,裸果木幼苗根长、根表面积随水分胁迫程度的加重不断减小,根系拓展空间的能力受到限制,且与根系生物量均存在显著的正相关关系(r分别为0.803 和0.905),这种协同变化表明裸果木根系具有较强的形态可塑性,这与张希吏[5]对沙芥(Pugionium cornutum)幼苗根系的研究结果基本一致。比根长和比表面积反映植物根系对土壤资源获取的能力[19],其值高说明植物根系呼吸作用较强,生理代谢旺盛,对水分的吸收利用效率高。细根具有较大的吸收表面积,生理活性强,对土壤水分环境反应灵敏,是根系吸收的活性位点[20]。植物在适度的水分胁迫条件下可以通过增大细根比根长和比表面积来扩大根系生存空间,产生干旱适应性[21−22]。在本研究中,裸果木幼苗就是通过显著增加细根比根长和比表面积,提高根系对水分的吸收利用效率来适应中度和重度干旱胁迫。
植物组织束缚水含量与自由水含量的比值大小与植物生长及抗性密切相关,比值大表明细胞原生质粘滞性及胶体亲水性增强,有利于植物吸水和水分保持,从而提高植物抗旱能力;比值小表明植物组织或器官的代谢活动旺盛,生长发育速率较快,但抗性较弱[23]。在本研究中,裸果木根系Va/Vs 随着干旱胁迫的加强,呈先减小后显著增大的趋势,这与段娜等[24]的研究结果基本一致,表明干旱胁迫条件下,裸果木幼苗根系的代谢强度降低,从而降低耗水,增强其抗旱性。根系活力直接影响植物对土壤营养物质和水分的汲取和利用,能够从本质上反映根系与土壤水分的动态关系[25]。本研究结果发现,裸果木幼苗根系活力随土壤水分的减少而显著下降,表明其通过降低根系的新陈代谢活动来提高抗旱能力,与栓皮栎幼苗根系活力[14]的响应模式相一致。
渗透调节是植物根系御旱的一种重要方式。在水分胁迫条件下,植物会通过细胞内渗透调节物质的积累来降低渗透势,维持细胞膨压和正常的生理过程[26]。在干旱胁迫下,许多植物体内大量积累脯氨酸,积累量越大,表明植物应对干旱的渗透调节能力越强[23]。本研究发现,水分胁迫使裸果木幼苗根系脯氨酸含量显著增加,栓皮栎幼苗细根的游离脯氨酸在水分胁迫下也显著积累[14],表明脯氨酸在根系响应干旱胁迫过程中发挥着关键作用。干旱胁迫下,植物可溶性糖的积累可以使细胞保持相对高的膨压,从而保证细胞结构和功能的相对稳定[27]。鸭茅(Dactylis glomerata)[28]、红砂[9]和柠条(Caragana korshinki)[4]幼苗根系均通过可溶性糖的主动积累适应水分胁迫。而本研究中裸果木幼苗根系可溶性糖随土壤水分减少先显著增大后减小,与沙棘(Hippophae rhamnoides)[4]根系表现出一致的变化规律,这可能与研究植物的内在调节机制及相关遗传因素有关[29]。在水分胁迫条件下,植物体内可能产生更多的蛋白质或者细胞内一些不溶性蛋白转变为可溶性蛋白,以抵抗缺水的威胁[30],芦苇(Phragmites communis)[31]和山杏(Armeniaca sibiria)根系[4]都可以通过增加可溶性蛋白含量来保持较低的细胞渗透势。而裸果木幼苗根系可溶性蛋白含量随干旱程度增加先升后降,分析其下降原因可能是活性氧大量积累使分解代谢大于合成代谢,可溶性蛋白大量降解[14,32]。
植物在胁迫条件下细胞膜的受损通常与超氧自由基增加引起膜脂过氧化有关[33]。研究发现[34],干旱胁迫条件下,O2−主要积累于根系中,根系中的H2O2主要来源于细根根尖分生区。刘艳等[35]研究显示,胁迫初期甘草(Glycyrrhiza uralensis)根系O2−和H2O2有小幅增加,随着胁迫增强,O2−和H2O2开始出现大幅累积。本研究中,随干旱胁迫程度的增大,裸果木幼苗根系O2−含量下降,但均显著高于对照,可能是对进一步干旱产生了一定的抗性。根系H2O2含量显著升高,这可能是对根系氧化胁迫的主要原因之一,与刺槐(Robinia pseudoacacia)根系对土壤含水量变化的响应基本一致[34]。MDA 作为膜脂过氧化的终产物,在干旱条件下会出现大量的积累[27−28]。研究表明,干旱胁迫会使沙芥[5]、鸭茅[28]根系的MDA 含量显著升高。裸果木幼苗根系MDA 含量随着土壤水分的减少也显著增加,表明干旱胁迫使根系发生了明显的膜脂过氧化作用。
植物在发展进化过程中,形成自身能够清除活性氧的保护酶系,如SOD、POD、CAT 等[33],它们的变化幅度可以反映植物的抗逆性[36]。SOD 是最核心的抗氧化酶,催化O2−发生歧化作用起到清除O2−的解毒作用,而SOD歧化反应产生的H2O2仍对细胞具有毒害作用,POD、CAT 正是清除植物体内的H2O2[31]的酶类,三者协同作用降低膜脂过氧化水平,以维持细胞膜的完整性。研究表明[9,37],干旱胁迫后,植物体内的抗氧化酶活性会不同程度的上升,增幅与抗旱能力呈正相关。本研究表明,裸果木幼苗根系SOD 活性随着土壤水分含量的减少先显著增加后减小,鸭茅[28]和红砂[9]根系也表现出类似的变化规律,说明干旱胁迫下,根系SOD 启动了抗氧化机制,重度干旱下活性氧积累较多,超出SOD 的清除能力范围,也可能是因为增加的H2O2钝化了SOD 活性[38]。CAT 活性随着土壤水分含量减少持续上升,与H2O2含量之间呈极显著正相关(r=0.798,P<0.01),表明CAT 对清除H2O2起关键作用,田艳[39]的研究也证实了这一结论。POD 活性在水分胁迫下显著下降,可能是POD 参与了多元不饱和酸的过氧化[40],或 是POD 活 性受到了抑制[41],而且POD 活性与H2O2含量之间呈极显著负相关(r=−0.735,P<0.01),表明裸果木幼苗根系没有启动POD 清除H2O2的机制,这与李海超[42]在刺槐研究中得出的结论相似。
土壤的不透明性严重限制了对根系功能的认识,相比较地上部分功能性状的研究,根系研究仍相对滞后。考虑到便于控制水分,本研究中仍采用传统的盆栽法,但由于受容器限制,可能会影响根系生长,使测定数据与实际情况不相符,今后还需要通过野外控制试验进一步开展研究。
4 结论
1)水分胁迫对裸果木幼苗根系生长有明显的抑制作用。裸果木幼苗通过增大根系的生物量分配比例、增加细根的比根长和比根表面积,来提高对水分的吸收利用效率,增强抗旱能力。2)随着干旱胁迫的增强,根系活力先显著减小后增大,而Va/Vs 显著增大,表明根系通过降低代谢强度来提高自身抗旱能力,以抵御和适应干旱胁迫。3)干旱胁迫下,裸果木幼苗根系主动积累渗透调节物质,Pro 含量先减小后显著增大,而SS 和SP 含量先显著增大后减小,通过3 种渗透调节物质的相互补偿作用,增强渗透调节能力,提高抗旱性。4)裸果木幼苗受到水分胁迫时,根系MDA、H2O2和O2−含量均显著增大,膜系统受到明显损伤,根系通过调动SOD、CAT 的清除活性氧功能,以减轻胁迫伤害。

