羊草根际促生菌的分离筛选及促生作用研究
漫静,唐波,邓波,李佳欢,何玉娟,张佳良
(1.中国农业大学草业科学与技术学院,北京100193;2.中国科学院植物研究所植被与环境变化国家重点实验室,北京100093;3.中国科学院大学资源与环境学院,北京100049)
根际(rhizosphere)是植物根系周围受根系影响的狭小区域,根际中包含着大量的微生物,如细菌、真菌及病原菌,其中有一类细菌能通过不同的作用方式来促进植物的生长发育,这类细菌被称为植物根际促生细菌(plant growth-promoting rhizobacteria,PGPR)[1−2]。大量研究表明,一方面PGPR 能够通过固氮、溶解土壤中的无机磷、有机磷及分泌植物激素如生长素(indole-3-acetic acid,IAA)而直接促进植物生长发育[3−4]。另一方面,当植物处于盐碱、干旱等非生物胁迫时或遭受病原菌等生物胁迫时,植物体内乙烯水平会大幅升高,这种由于胁迫导致的植物体内过量的乙烯严重阻碍了植物的生长发育甚至会导致植物死亡。根据研究发现,有一类PGPR 能够通过分泌1-氨基环丙烷-1-羧酸脱氨酶(1-aminocyclopropane-1-carboxylate deaminase,简称ACC 脱氨酶),将乙烯合成前体ACC(1-aminocyclopropane-1-carboxylate)分解转化为α-酮丁酸(α-ketobutyrate acid,α-KA)和氨,从而避免或降低逆境中乙烯对植物的伤害,而间接促进植物生长发育[5−6]。基于PGPR 具有能够促进植物生长的这些特性,可代替化肥与农药,从而改善过量施用化肥和农药对土壤环境严重污染的现状,因此,开发高效的PGPR 菌剂成为目前研究的热点之一。
羊草(Leymus chinensis)是禾本科赖草属根茎型多年生牧草,为欧亚大陆草原东部区的重要建群植物,主要分布于我国的东北3 省及内蒙古、河北、新疆等省区。由于羊草主要生长于草原区域,因此对不同的生境有很强的适应性,具有耐旱、耐寒、耐盐碱的生态特性,该物种在改良盐碱地,保持水土等方面起着重要作用[7]。
目前,众多学者已从小麦(Triticum aestivum)、玉米(Zea mays)等粮食作物中分离筛选出优良的PGPR 菌株并用于后续菌剂的研发[8−10],但对草地牧草植物PGPR 资源的挖掘及促生潜力的研究相对较少。此外,PGPR 的数量分布及促生特性不仅与植物种类有关,还与植物所处的环境和土壤条件密切相关[11]。因此,本研究从不同地区的天然草地羊草根际分离筛选PGPR 菌株,并初步研究菌株的促生特性,从而为特定生境下羊草PGPR 菌剂的开发提供理论依据和菌种资源。
1 材料与方法
1.1 样品采集
2015 年6 月中旬−7 月,选择羊草生长的主要地区即黑龙江省草业研究所兰西试验基地(Lanxi,LX,46°32′N,125°28′E,海拔160 m)、内蒙古锡林郭勒草原白音锡勒牧场(Xilinhot,XLHT,44°08′N,117°05′E,海拔1224 m)和内蒙古呼伦贝尔海拉尔区谢尔塔拉牧场(Hulun Buir,HLBE,49°19′N,119°55′E,海拔628 m)3 个样地,采集长×宽×高为10 cm×10 cm×30 cm 的包含羊草根系的土块,每个采样区采集5 个,共15 个土块。分别将各样区采集的包含羊草根系的土块放入无菌自封袋中,于4 ℃冰盒中保存,带回实验室立即进行PGPR 的分离与筛选。
1.2 试验所用培养基
无氮培养基(nitrogen free medium,NFM)用于固氮菌的分离[12];PKO(Pikovaskaia’s)无机磷培养基用于溶解无机磷细菌的分离[Ca3(PO4)2为唯一磷源];蒙金娜有机磷培养基用于溶解有机磷细菌的分离(蛋黄卵磷脂为唯一磷源)[13];PAF(Pseudomonas agar F)、DF 盐(Dworkin and Foster)、ADF 培养基用于含ACC 脱氨酶促生菌的富集与分离[14];溶菌肉汤培养基(Luria-Bertani,LB)用于固氮菌和溶磷菌的保存;胰蛋白胨大豆肉汤培养基(tryptic soybean broth,TSB)用于含ACC 脱氨酶促生菌的保存[14]。
NFM 培 养 基:CaCl2·2H2O 0.02 g,MgSO4·7H2O 0.2 g,K2HPO40.5 g,NaMoO4·2H2O 0.002 g,NaCl 0.1 g,KOH 4.5 g,苹果酸5.0 g,生物素10 μg,0.5%溴百里酚蓝5 mL,琼脂18 g(半固体培养基加2 g,液体培养基不加),蒸馏水1000 mL,pH 7.0;
PKO 无机磷培养基:葡萄糖10.0 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.1 g,NaCl 0.2 g,KCl 0.2 g,FeSO4·7H2O 0.003 g,MnSO4·4H2O 0.03 g,Ca3(PO4)25.0 g,酵母粉0.5 g,琼脂18 g(液体培养基不加),蒸馏水1000 mL,pH 7.0;
蒙金娜有机磷培养基:葡萄糖10.0 g,MnSO4·4H2O 0.03 g,FeSO4·7H2O 0.03 g,CaCO35.0 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,蛋黄卵磷脂0.2 g,酵母粉0.4 g,琼脂18 g(液体培养基不加),蒸馏水1000 mL,pH 7.0~7.5;
PAF 培养基:蛋白胨10.0 g,酪蛋白水解物10.0 g,MgSO4·7H2O 1.5 g,K2HPO41.5 g,甘油10 mL,蒸馏水1000 mL,pH 7.5;
DF 盐培养液:KH2PO44.0 g,Na2HPO46.0 g,MgSO4·7H2O 0.2 g,FeSO4·7H2O 0.1 g,葡萄糖2.0 g,葡萄糖酸2 mL,柠檬酸2.0 g,(NH4)2SO42.0 g,ZnSO4·7H2O 0.1246 mg,CuSO4·5H2O 0.0782 mg,MnSO40.0112 mg,MoO30.01 mg,H3BO30.01 mg,蒸馏水1000 mL,pH 7.5;
ADF 培养基:KH2PO44.0 g,Na2HPO46.0 g,MgSO4·7H2O 0.2 g,FeSO4·7H2O 0.1 g,葡萄糖2.0 g,葡萄糖酸2 mL,柠檬酸2.0 g,ZnSO4·7H2O 0.1246 mg,CuSO4·5H2O 0.0782 mg,MnSO40.0112 mg,MoO30.01 mg,H3BO30.01 mg,蒸馏水1000 mL,pH 7.5,琼脂20 g(液体培养基不加)。培养基高温灭菌后加入1-氨基环丙烷-1-羧酸(ACC),使其终浓度达到3.0 mmol·L−1;
LB 培养基:NaCl 10.0 g,胰蛋白胨10.0 g,酵母粉5.0 g,琼脂20.0 g,蒸馏水1000 mL,pH 7.0~7.5;
TSB 培养基:K2HPO42.5 g,NaCl 5.0 g,葡萄糖2.5 g,大豆蛋白胨3.0 g,胰蛋白胨17 g,蒸馏水1000 mL,pH 7.5,琼脂20 g(液体培养基不加)。
1.3 羊草根际促生菌的分离
1.3.1 固氮菌与溶磷菌的分离 为了便于研究,本试验将羊草根际细分为距根系较远土壤(soil away from roots,NRS)、根表土壤(soil adhering to roots,RS)、根系表面(rhizoplan of roots,RP)和根内(histoplan of roots,HP)4 个区域,并通过平板涂布法分别对这4 个区域的PGPR 进行分离筛选[15]。具体方法如下:取羊草根系周围(5~15 mm)的土壤样品10 g,磨细后溶于90 mL 已灭菌的0.85%的生理盐水中,200 r·min−1充分震荡30 min 后静置,所获上清液即为10−1的NRS 稀释液,按照梯度稀释的方法依次制备10−2、10−3、10−4和10−5的NRS 稀释液,备用。取已抖落表面虚土的羊草根系1 g,放入盛有9 mL 已灭菌的0.85%的生理盐水的试管中,800 r·min−1离心2 min 后静置,上清液即为10−1的RS 稀释液,梯度稀释依次制备10−2、10−3、10−4和10−5的RS 稀释液,备用。取出上一步经过离心的根系,用无菌水冲洗2~3 次后放入盛有9 mL 已灭菌的0.85%的生理盐水的试管中,同时加入灭菌小石子,1000 r·min−1离心10 min 后静置,上清液即为10−1的RP 稀释液,梯度稀释依次制备10−2、10−3、10−4和10−5的RP 稀释液,备用。取出上一步离心过的根系,用70%的无水乙醇浸泡30 s 后放入2%的次氯酸钠(NaClO)中处理5 min,之后用无菌水反复冲洗5 次,并用无菌滤纸吸干根系表面水分,之后放于研钵中进行研磨,用9 mL 已灭菌的0.85%的生理盐水冲洗研钵,将研钵中的生理盐水连同根系一同转入离心管中,1500 r·min−1离心5 min,上清液即为10−1的HP 稀释液,梯度稀释依次制备10−2、10−3、10−4和10−5的HP 稀释液,备用[16]。
分别吸取上述制备好的羊草根际4 个区域的10−3、10−4和10−5的稀释液50 μL,分别涂布于NFM、PKO 和蒙金娜固体培养基上进行固氮菌、溶解无机磷和溶解有机磷细菌的分离,根际每个区域、每个浓度梯度均做3 个平行涂布。无菌玻璃刮刀涂抹均匀后倒置于温度为28 ℃的培养箱中暗培养。待菌落长出后,挑取NFM 培养基上菌落较大的单个菌落于新的NFM 上进行平板划线,获得的纯的单个菌落即为固氮菌。分别挑取PKO 和蒙金娜培养基上菌落周围形成明显透明圈的单个菌落于新制备的各自的固体培养基上进行平板划线,获得纯的、菌落较大、溶磷圈明显的即为溶磷菌。分离出的固氮菌和溶磷菌分别接种于LB 斜面培养基上,4 ℃冰箱保存备用[16]。
1.3.2 含ACC 脱氨酶的PGPR 分离 称取羊草根系周围(5~15 mm)的土壤样品1 g,磨细后溶于50 mL 的PAF 液体培养基中,置于28 ℃,200 r·min−1的摇床中暗培养24 h。取此时得到的PAF 培养液1 mL 于50 mL 已灭菌的PAF 液体培养基中,28 ℃,200 r·min−1再次暗培养24 h。之后取该PAF 培养液1 mL 于50 mL 已灭菌的DF液体培养基中,相同条件培养24 h。之后取该DF 培养液1 mL 于50 mL 已灭菌的ADF 液体培养基中,同等条件再次培养24 h,此过程为含ACC 脱氨酶活性菌株的富集过程。取最后一步富集得到的ADF 培养液1 mL,用0.85%的生理盐水梯度稀释形成10−3、10−4和10−5的稀释液,即为NRS 稀释液。抖落羊草根系表面虚土,用镊子将仍附着在羊草根系表面的土壤刮入灭菌三角瓶中。称取该土壤1 g 于50 mL PAF 液体培养基中,置于28 ℃,200 r·min−1的摇床中暗培养24 h。按照上述NRS 稀释液的制备方法,进行RS 稀释液的制备。取上述抖落表面土壤的根系,无菌水冲洗5 次后,剪成1 cm 的小段,用石蜡油封住两端,将该样品放入10 mL 的PBS 缓冲液中浸泡10 min,150 r·min−1震荡30 min,取上清液1 mL 于50 mL PAF 液体培养基中,置于28 ℃,200 r·min−1的摇床中暗培养24 h。同样按照上述NRS 稀释液的制备方法,进行RP 稀释液的制备。将无菌水冲洗后的羊草根系无菌条件下用0.01%的Tween 20 处理30 s,8% NaClO 消毒5 min,无菌水冲洗后用75%酒精浸泡5 min,再次用无菌水冲洗并吸干根系表面水分,之后进行研磨。转移1 mL 研磨液于50 mL 的PAF 液体培养基,置于28 ℃,200 r·min−1的摇床中暗培养24 h。同样按照上述NRS 稀释液的制备方法,进行HP 稀释液的制备[14]。
分别吸取浓度为10−3、10−4和10−5的根际4 个区域的稀释液50 μL 涂布于ADF 固体培养基上,根际每个区域、每个浓度梯度均3 次重复。无菌玻璃刮刀涂抹均匀后倒置于28 ℃的培养箱中培养3 d 后,挑取培养基上生长良好的单菌落进行纯化,直至获得纯的单个菌落后,挑选较大的菌株接种于TSB 斜面培养基上,4 ℃冰箱保存。
1.4 羊草根际促生菌促生能力的测定
1.4.1 固氮能力 乙炔还原法测定1.3.1 中分离出的羊草根际固氮菌的固氮酶活性,单位为nmol C2H4·mL−1·h−1[16]。
1.4.2 溶磷能力 溶磷圈法进行定性测定,也就是将1.3.1 中初步分离出的具有溶解无机磷和有机磷的细菌分别接种于PKO 无机磷和蒙金娜有机磷培养基上,每个菌株3 个重复,测定各菌株形成的溶磷圈直径(D)和菌落直径(d),根据D/d 值的大小对菌株的溶磷能力进行初步判断。溶磷菌溶磷能力的定量测定:将D/d 值大于1.5的菌株作为初筛菌株,并对这些菌株的溶磷能力进行定量测定。将菌株活化后,吸取500 μL 悬浮液(OD600=0.5)接种于50 mL 的PKO 液体培养基中,每个菌株3 个重复,以不接菌的PKO 培养基为对照,28 ℃、180 r·min−1摇床中培养7 d 后,取5 mL 培养液,用钼蓝比色法测定菌株溶解无机磷的能力。1.3.1 中蒙金娜培养基中分离出来的菌株溶解有机磷能力的测定方法同PKO 培养基中分离出的菌株溶解无机磷能力的测定,但培养基换为蒙金娜培养基。
1.4.3 ACC 脱氨酶活性的测定 ACC 脱氨酶活性的测定参照Penrose 等[14]的方法。
1.4.4 分泌IAA 能力的测定 对1.4.1~1.4.3 中已测定的具有较高固氮酶活性、溶磷能力和ACC 脱氨酶活性的菌株进行分泌IAA 能力的测定。测定方法为定性显色法和Salkowski 定量比色法[17]。
1.5 羊草根际优良PGPR 菌株试管接种效应研究与鉴定
筛选出1.4 中已测定的具有优良促生特性(即固氮酶活性较高、溶磷能力较强、ACC 脱氨酶活性或分泌IAA能 力 较 强)的 菌 株,包 括LNR24、HPS14、XMS12、XPR2、HAR7、LAH29、HPR6、HPN17、XMH1、XPR1 和HPR1,共11 株,制备PGPR 接种剂。分别接种各PGPR 菌株于50 mL 的LB 液体培养基中,28 ℃,125 r·min−1培养48 h,之后用无菌水调节各菌株菌悬液浓度为1×108cfu·mL−1,接种此时得到的各菌悬液20 mL 于含有150 mL 已灭菌的LB 液体培养基中,相同条件再次进行培养,之后再次调节其浓度为1×108cfu·mL−1,此时获得的即为单一PGPR 菌株的接种剂[16]。

图1 PGPR 菌株试管接种试验Fig.1 In vitro inoculation test of PGPR strains
挑选饱满的羊草种子后用70%的酒精浸泡5 min,之后用2%的NaClO 处理10 min,无菌水冲洗5 次后,置于铺有双层滤纸、含适量蒸馏水的培养皿,之后在光照培养箱中进行催芽,催芽条件为30 ℃(8 h,光照)/20 ℃(16 h,暗培养)[18]。当种子萌发至3~4 cm 时,挑选长势较好的幼苗转接到20 mL 已灭菌的Hoagland 半固体难溶磷培养基的试管中,每个试管1 株幼苗,置于光照培养箱中培养3~4 d,培养条件为28 ℃(16 h,光照)/20 ℃(8 h,暗培养),之后再次挑选出生长一致的幼苗试管,分别接种各单一PGPR 菌株接种剂500 μL,以不接菌为对照,每个处理3 次重复,培养周期为20 d。培养结束后,将试管中的幼苗取出并用无菌水冲洗,立即测定羊草株高、叶片数、地上和地下部分干重(图1)。
筛选出的11 株优良PGPR 菌株的鉴定采用16S rRNA 基因序列比对。菌株DNA 的提取、16S rRNA 的PCR扩增及序列测定均由北京三博远志生物技术有限责任公司完成。将测得的16S rDNA 序列在数据库中进行序列检索,并与已测定的细菌菌株的16S rDNA 序列进行同源性比较。用MEGA 4 构建分子进化树,采用Neighbor-Joining 法的Complete Deletion 模式建树,用Bootstrap 进行检验,并重复1000 次。
1.6 数据分析
采用SPSS 16.0(SPSS Inc.,Chicago,IL,USA)对数据进行单因素方差分析,采用Duncan 法进行多重比较。
2 结果与分析
2.1 羊草根际PGPR 的筛选及分布
通过选择性培养基,从3 个不同采样点的羊草根际初步分离出固氮菌226 株,溶解无机磷细菌112 株,溶解有机磷细菌191 株,含ACC 脱氨酶的细菌183 株。其中,HLBE 地区分离出的羊草根际固氮菌和溶磷菌的数量最多,LX 地区最少,但LX 地区分离到的羊草根际含ACC 脱氨酶的菌株最多(图2A)。在同一取样地下,羊草根际不同部位分离到的PGPR 的数量也不尽相同(图2B)。总体而言,RS 和RP 两个部位分离到的羊草PGPR 的数量大于NRS 和HP 两个部位分离到的PGPR。
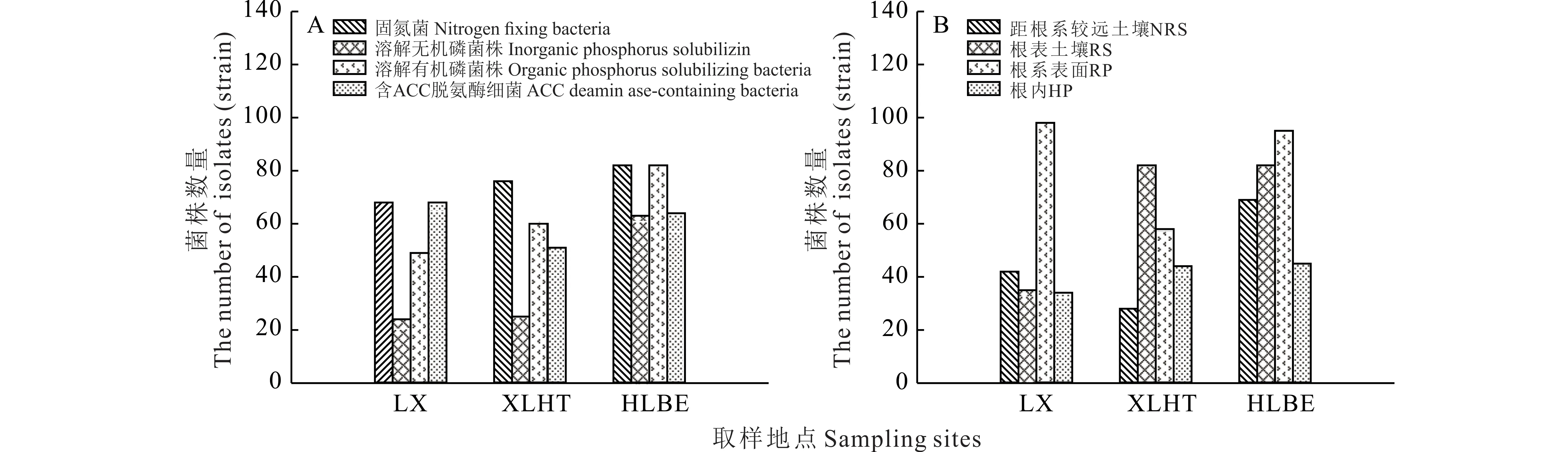
图2 不同地区羊草根际PGPR 数量分布Fig.2 The distribution of PGPR in rhizosphere of L.chinensis in different areas
2.2 菌株固氮酶活性
通过乙炔还原法对初步分离出的226 株固氮菌的固氮酶活性测定发现,仅有20 株具有固氮酶活性,占供试菌株的9%。其中18 株来自LX 地区(菌株编号以L 开头),剩余2 株分离于XLHT 地区(菌株编号以X 开头),而HLBE 地区并未分离到具有固氮酶活性的固氮菌。在这20 株菌中,菌株LNR24 的固氮酶活性最高,可达(11.63±0.79)nmol C2H4·mL−1·h−1,该菌分离自LX 地区的羊草根表(图3)。
2.3 菌株溶磷特性
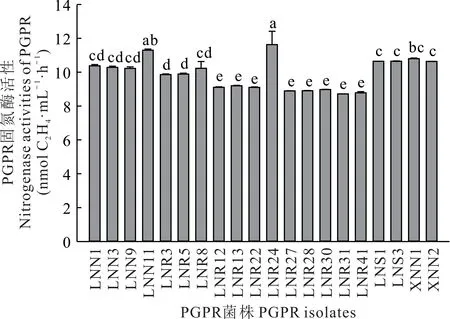
图3 羊草根际固氮菌固氮酶活性Fig.3 Nitrogenase activities of nitrogen fixing strains in the rhizosphere of L.chinensis(mean±SE,n=3)
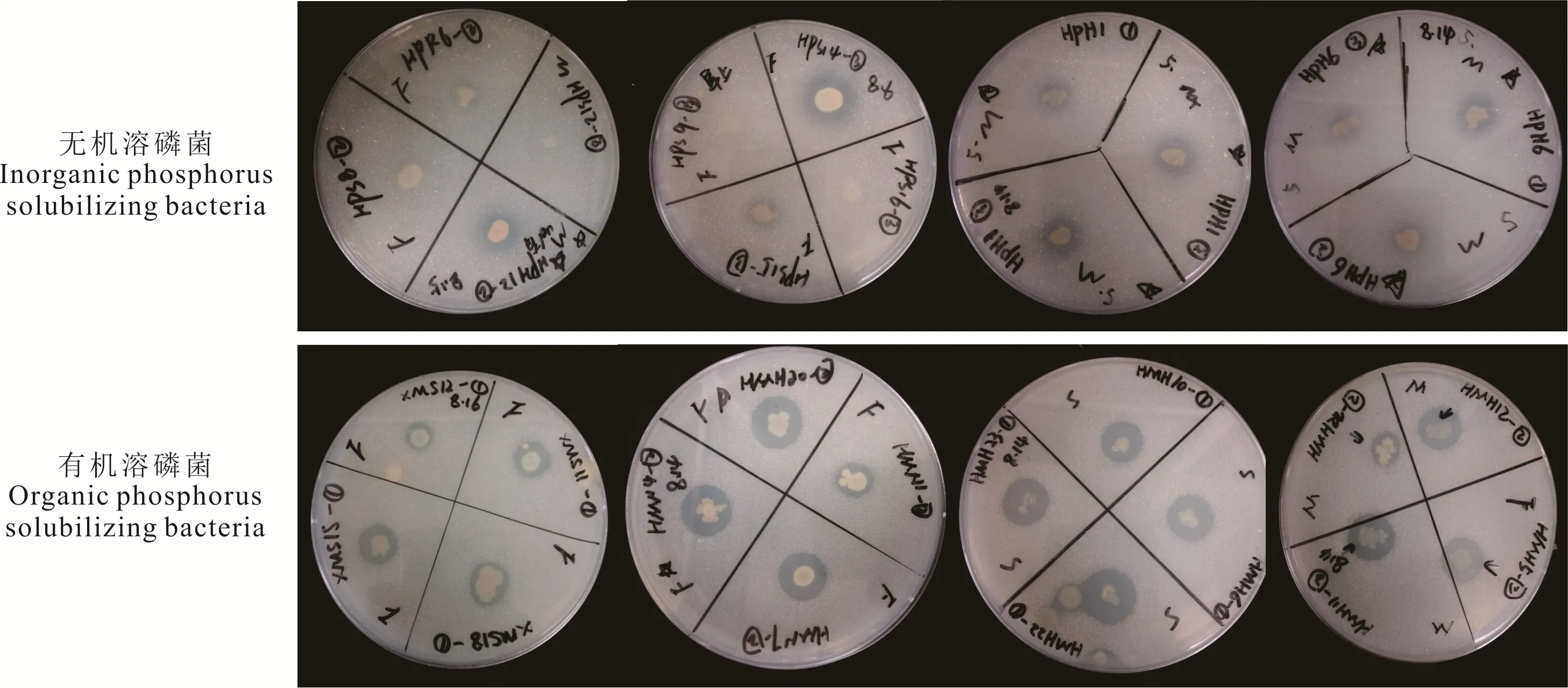
图4 部分无机及有机溶磷菌溶磷能力Fig.4 Qualitative determination of phosphate-solubilizing ability of some inorganic- and organic phosphorus solubilizing bacteria
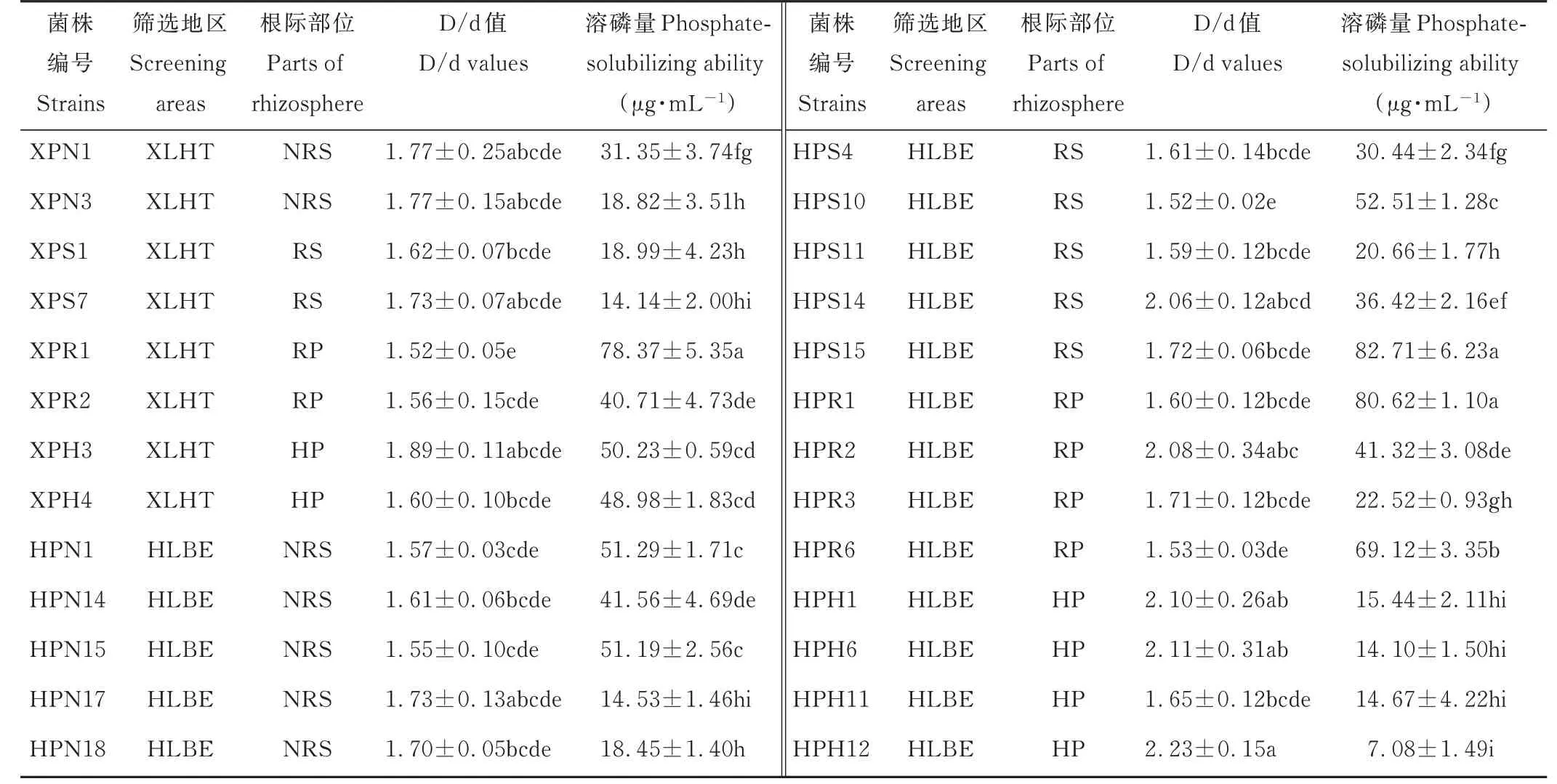
表1 不同地区羊草根际不同部位溶解无机磷细菌溶磷能力Table 1 Phosphate-solubilizing ability of inorganic phosphorus solubilizing bacteria in different areas and different regions of L.chinensis rhizosphere(mean±SE,n=3)
将初步分离出的112 株溶解无机磷的细菌点接于PKO 培养基上,根据形成的溶磷圈的大小对其溶磷能力进行定性测定(图4)。结果表明,112 株菌中仅有26株的D/d 值大于1.5,这些菌株主要分离自XLHT 和HLBE 地区,LX 地区未分离到。菌株HPH12 的D/d值最大,而菌株XPR1 和HPS10 的最小(表1)。对这些初步筛选出的溶解无机磷的细菌,根据其溶解Ca3(PO4)2的能力,对其溶磷能力进行定量测定。结果表明,菌株XPR1、HPS15 和HPR1 的溶磷能力显著高于其他菌株,溶磷量分别为(78.37±5.35)μg·mL−1、(82.71±6.23)μg·mL−1和(80.62±1.10)μg·mL−1,而菌株HPH12 的溶磷能力最弱,溶磷量为(7.08±1.49)μg·mL−1(表1)。
同样,对初步分离出的191 株溶解有机磷的细菌的溶磷能力进行定性测定发现,仅有36 株的D/d 值大于1.5,其中,LX 地区分离到1 株,XLHT 地区分离到11 株,HLBE 地区分离到24 株(图4 和表2)。对这些初步筛选出D/d 值大于1.5 的溶解有机磷的细菌的溶磷能力进行定量测定发现,分离自XLHT 地区的编号为XMS15 和分离自HLBE 地区的编号为HMN3 的菌株,溶解蛋黄卵磷脂的能力显著高于其他菌株,分别为(31.19±2.05)μg·mL−1和(32.48±4.34)μg·mL−1(表2)。
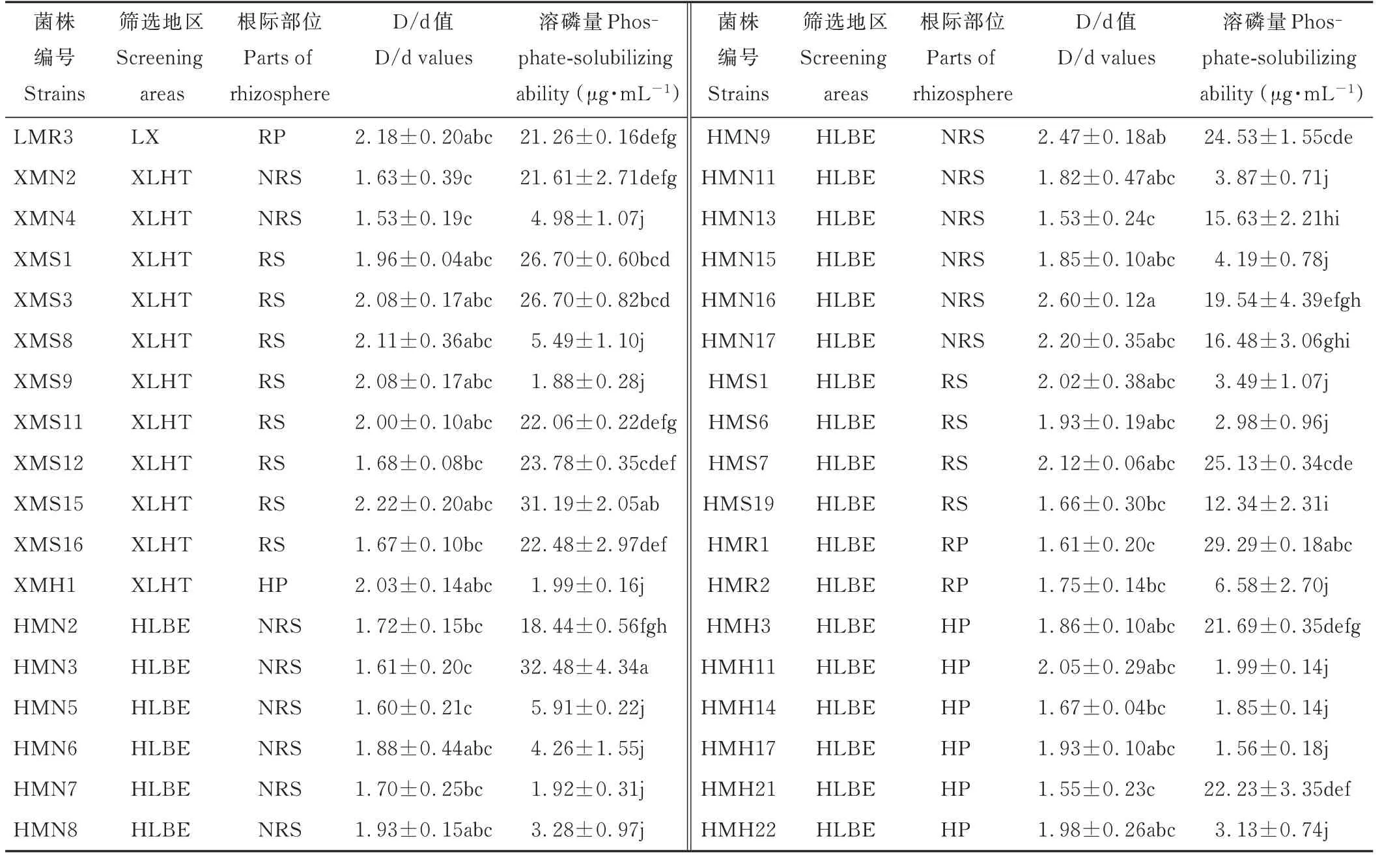
表2 不同地区羊草根际不同部位溶解有机磷细菌溶磷能力Table 2 Phosphorus solubilizing ability of organic phosphorus solubilizing bacteria in different areas and different regions of L.chinensis rhizosphere(mean±SE,n=3)
2.4 菌株分泌ACC 脱氨酶的活性
对初步分离出的分泌ACC 脱氨酶活性菌株进行酶活性测定发现,183 株中仅有60 株菌具有ACC 脱氨酶活性,酶活性范围为0.04~64.31 μmol α-KA·mg−1Pr·h−1(表3)。
2.5 菌株分泌IAA 能力
挑选固氮酶活性较高、溶磷能力较强及ACC 脱氨酶活性较高的39 株PGPR 菌株,对其分泌IAA 能力进行定性分析。结果表明,这些菌株均具有分泌IAA 的能力,颜色由粉红色到红褐色。进一步进行定量分析,结果表明,这39 株PGPR 的IAA 分泌量在(3.27±0.18)~(48.97±3.56)μg·mL−1。分泌量大于10 μg·mL−1的仅有10株,大部分菌株的分泌量较低。菌株LMR3 的分泌量最大,显著高于其他菌株(表4)。
2.6 羊草根际优良PGPR 菌株试管接种效应
由图5 可知,各菌株处理对羊草幼苗株高、地上和地下生物量均有不同程度的影响。与对照[CK,(22.20±0.58)cm,(0.0461±0.0069)g]相比,接种菌株HPS14 和XPR2 增加了羊草株高和地上生物量,株高分别增加了49.0%和16.8%,地上生物量分别增加了89.2%和28.9%。而接种菌株HPR6、XMH1、XPR1 和HPR1 显著降低了羊草株高和地上生物量,株高分别降低了29.7%,64.9%,65.2%和67.3%,地上生物量分别降低了61.6%,68.0%,78.8%和76.1%。大部分菌株处理下的羊草地下生物量显著高于对照(0.0038±0.0007)g·plant−1,其中HPS14、XPR2 和HPR1 处理下 的 羊 草 地 下生物量均较大,分 别 为(0.0129±0.0018)g·plant−1,(0.0128±0.0018)g·plant−1和(0.0162±0.0029)g·plant−1。
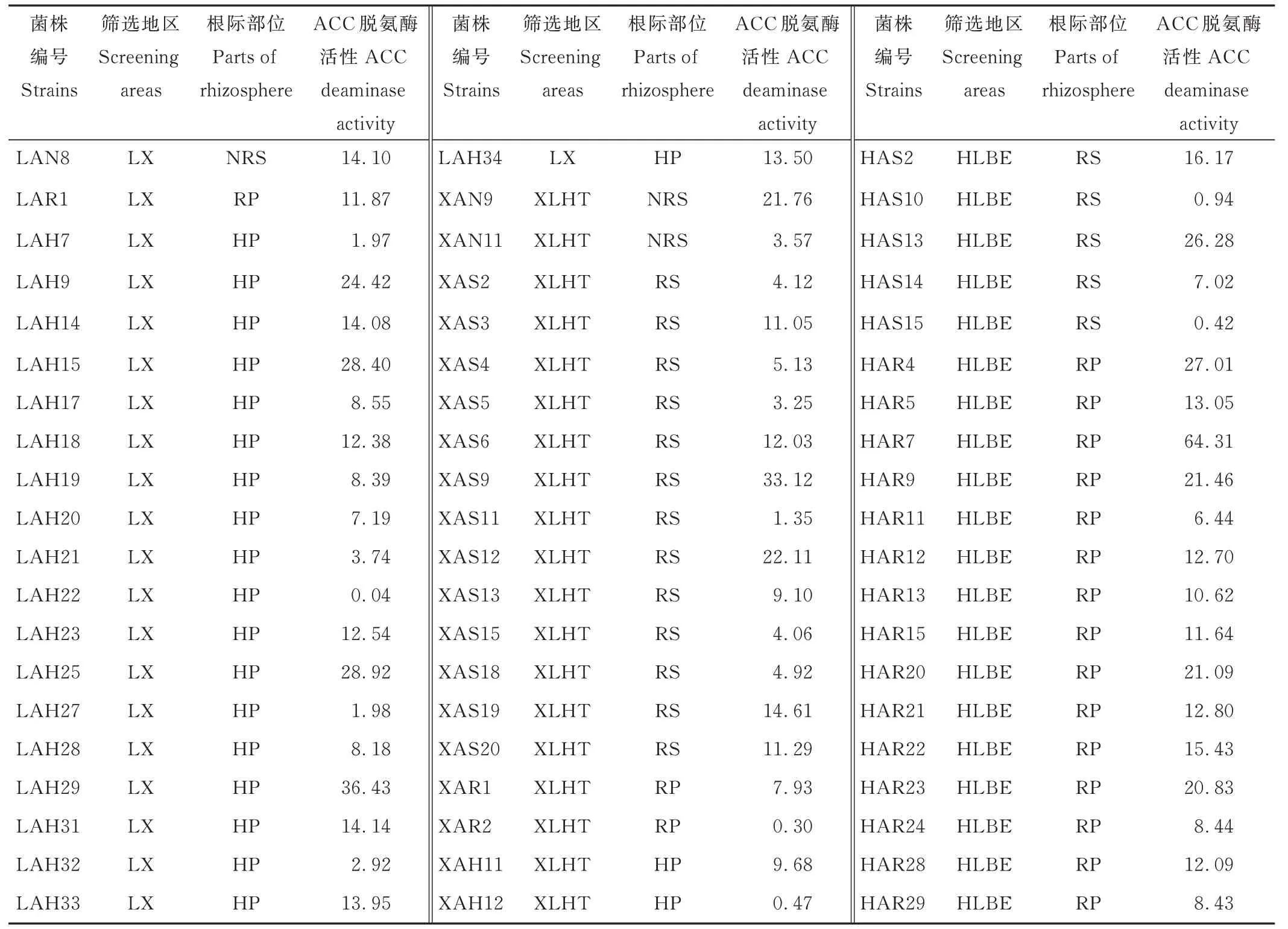
表3 PGPR 菌株ACC 脱氨酶活性Table 3 ACC deaminase activity of PGPR isolates(μmol α-KA·mg-1 Pr·h-1)
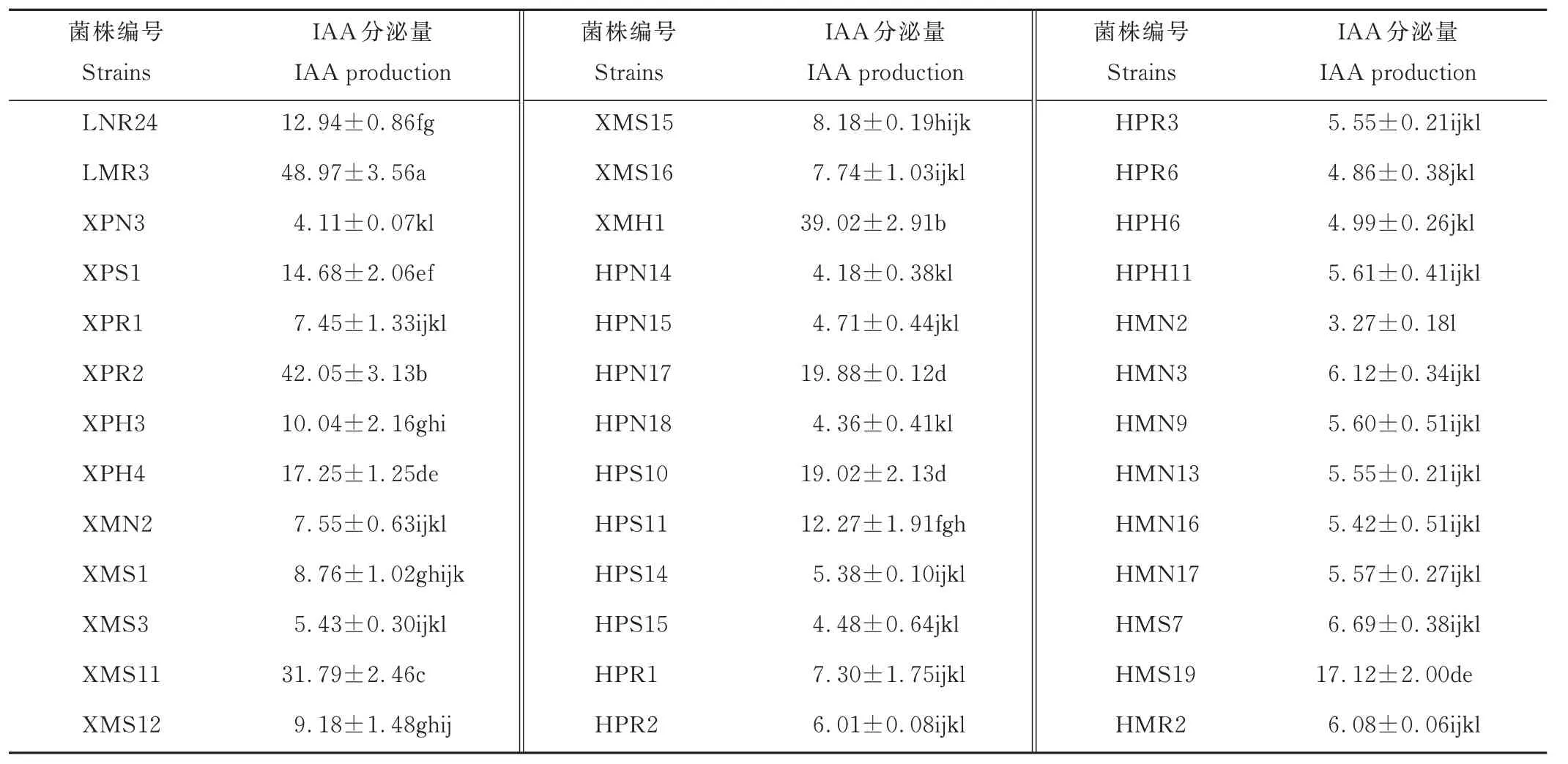
表4 优良PGPR 菌株分泌IAA 能力Table 4 IAA production by PGPR isolates(mean±SE,n=3,μg·mL-1)
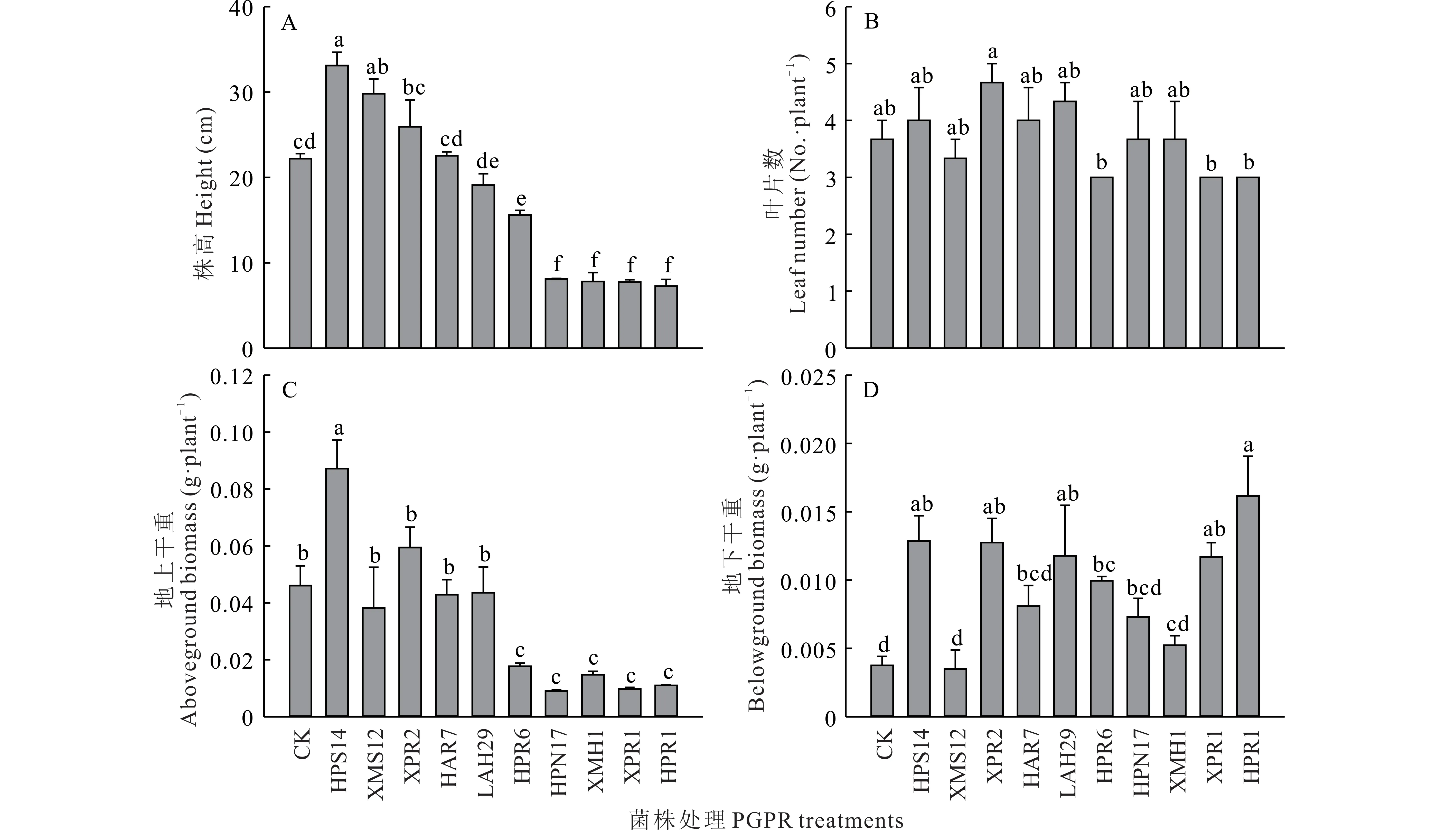
图5 各菌株处理对羊草幼苗形态指标和生物量的影响Fig.5 Effects of different treatments on morphological indexes and biomass of L.chinensis seedlings(mean±SE,n=3)
2.7 羊草根际优良PGPR 的鉴定
对上述11 株PGPR 菌株进行16S rRNA 鉴定发现,菌株LNR24、XMH1 和XPR1 为同一菌株(半透明黄单胞菌,Xanthomonas translucens,AB680445),与Xanthomonassp.具有很高的同源性(99%),属于黄单胞菌属。菌株LAH29(埃里米黄杆菌,Chryseobacterium elymi,NR115851)为金黄杆菌属。菌株XMS12(伊夫弧菌,Phyllobacterium ifriqiyense,KJ734886)、XPR2(柔毛杆菌,Phyllobacterium loti,NR133818)、HPR6(桃金娘支杆菌Phyllobacterium myrsinacearum,AY512821)和HPN17(HQ380017)与Phyllobacteriumsp.具有很高的同源性,为叶杆菌属。菌株HPS14 属于Inquilinus ginsengisoli(GU201848)。菌株HPR1(泛菌,Pantoea conspicua,HF562884)为泛菌属。菌株HAR7(产气肠杆菌,Enterobacter aerogenes,KU500561)为肠杆菌属。
3 讨论
研究表明,PGPR 的数量分布不仅与植物种类及同一物种的不同品种有关,还受植物所处的环境条件的影响[11]。因此,从不同环境条件下分离和筛选PGPR 菌株是获得高效功能菌株的基础。本研究从LX、XLHT 和HLBE 3 个地区分离到的具有不同促生特性的PGPR 菌株的数量不同,说明羊草根际PGPR 菌株的分布受到了不同地区气候条件、土壤等因素影响。此外,本研究发现距离根系越近的部位分离到的PGPR 的数量越多,如从羊草根表土壤(RS)与根系表面(RP)两个部位分离到的PGPR 的数量高于从远根土壤(NRS)和根内(HP)分离到的,引起这种现象的原因可能是可溶性化合物沿根的分布距离不同,使得根际微生物数量不同,进而表现出了根际效应[19]。
对初步分离出的菌株进行促生特性的研究发现,226 株固氮菌中仅有20 株表现出了固氮酶活性,活性范围为(8.71±0.01)~(11.63±0.79)nmol C2H4·mL−1·h−1。同样,112 株溶解无机磷和191 株溶解有机磷细菌中D/d值大于1.5 的也仅有26 和36 株,溶磷量范围分别为(7.08±1.49)~(82.71±6.23)μg·mL−1和(1.56±0.18)~(32.48±4.34)μg·mL−1。而183 株含ACC 脱氨酶的菌株中仅有60 株菌具有ACC 脱氨酶活性。这些研究结果表明羊草根际虽然存在着大量的PGPR 资源,但真正具有开发潜力的、促生特性较好的、可以用于后续菌剂研发的优良PGPR 菌株非常少。与以往研究相比,本研究筛选出的羊草根际固氮菌的固氮酶活性与溶磷菌的溶磷量较低,如胡春锦等[20]采用Ashby 培养基从甘蔗(Saccharum officinarum)根际土壤和根样品中分离出的36 株固氮菌中,酶活性最高的可达1143.39 nmol C2H4·mL−1·h−1,李显刚等[21]采用PKO 无机磷培养基从百脉根(Lotus corniculatus)根际分离出的11 株溶磷菌的溶磷量在94.35~400.49 μg·mL−1。可能的原因是分离固氮菌所选用的培养基及分离PGPR 的植物种类不同。含ACC 脱氨酶的PGPR 菌株可以将逆境条件下植物体内产生的过量乙烯转化为氨和α-酮丁酸,降低或避免了过量乙烯对植物生长的抑制作用,并在一定程度上为植物生长提供氮而促进植物生长发育[5]。Penrose 等[14]研究发现,只有当菌株的ACC 脱氨酶活性≥20 nmol α-KA·mg−1Pr·h−1时,才可以在以ACC 为唯一氮源的培养基上生长并作为一类PGPR。本研究筛选出的60 株PGPR 菌株的ACC 脱氨酶活性均大于20 nmol α-KA·mg−1Pr·h−1,酶活性范围为0.04~64.31 μmol α-KA·mg−1Pr·h−1。秦宝军等[22]从小麦(Triticum aestivum)根际分离出的9 株具有ACC 脱氨酶活性的菌株,酶活性最大为9.32 μmol α-KA·mg−1Pr·h−1。Bal 等[23]从水稻(Oryza sativa)根际筛选出的17 株ACC 脱氨酶活性的PGPR 菌株酶活性最大的仅为2.66 μmol α-KA·mg−1Pr·h−1。对比发现,本研究从羊草根际筛选出的具有ACC 脱氨酶活性的PGPR 菌株的酶活性相对较高,该结果说明,相较于固氮菌和溶磷菌,羊草根际含ACC 脱氨酶的PGPR 菌种资源的挖掘及促生特性的研究是值得研究的重点。
PGPR 的分离与筛选是许多微生物学者研究的热点,在该过程中,微生物的鉴定也是必不可少的一步,但目前仅有少部分的种类得到鉴定,如类芽孢杆菌属(Paenibacillus)、伯克霍尔德式菌属(Burkholderia)、产检杆菌属(Advenella)、肠杆菌属(Enterobacter)、泛菌属(Pantoea)、假单胞菌属(Pseudomonas)等[24]。本研究通过16S rRNA 对筛选出的11 株PGPR 菌株进行分子鉴定发现菌株LNR24、XMH1 和XPR1 是同一菌株(Xanthomonas translucens,AB680445),为黄单胞菌属(Xanthomonassp.),该菌株同时具有固氮、溶解无机磷、溶解有机磷和分泌IAA 的特性。试管促生试验结果表明,该菌株显著降低了羊草株高和地上生物量,但促进了地下生物量的增加。程美霞等[25]发现1 株分离自水稻的黄单胞菌属(Xanthomonassp.)在水稻幼根稳定吸附、定植中发挥促生作用,本研究结果与此一致。但Gardiner 等[26]研究发现Xanthomonas translucens会导致小麦患细菌性条纹病。该结果说明菌株的促生特性会因植物种类的不同而不同。本研究筛选出两株能够同时促进羊草株高、地上和地下生物量增加的菌株(HPS14 和XPR2),这两株菌可能通过溶解无机磷及分泌IAA 而促进羊草生长,经16S rRNA 基因序列比对鉴定分别属于叶杆菌属(Phyllobacterium loti)和Inquilinus ginsengisoli。Liu 等[27]通过对受重金属污染的紫花苜蓿(Medicago sativa)接种Phyllobacteriumsp.发现,与未接菌相比,接菌的紫花苜蓿的生物量显著增加了15.9%~20.2%,同时土壤微生物活性和微生物群落对土壤碳的利用能力也显著提高,本研究结果与此一致。这说明本研究筛选出的这两株菌可以作为优良的PGPR 接种剂加以应用。
4 结论
通过选择性培养基,本研究从黑龙江兰西、内蒙古锡林浩特和呼伦贝尔3 个地区共筛选出20 株具有固氮酶活性的固氮菌株,固氮酶活性范围为8.71~11.63 nmol C2H4·mL−1·h−1。筛选出26 株D/d 值大于1.5 的溶解无机磷的PGPR,通过钼蓝比色法测定其溶磷量为7.08~82.71 μg·mL−1。筛选出36 株D/d 大于1.5 的溶解有机磷PGPR,钼蓝比色法测定其溶磷量为1.56~32.48 μg·mL−1。筛选出60 株菌具有ACC 脱氨酶活性的PGPR 菌株,酶活性为0.04~64.31 μmol α-KA·mg−1Pr·h−1。通过试管接种试验,本研究共筛选出两株(HPS14 和XPR2)可以促进羊草株高、地上和地下生物量增加的菌株,经16S rRNA 鉴定,这两株菌分别属于Inquilinus ginsengisoli和Phyllobacterium loti,可以用于后续PGPR 微生物肥料的研制和相关研究。

