染色体微阵列联合核型分析技术在超声软指标异常胎儿中的应用价值*
刘建生
泰安市妇幼保健院,山东 泰安 271000
针对超声异常胎儿,染色体核型分析可发现染色体数目和结构异常,可检出9%~19%的异常[1]。在器官畸形及生长发育不良胎儿中,10%~16%包含染色体拷贝数变异(copy number variations,CNVs)[2],这些变异可通过染色体微阵列分析(chromosomal microarray analysis,CMA)诊断。随着超声技术的不断进步,超声检查中可发现胎儿结构异常以及有可能提示胎儿异常的“软指标”,比如胎儿NT(nuchal translucency,NT)增厚、鼻骨缺失、侧脑室增宽、脉络丛囊肿、单脐动脉、股骨短等。这些软指标在染色体正常胎儿中可能是一种变异,也可能随着胎儿的发育而发生明显的结构异常,而在染色体异常胎儿中超声软指标异常的发生率会增加。目前多数产前诊断机构仍单纯用染色体核型分析技术进行产前诊断,没有从分子水平诊断。CMA技术作为一种分子诊断技术已成为产前诊断的一线技术[3],与传统的核型分析相比,在超声异常胎儿中CMA可提高8%~16%的异常检出率[1],以此诊断染色体拷贝数变异导致的染色体微缺失、微重复及杂合性缺失等。本研究通过染色体核型与CMA技术联合分析,对染色体数目、结构及微缺失、微重复及杂合性缺失多方面诊断,相互补充,提高胎儿遗传学检出率,避免缺陷儿出生,并为遗传咨询提供指导。
1 对象与方法
1.1 对象
2018年1月-2020年4月在本院超声检查提示胎儿软指标异常而就诊的孕妇90例,均为单胎,孕妇年龄为20~43岁,平均31.5岁,孕周18+4~27周,平均 23周,患者均接受遗传咨询知情同意。
1.2 方法
1.2.1样本采集 征得所有超声软指标异常孕妇知情同意,收集的数据包括孕妇年龄、孕周、超声异常指标分类信息等。本文胎儿超声软指标包括NT、NF(nuchal fold )增厚、鼻骨缺失或小、侧脑室增宽、脉络丛囊肿、单脐动脉、股骨短。对90例超声软指标异常胎儿于孕18~24周时抽取羊水30 mL,分别进行羊水细胞培养染色体核型分析及染色体微阵列检测。
1.2.2样本检测 核型分析历经细胞培养、染色体收获、显带及染色后进行分析。CMA又称基因芯片,用于全基因组的检测,包含75万个基因探针,可检测CNVs和杂合性缺失。经提取羊水细胞全基因组DNA,并经DNA消化、连接、PCR、纯化、洗涤和芯片扫描,获取数据加载于ChAs v3.0软件进行结果判读。
1.2.3结果判读 核型分析根据人类染色体命名国际规则(An International System for Hunman Cytogenetic Nomenclature, ISCN) (2016版)报告结果。CMA芯片检测对结果大于200 kb缺失及大于500 kb的重复片段进行分析报告。结果分为CNVs和未见异常两类。其中CNVs又分为致病性 CNVs、非明确临床意义型 (variant of uncertain significance, VOUS)及良性 CNVs 三种类型。CNVs分析经DECIPHEROMIMDGVISCANCBI pubMed等数据库为参照,获得样品基因组DNA可能治病的变异信息,发放诊断报告, 对纳入病例进行电话随访其妊娠结局。分析两种方法结合的胎儿遗传学检出率及在超声软指标异常的分布。
1.3 统计学分析
采用SPSS 17.0软件进行数据处理,样品间率的比较采用χ2检验,检验水准α=0.05。
2 结 果
2.1超声诊断胎儿软指标异常90例,其中单纯软指标异常73例:NT/NF增厚40例,双侧脉络丛囊肿6例,鼻骨缺失或小12例,单脐动脉5例,室间隔缺损7例,脑室扩张3例;两种以上软指标异常17例。检出CNVs 32例,检出率为35.6%(32/90),其中良性12.5%(4/32),VOUS 56.2%(18/32),致病性CNV 31.2%(10/32),引产10例。单纯软指标异常主要以NT增厚为主,占44.4%(40/90),CNV检出率30.0%(12/40),包括致病性CNVs 4例,占5.5%(4/73),其中室间隔缺失检出1例致病性CNVs。两种以上软指标异常病例17例中检出CNVs 10例(58.8%),包括致病性CNVs 6例,占35.3%,与单纯软指标异常致病性检出率比较,差异有统计学意(χ2=9.550,P=0.003)。详见表1。
2.2检出异常病例包括唐氏综合征5例,爱德华氏综合征1例,特纳综合征1例,染色体大片段缺失1例,均与核型分析结果一致。另有CMA检测未见异常、核型分析结构异常2例,较单独CMA检测提高了2.2%(2/12)的遗传学检出率,占病例的16.7%(2/12)。染色体核型分析未见异常,CMA检出异常2例,较单独核型分析提高了2.2%(2/12)的遗传学检出率,占致病性病例的20%(2/10),避免了2例缺陷儿的出生。VOUS父母验证4例,其中3例由父母一方遗传而来,1 例未遗传自父母,均继续妊娠,经随访未见异常。详见表2。
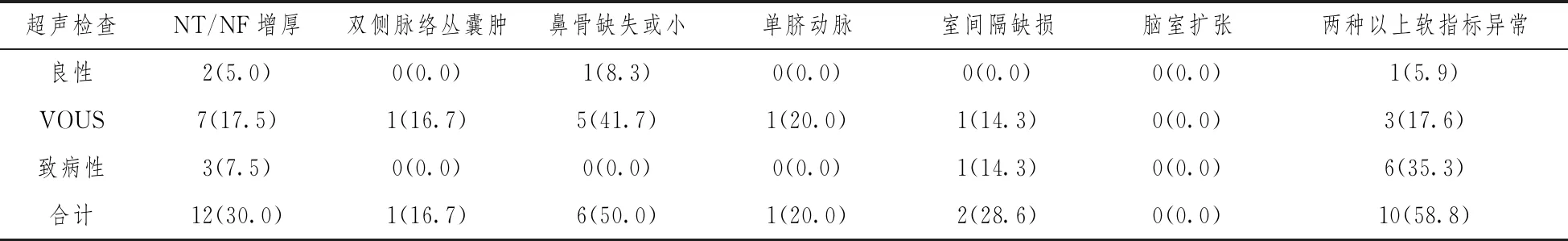
表1 胎儿超声诊断异常CNVs检出率分布表(例,%)

表2 染色体核型及CMA检测致病性病例统计表
3 讨 论
染色体核型分析技术是目前传统的产前诊断方法,CMA芯片技术是近年来最有效的分子诊断技术,可以增加产前诊断的检出率,既可检测基因组拷贝数异常,又可检测杂合性缺失,对超声提示胎儿结构异常者额外检出率可达6%~9%[4]。CNVs即染色体片段的重复或缺失,拷贝数存在差异且碱基数目>1 kb,是十分普遍的染色体变异,且很多变异都与疾病直接相关[5]。对于超声提示异常的胎儿首选CMA进行产前诊断,以排除染色体异常和50Kb以上的微缺失、微重复综合征[6]。本研究对超声软指标异常患者进行遗传学诊断,检出异常病例12例,两项检查技术有8例结果相同,染色体数目异常占染色体畸变的58.33%(7/12)。CMA共发现拷贝数异常10例,其中特纳综合征1例,21三体综合征5例,18三体1例,21号染色体缺失1例,均与核型结果一致。另有CMA检测未见异常,核型分析结构异常2例,较单独CMA检测提高了2.2%(2/12)的遗传学检出率,占病例的16.7%(2/12),对2例患者进行优生遗传咨询指导,再生育要进行产前诊断,防治缺陷儿出生。染色体核型分析未见异常,CMA检出异常2例,较单独核型分析提高了2.2%(2/12)的遗传学检出率,占致病性病例的20%(2/10),2例终止妊娠,避免了2例缺陷儿的出生。有报道称超声存在异常软指标,而核型正常的胎儿中致病性CNVs的发生率为3%~9%[7],及报道的4.8%[8],本研究软指标异常核型分析正常80例中,CMA检出CNVs病例2例,占2.5%,略低于文献报道,可能与病例数量少有关。本文胎儿超声软指标异常的遗传学检出率主要为NT/NF增厚居多,随着NT厚度增加,胎儿染色体异常几率增加[9-11],目前NT检查在染色体非整倍体的筛查作用也得到了肯定[12-13]。Maya等[14]建议,在NT超过3 mm时就应进行CMA检查。单脐动脉、室间隔缺损、脑室扩张、膈疝及脉络丛囊肿等均有病例检出,因此超声软指标异常在很大程度上要引起重视,进一步完善遗传咨询并进行产前诊断很必要。
本研究发现22q11.21×1(3.16M)1例,该片段覆盖22q11 deletion syndrome (Velocardiofacial/DiGeorge syndrome)综合征区域,包含TBX1、USP18、DGCR6等44个OMIM基因,该片段缺失可导致生长发育迟缓、心脏发育异常、胸腺发育异常、面部发育异常等临床表现。21q22.11q22.3×1(13.04M) 1例,该区域包含102个OMIM基因(RUNX1、DYRK1A等),缺失可导致隐性脊柱裂、小头畸形、面部异常、小颌畸形、尿道下裂、智力障碍等不同临床表现。17q12×3(1.42M)1例,包含ACACA、HNF1B等14个OMIM基因,该重复片段可导致胎儿智力发育迟缓、小头畸形、心脏畸形等临床表现。以上3例胎儿超声检查均有不同程度的发育异常,均选择引产。2例染色体结构异常,为染色体病携带者,无拷贝数异常,CMA检测未见异常,经遗传咨询,均继续妊娠,妊娠随访婴幼儿均未见异常。
随着芯片技术的分辨率逐渐增加, VOUS也逐渐增加,本研究中 18例 CNVs胎儿为临床意义不明确型,其中有4例进行了父母CMA验证, 3例均遗传自父母一方,1 例为突变导致,经随访有2例分娩,2例患者继续妊娠,随访均未见明显异常。在很多情况下,即使对胎儿父母进行了 CMA比对,仍然无法对其临床性质进行确切的判读。 CNVs的临床性质还与外显率、表现度和环境等多种因素有关,即使相同的 CNVs结果在不同的个体也会出现不同的临床表型[15]。目前还没有相关诊断方法能彻底解决此难点,只能通过父母验证与遗传咨询,因此, VOUS的发现可能会给孕妇及其家庭带来焦虑,甚至造成不必要的引产。在产前诊断工作中,选择适宜的产前诊断技术是前提,专业的产前咨询是重中之重。
综上所述,染色体核型分析与CMA检测相结合,可同时检测染色体数目、结构异常及CNVs变异,提高遗传学检出率。超声软指标异常胎儿不能轻视,尤其是两种以上软指标异常胎儿,发病率明显升高,应进一步产前遗传学咨询与诊断。

