杉木林土壤和苗木内生溶磷细菌的筛选及其溶磷特性*
韦宜慧 陈嘉琪 赵光宇 董玉红 厚凌宇 焦如珍
(中国林业科学研究院林业研究所 林木遗传育种国家重点实验室国家林业和草原局林木培育重点实验室 北京 100091)
磷在植物能量传递和储存、光合作用、细胞分裂及物质运转等生理过程中发挥重要作用。磷具有促进根的发育、植物的快速生长、提高水分利用效率和抗逆性的能力(周德贵等, 2018; Bononietal., 2020)。如果植物缺磷,会造成生长缓慢,且根系生长会受到抑制。研究发现,土壤中存在大量具有溶磷能力的细菌,这些细菌能将土壤中的难溶性磷酸盐转化为植物可吸收利用的水溶性磷,从而提高土壤磷可利用率,促进植物的生长(张艺灿等, 2020)。由于溶磷微生物具有节能、环保、来源广泛等特点,已经成为当前研究热点(陈玲等, 2018; Chawngthuetal., 2020)。溶磷菌在农作物上的应用研究已有许多报道,如水稻(Oryzasativa)、小麦(Triticumaestivum)、玉米(Zeamays)等,但关于林木方面的研究较少。
杉木(Cunninghamialanceolata)是我国南方用材林主要造林树种,造林面积列居全国首位,在我国林业生产中占有极其重要地位,但长期集约化生产造成杉木林生产力下降,人们通过施用化肥来提高产量(盛炜彤等, 2003; 于宁楼等, 2003),但肥效时间短,利用率低。南方地区淋溶强烈,土壤富含铝离子和铁离子,磷极易被固定,土壤磷利用率极低,磷肥的投入量是植物实际吸收能力的2倍,导致磷养分供给不足,严重制约了杉木人工林可持续发展(李杰等, 2011; Pantigoso, 2019),因此有效磷缺乏是限制杉木生产力的主要因素之一(于姣妲等, 2018)。溶磷菌作为新型生物肥料,具有巨大的促生潜力,既可以提高植物对磷的吸收,减少对化肥的依赖,又可以提高土壤肥力,优化磷资源的使用,与化肥相比更环保(Kudoyarovaetal., 2017; Kuntyastutietal., 2017; 刘春菊等, 2020)。因此,筛选高效溶磷菌对提高土壤磷利用率,促进杉木生长具有重要意义。
筛选高效溶磷菌是溶磷菌广泛应用于实践生产的基础和前提。为获得适应性强且稳定的菌株,需要对溶磷菌进行培养条件优化,而培养环境因子和培养基成分是不得不考虑的问题。影响溶磷菌溶解磷酸盐的因素繁多,如何筛选出适应力强的高效溶磷菌显得尤为重要。了解溶磷菌的溶磷特性可为制备高效溶磷菌打下良好的基础,有利于将其更好地应用于生产实践。本研究以杉木林地土壤及杉木植物为材料,拟分离筛选出具有高效溶磷能力的菌株,并筛选出最佳溶磷条件,探究其生态适应性和溶磷特性,以期获得更高效稳定的溶磷菌株,为微生物肥料研制提供理论依据,减少化肥使用,缓解杉木人工林地力衰退,提高杉木人工林生产力。
1 材料与方法
1.1 试验材料
土壤样品采自江西省分宜县大岗山山下林场(27°36′N, 114°24′E),地貌属低山丘陵,海拔220~300 m。年均气温17.2 ℃,年均降水量1 600 mm,属亚热带季风气候,土壤类型为红壤。杉木人工林林龄为18年生,林分密度3 067株·hm-2,林下植物优势种为狗脊(Cibotiumbarometz)、大青(Clerodendrumcyrtophyllum)、三花悬钩子(Rubustrianthus)、杜茎山(Maesajaponica)。在杉木人工林内布设样方(20 m×30 m),在样方内取土, 2018年9月采样,采样深度0~20 cm。通过S形采样法在样地内布设7个采样点,除去枯枝落叶层后用土钻钻取0~20 cm土壤,将7个采样点土壤混合置于无菌袋中,冰袋保存带回实验室。分离筛选杉木内生菌所用植物样品为中国林业科学研究院亚热带林业实验中心提供的长势良好的2年生杉木实生苗。
PVK固体培养基: 葡萄糖10 g,Ca3(PO4) 25 g,CaCO35 g,(NH4)2SO40.5 g,NaCl 0.2 g,MgSO4·7H2O 0.1 g,KCl 0.1 g,MnSO40.002 g,FeSO4·7H2O 0.002 g,琼脂18 g,蒸馏水1 000 mL,pH7.0。
PVK液体培养基: 即PVK固体培养基不加琼脂。
1.2 溶磷菌初筛
称取土样10 g于装有90 mL无菌水的三角瓶中,28 ℃摇床振荡30 min。将土壤悬浮液连续稀释10-2、10-3、10-4,取0.1 mL稀释度为10-3、10-4土壤悬浮液涂布于PVK琼脂平板上,28 ℃培养5~7天。观察平板是否长出产生溶磷圈的菌落。挑取溶磷圈较大的菌落,用连续划线法进一步分离纯化。
将整株杉木根、茎、叶分离,置于流水下冲洗24 h,除去表面泥土及杂质,滤纸吸干水分后,用剪刀截成2 cm长的小段,分别称取根、茎、叶各1 g置于已灭菌的培养皿中。在超净台上进行表面消毒: 在体积分数75%酒精中浸泡30 s后置于6%次氯酸钠溶液浸泡5 min,无菌水冲洗7次,将已消毒的植物组织材料放置在无菌研钵中,加入少量无菌水研磨成匀浆,取0.1 mL涂布于PVK平板上,最后一次清洗的无菌水作为对照,设3个重复,28 ℃培养5~7天,观察平板是否存在产生溶磷圈的菌落。挑取溶磷圈明显的菌落进行纯化并观察记录菌落特征。
1.3 溶磷菌复筛
将菌株接种到PVK液体培养基中,28 ℃往复摇床180 r·min-1培养7天,然后测定培养基pH值。培养液8 000 r·min-1离心15 min,以去除细菌菌体。取上清液用分光光度计,在420 nm波长下,用钼锑钪比色法(张祥胜, 2008)测定培养液中可溶性磷含量。
1.4 溶磷菌生理生化试验
溶磷菌常规生理生化鉴定按照《常见细菌系统鉴定手册》中的方法进行,主要包括革兰氏染色、葡萄糖水解试验、乳糖水解试验、甲基红试验、V-P试验、产硫化氢试验、明胶液化试验、柠檬酸盐利用试验、丙二酸盐利用试验、反硝化作用试验。
1.5 16S rDNA基因序列测定
用北京博迈德生物科技有限公司的细菌基因组DNA提取试剂盒提取菌株DNA,以DNA为模板,用细菌通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR扩增,扩增体系如下: DNA模板1 mL,引物27F 0.5 mL,1492R 0.5 mL,2×TaqMix 12.5 mL,ddH2O 10.5 mL。PCR程序如下: 93 ℃ 3 min,93 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min,32个循环; 72 ℃ 7 min。扩增产物由华大基因进行双向测序。将测得的16S rDNA序列用ContigExpress软件拼接好后,分别在GenBank、EzTaxon、BIGSdb数据库中搜索,选取同源性较高的模式菌株,通过MEGA7.0软件,采用Neighbor-Joining法构建系统发育树,置信度通过重抽样法(Bootstrap=1 000)计算获得。
1.6 溶磷特性研究
采用单因素试验,测定不同pH、温度、碳源、氮源及磷源培养条件下溶磷菌的溶磷能力。以PVK液体培养基为基础,pH分别设置为4、5、6、7、8、9、10; 培养温度设置为10、15、20、25、30、35、40 ℃。分别以0.5、5.0、10.0 g·L-1的浓度提供不同碳源(葡萄糖、蔗糖、乳糖、麦芽糖、甘露醇、可溶性淀粉)、氮源(硫酸铵、硝酸钾、氯化铵、尿素、蛋白胨、酵母浸粉)、磷源(磷酸钙、磷酸铁、磷酸铝)。按体积分数2%接种量将OD600=0.5的菌液接种于PVK培养液中(3个重复)。28 ℃摇床培养7天,以未接种PVK液体培养基为对照,用钼锑钪比色法测定培养液中可溶性磷含量。
1.7 数据处理
运用Excel软件进行数据记录,SPSS24.0软件对溶磷能力进行方差分析(ANOVA),在MEGA7.0中采用NJ法构建系统发育树,Bootstrap值为1 000。
2 结果与分析
2.1 溶磷菌菌落特征
从杉木林地土壤及杉木苗木植株共分离纯化得到20株溶磷菌,有13株溶磷菌分离自杉木林地土壤,5株来自杉木植株根系,1株分离自杉木植株茎部,另1株来自叶片(表1)。细菌菌落形态特征指标一般包括形状、颜色、表面状态、光泽等。对所分离的20株溶磷菌的形态特征进行了观察记录(图1)。大部分菌株菌落成白色或淡黄色、圆形、表面湿润,少数菌落透明。

表1 溶磷菌在PVK培养基上的菌落特征①Tab.1 Colony characteristics of phosphate solubilizing bacteria on PVK medium
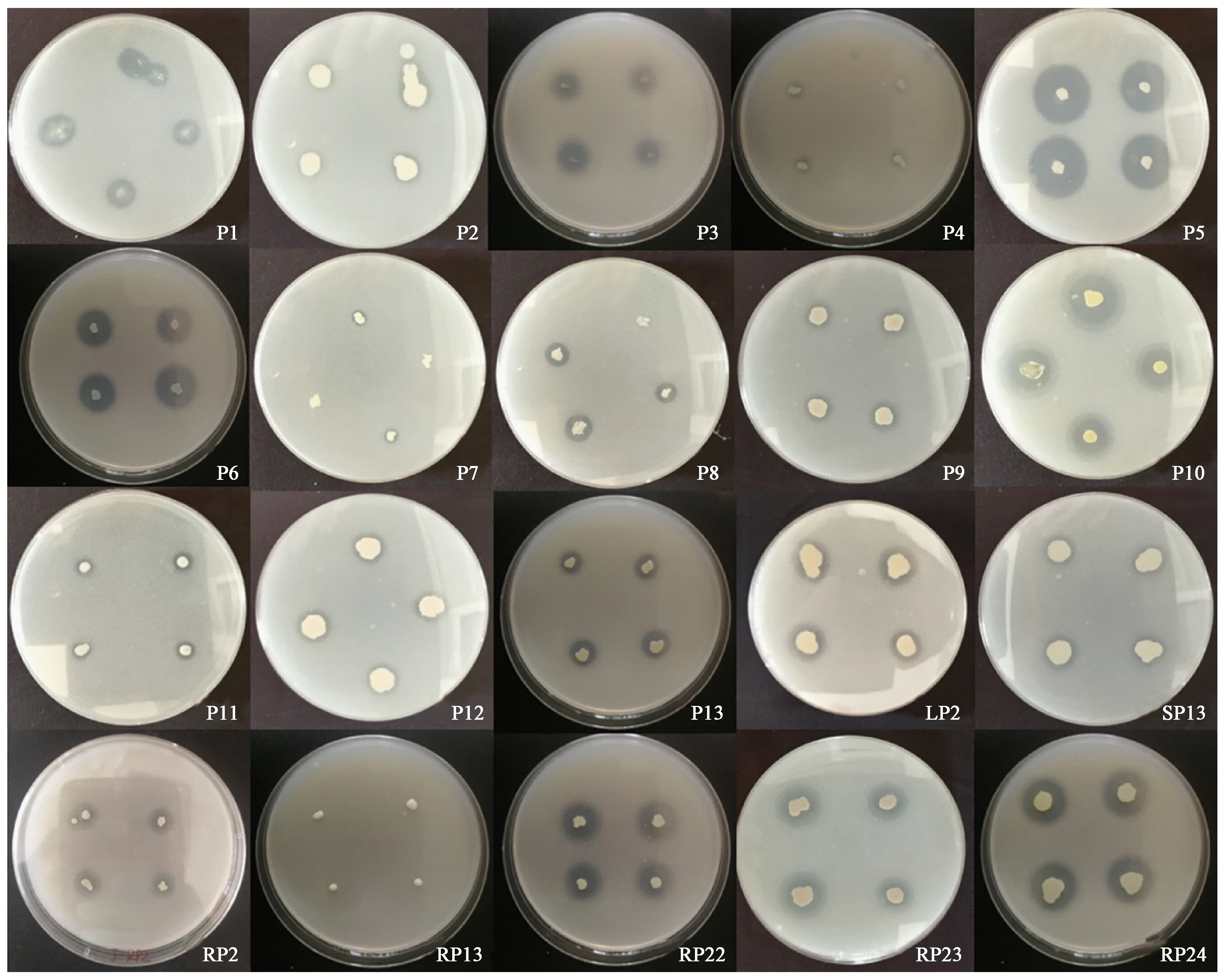
图1 分离菌株特征Fig.1 Characteristics of isolated strains
2.2 溶磷菌溶磷能力
将菌株接种于以磷酸钙为唯一磷源的PVK液体培养基中,测定培养液中可溶性磷含量,发现各菌株溶磷能力存在显著差异(表2)。从表2可以看出, 20株菌株的可溶性磷含量在21.21~195.61 mg·L-1之间,其中菌株P5具有最强的溶解磷酸钙的能力,且显著高于其他菌株; 其次是RP2、RP22和RP23。

表2 分离菌株溶磷能力Tab.2 Determination of phosphate solubilizing ability (mg·L-1)
2.3 溶磷菌生理生化特征
对筛选出的溶磷菌进行生理生化鉴定,除P7外,筛选菌株均为革兰氏阴性菌,葡萄糖水解试验均为阳性,乳糖水解仅RP23、RP24为阴性,硫化氢试验仅RP23为阳性,柠檬酸盐试验为阴性的是P2、RP23,其他菌株均为阳性。丙二酸盐试验仅有RP22为阳性。其中LP2、RP2和RP22生理生化特征相似,均可利用葡萄糖、乳糖,甲基红试验阴性,V-P试验阳性(表3)。
2.4 16S rDNA基因序列比对分析
对20株菌株的16S rDNA基因进行扩增,获得了约1 350 bp的16S rDNA基因的核苷酸序列。在GenBank、EzTaxon、BIGSdb数据库进行BLAST(表4)。16S rDNA序列比对结果显示, 20株促生菌分别属于8个属,其中P7与Bacillusaryabhattai(B8W22)、RP22与Pseudomonasgrimontii(CFML97-514)相似性为100%,而P2的比对结果相似性相对较小(96.52%)。溶磷菌溶磷能力最强的菌株P5为伯克氏菌属(Burkholderia),其次是RP2、RP22,二者均为假单胞菌属(Pseudomonas)。用ClustalW对20株溶磷菌及其相似菌株进行多序列比对,并利用MEGA7.0软件,采用邻接法(Neighbor-joining)构建溶磷菌的系统发育树(图2)确定了各菌株的种类。图中发育树仅显示自展值大于70的数值。
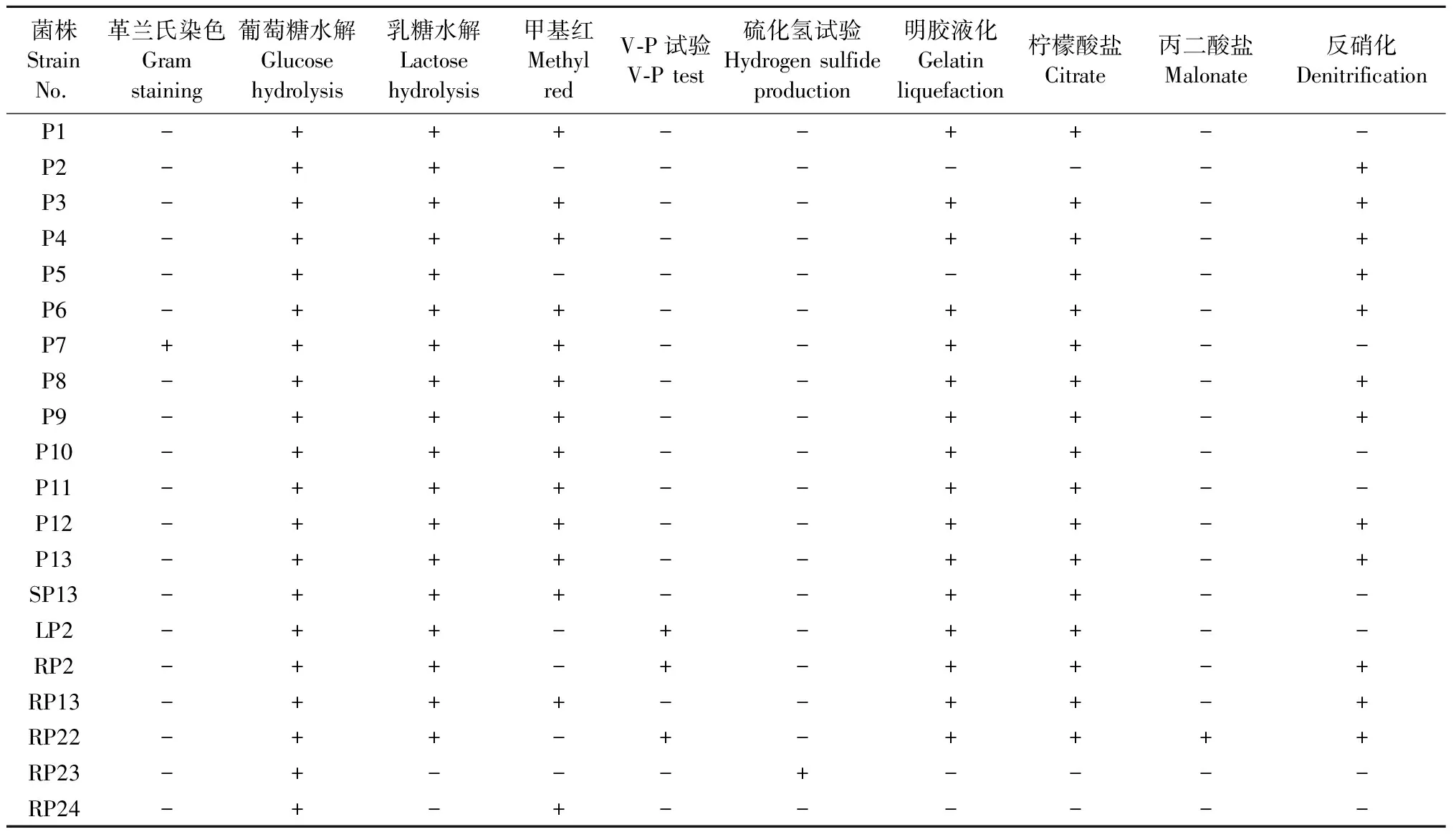
表3 溶磷菌生理生化特征①Tab.3 Physiological and biochemical features of phosphate solubilizing bacteria

表4 基于16S rDNA序列鉴定结果Tab.4 Identification based on 16S rDNA sequence

图2 基于16S rDNA序列构建的系统发育树Fig.2 Phylogenetic evolutionary tree based on 16S rDNA sequences
2.5 影响溶磷菌溶磷特性的环境条件
2.5.1 pH对溶磷菌溶磷能力的影响 由图3可知,pH在4~7时,RP2和RP22溶磷能力随着pH的升高而增加,而P5则呈现先上升后下降的趋势。pH在8~10时,各菌株的溶磷能力随着pH的升高而降低。P5菌株在各pH条件下其溶磷能力均高于RP2和RP22,具有较广的pH适应范围,在pH为5时,培养液中可溶性磷含量最高,pH为4时仍具有较高的溶磷能力,说明P5耐酸。RP2和RP22在pH为7时溶磷能力达到最高。总的来看,pH为5~7时,各菌株均表现出最高的溶磷能力。
2.5.2 温度对溶磷菌溶磷能力的影响 不同温度对溶磷菌溶磷能力的影响如图4所示,在25~35 ℃时3株菌株均表现出较高的溶磷能力,P5和RP2的最适温度为30 ℃,RP22的最适温度为25 ℃。此外,P5对温度的适应性较强,在各温度条件下溶磷能力均显著高于RP2和RP22,且在40 ℃高温条件下仍具有较高的溶磷能力。在30~40 ℃,各菌株随着温度的升高,溶磷能力逐渐降低。

图3 pH对溶磷菌溶磷能力的影响Fig.3 Effect of pH on the ability of phosphate solubilizing bacteria同一小写字母表示同一菌株的差异不显著,P=0.05。下同。The same lowercase letter means that the same strain is not significantly different at P=0.05,the same below.

图4 温度对溶磷菌溶磷能力的影响Fig.4 Effect of temperature on the ability of phosphate solubilizing bacteria
2.5.3 碳源对溶磷菌溶磷能力的影响 不同碳源对溶磷菌的溶磷能力有显著影响(图5)。P5以蔗糖为碳源时溶磷能力最高,为203.43 mg·L-1,葡萄糖次之,以乳糖和甘露醇为碳源时溶磷能力最低。RP2在以葡萄糖为碳源时溶磷能力最高,其次是蔗糖和麦芽糖,碳源为乳糖和甘露醇时溶磷能力最低。RP22的最佳碳源是葡萄糖,其次是蔗糖和麦芽糖。总体来看,不同碳源条件下P5的溶磷能力优于RP2和RP22。
2.5.4 氮源对溶磷菌溶磷能力的影响 由图6可知,6种不同氮源对菌株溶磷能力的影响差异显著。P5以氯化铵为氮源时溶磷能力最高,为208.83 mg·L-1,硫酸铵和尿素次之,以蛋白胨为氮源时溶磷能力最低。RP2在以硝酸钾为氮源时溶磷能力最高,其次是硫酸铵和氯化铵,氮源为酵母浸粉和蛋白胨时溶磷能力最低。RP22的最佳氮源为硝酸钾,硫酸铵和氯化铵次之。从不同菌株来看,在以硫酸铵、氯化铵、尿素以及蛋白胨为唯一氮源时,菌株溶磷能力的大小排序为P5>RP2>RP22。总体来看,不同碳源条件下P5的溶磷能力优于RP2和RP22。

图5 不同碳源对溶磷菌溶磷能力的影响Fig.5 Phosphate solubilizing ability of phosphate solubilizing bacteria at different carbon source
2.5.5 磷源对溶磷菌溶磷能力的影响 3种不同磷源条件下,P5、RP2和RP2溶磷能力如图7所示。P5菌株在不同磷源中溶磷能力优于RP2和RP22,其中以磷酸钙为磷源时可溶性磷含量最高,其次是磷酸铝。RP2和RP22对磷酸钙的溶解能力显著高于磷酸铁和磷酸铝。总的来看,3株菌对不同磷源的溶解能力大小排序为: 磷酸钙>磷酸铝>磷酸铁。
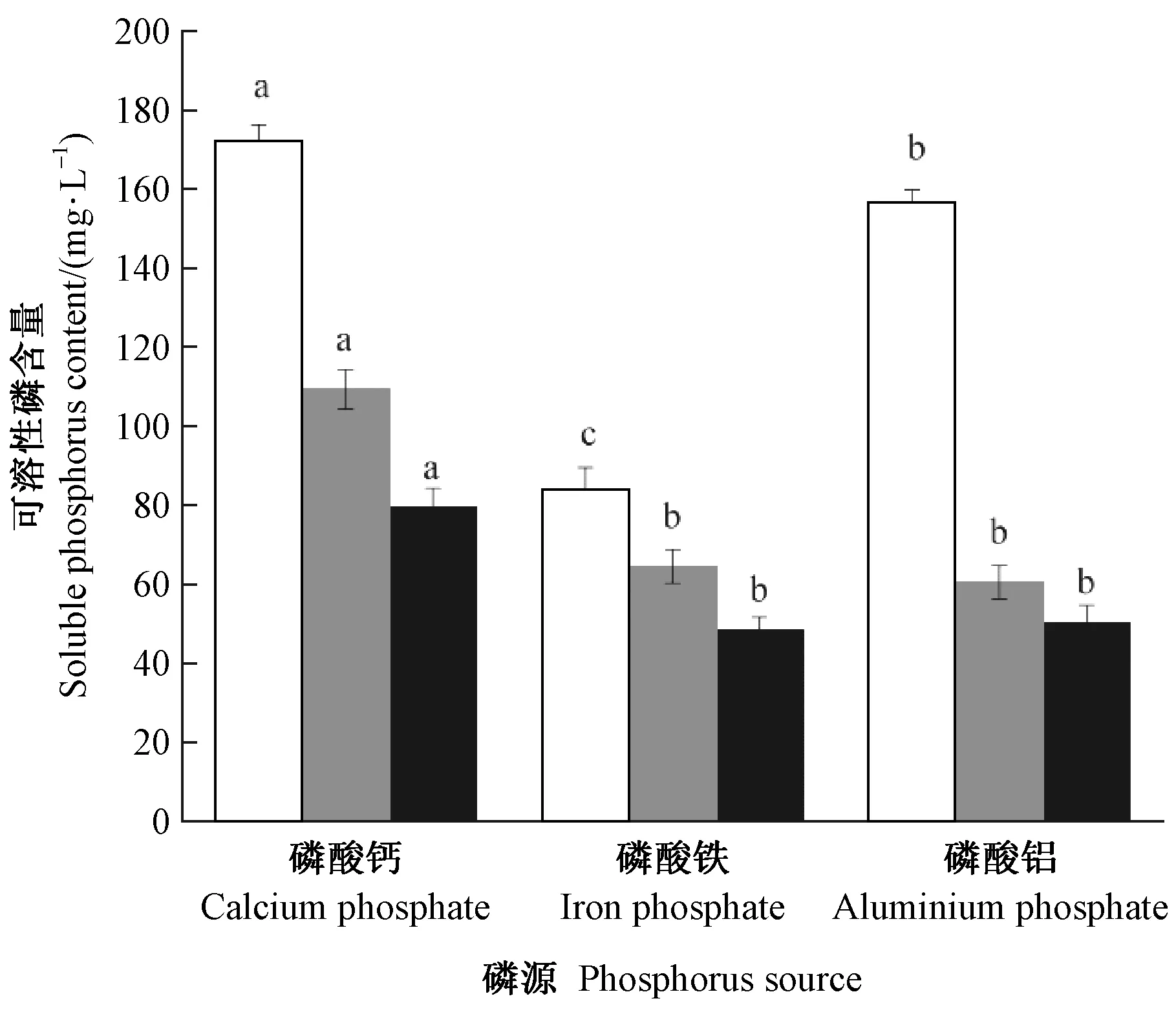
图7 不同磷源对溶磷菌溶磷能力的影响Fig.7 Phosphate solubilizing ability of phosphate solubilizing bacteria at different phosphate source
3 讨论
3.1 溶磷菌的筛选与鉴定
溶磷菌作为一种对环境友好的微生物肥料重要成分,可以通过溶解土壤中的难溶性磷酸盐,提高磷素可利用率,从而有利于促进植物的生长。杉木是我国南方主要用材树种,然而目前面临着生产力下降、土壤退化等问题,缺磷是杉木生长的主要限制因子。因此,从杉木林中筛选溶磷菌可以为杉木提供一种新的微生物肥料来源,对杉木生长具有重大意义。

通常采用生理生化鉴定和16S rDNA序列来鉴定细菌菌种。研究表明16S rDNA序列可为细菌鉴定提供有效的种的特异性特征序列,因此,16S rDNA序列测序鉴定细菌已经广泛应用。本文结合生理生化试验、16S rDNA序列比对及系统发育树,将菌株鉴定至属。目前已知的溶磷菌主要包括伯克氏菌属、芽孢杆菌属、假单胞菌属、欧文氏菌属、克雷伯氏菌属,其中假单胞菌属、伯克氏菌属和芽孢杆菌属的研究报道较多。本研究筛选出的高效溶磷菌为伯克氏菌属和假单胞菌属。序列比对分析和系统发育树表明有3株菌株与模式菌株的基因系列具有显著相似性(>97%)且自展值均大于90。通常相似性大于97%,发育树自展值大于70可认为该分类结果是可信的(Rajuetal., 2018)。
3.2 溶磷菌的溶磷特性
溶磷菌的溶磷能力随环境条件的变化而发生改变。本研究结果显示筛选出的3株溶磷菌生长最适pH范围为5~7,最适温度范围为25~35 ℃,与Batool等(2019)、杨艳红等(2015)研究结果一致,并且P5菌株在pH为4、温度为40 ℃时也具有较强的溶磷能力,说明该菌耐高温耐酸,能在恶劣环境条件下生存。P5菌株在以蔗糖为碳源时具有最高的溶磷能力,RP2和RP22则在葡萄糖为碳源时其溶磷能力最强,表明溶磷菌对碳源的利用以单糖和双糖为主,对多糖的利用率较低,这与乔志伟等(2013)研究结果相同。这可能与糖类的结构有关,单糖是碳水化合物中最基本的单位,微生物可以直接吸收,而多糖则需要分解为单糖后才能被微生物利用。本研究结果表明,P5菌株在以氯化铵为氮源时具有最高的溶磷能力,RP2和RP22则以硝酸钾为氮源时其溶磷能力最强,以硫酸铵次之,表明溶磷菌对氮源的利用以铵态氮和硝态氮为主,这与Park等(2010)研究结果一致。研究发现,不同氮源会引起溶磷菌分泌的有机酸的种类和数量发生变化,从而改变其溶磷能力(Bhabatarinietal., 2016)。与硝态氮相比,以铵态氮为唯一氮源时,溶磷菌分泌的有机酸数量显著增加(秦利均等, 2019)。许多研究报道溶磷菌对不同难溶磷酸盐的溶解能力按强弱排序依次为磷酸钙、磷酸铝、磷酸铁,本研究也得出一致的结果。Ca-P较易溶解可能与溶磷微生物分泌的有机酸种类有关,也可能是微生物分泌质子和有机酸螯合阳离子双重作用的结果,而Al-P只能通过螯合作用来释放磷酸盐(Pandaetal., 2016)。此外,一些溶磷菌还可以通过产生H2S将Fe-P转化为FeSO4,从而溶解磷酸铁,增加可溶性磷含量(Chakdaretal., 2018)
4 结论
从杉木林土壤及杉木苗木的根、茎、叶分离获得3株高效溶磷菌P5、RP2和RP22; 结合生理生化试验、16S rDNA序列比对和系统发育树,将菌株P5鉴定为Burkholderiaubonensis,RP2为Pseudomonasfrederiksbergensis,RP22为Pseudomonasgrimontii。对P5、RP2和RP22的溶磷培养条件进行单因素试验,各菌株在25~30 ℃,pH5~7时具有最强的溶磷能力,其中P5在pH4、温度40 ℃时仍具有较高的溶磷能力; 在碳源和氮源试验中,P5菌株溶磷条件的最佳碳源和氮源分别为蔗糖和氯化铵, RP2和RP22溶磷的最佳碳源和氮源分别为葡萄糖和硝酸钾; 磷源种类对溶磷菌溶磷能力有显著影响,3株溶磷菌对磷酸钙溶解度均大于磷酸铝和磷酸铁。

