中脑多巴胺奖赏系统与疼痛调控*
赵炜楠 胡苏皖 翟晓静 杨俊霞 丁海雷 张红星 曹君利,3
(1 江苏省麻醉学重点实验室,徐州221004;2 江苏省麻醉与镇痛应用技术重点实验室,徐州221004;3 徐州医科大学附属医院麻醉科,徐州221002)
生理状态下,急性疼痛是机体免受进一步环境伤害的保护性反应,而组织损伤、炎症等引起的疼痛则是一种病理状态。几乎每个人都有过急性疼痛的经历,全球约有20%的人口罹患慢性疼痛,长期的疼痛伴随着焦虑、失眠、抑郁等情感方面的症状,极大地摧残着病人的身心[1]。疼痛及其相关的医疗与社会现象(如阿片危机),已经成为一个全球性公共卫生问题。国际疼痛学会 (International Association for the Study of Pain, IASP) 最初为疼痛所下的定义是“组织损伤或潜在组织损伤所引起的不愉快感觉和情感体验”。近几十年来,随着研究的不断深入,人们认识到疼痛不仅是伤害性刺激的感觉和情感体验,还是多种信息在中枢相互作用整合的结果。为了更准确地阐明疼痛的本质,指导疼痛的基础研究与临床治疗,IASP 在2020 年更新了疼痛的定义:疼痛是一种与实际或潜在的组织损伤相关的不愉快的感觉和情绪情感体验,或与此相似的经历。并且对该定义做出了六项注释,这些注释在感觉和情感体验的基础上,从心理、认知和社会维度更全面地阐述了疼痛的属性。
虽然人们对疼痛本质的认识逐渐深入,但由于技术的限制,一直以来疼痛的机制研究主要集中在外周和低级中枢神经系统,如背根神经节和脊髓,而对脑机制的探索非常有限。然而,疼痛相关的情感体验、认知与社会维度的成分属于人类高级活动,这些活动或过程中信息的整合有着复杂的脑机制。临床影像学技术、特异性神经示踪技术和光遗传学、化学遗传学等特异性观察与干预手段的出现与发展,结合传统的分子生物学与药理学技术,使疼痛等脑相关疾病的神经生物学机制研究进入了一个新的时代。越来越多的临床和基础研究表明,疼痛与涉及情感和动机的神经结构功能异常密切相关,其中中脑多巴胺 (dopamine, DA) 奖赏系统是调控疼痛与镇痛的热点与关键脑结构。同时,疼痛也是一些与中脑多巴胺系统功能异常相关疾病(如帕金森病[2])的并发症状。例如,中脑DA 能神经元变性缺失,DA 水平下降可能与帕金森病疼痛症状的产生相关[3,4]。人为毁损中脑黑质DA 能神经元能模拟帕金森病的运动症状和非运动症状(如疼痛),而同时毁损腹侧被盖区(ventral tegmental area, VTA)尾部DA 能神经元则可以缓解疼痛等非运动症状,提示VTA DA 能神经元在帕金森病相关疼痛行为中发挥重要的调控作用[5]。本文将从分子与神经环路水平就中脑DA奖赏系统在疼痛调控中的作用进行系统综述,并对这一系统调控疼痛的未来研究方向进行展望。
一、中脑DA 奖赏系统
中脑DA 奖赏系统主要由VTA DA 能神经元及其下游靶区组成,VTA 是该系统中DA 的主要来源[6,7]。VTA 位于黑质和红核之间,是一个由多种类型神经元构成的核团,其中包含60%~65%的DA 能神经元、30%~35%的γ-氨基丁酸(γ-amino-butyric acid, GABA)能神经元和2%~3%的谷氨酸能神经元[8]。中脑DA 奖赏系统在感觉、情感、应激、动机和奖赏等相关生理和病理过程中发挥重要作用。越来越多的证据表明,VTA DA 能神经元及其相关神经环路在疼痛调制中扮演着重要的角色。中脑DA 能神经元活动异常是慢性疼痛及相关疾病的重要机制[3,4]。传统观念认为疼痛是一种负性行为,疼痛抑制VTA DA能神经元活性,减少DA 释放;疼痛缓解作为一种“奖赏”效应能够激活DA 奖赏系统,增加DA 释放。近年来,也有观点认为疼痛激活VTA DA 能神经元,而抑制VTA DA 能神经元缓解疼痛。这些证据提示VTA DA 能神经元具有复杂的解剖和功能异质性。因此,总结VTA DA 能神经元参与疼痛调控的分子、细胞与环路机制,对进一步认识中脑DA 奖赏系统在调控疼痛中的作用和指导未来基础与临床研究有重要意义。
二、中脑DA 能神经元调控疼痛的神经环路机制
脑内并没有一个专门的区域能够单独决定疼痛的体验过程,疼痛是多个脑区之间神经网络进行信息处理与整合的结果。核团间的投射所构成的神经环路是组成神经网络的基本单位,了解这些神经环路调控疼痛的机制是弄清神经网络如何处理疼痛信号的重要前提。
中脑DA 奖赏系统主要由VTA DA 能神经元及其下游靶区伏隔核 (nucleus accumbens, NAc) 组成。广义的中脑DA 奖赏系统还包括接受VTA DA 能投射的前额叶皮质 (prefrontal cortex, PFC)、杏仁核 (amygdala, Amy) 以及海马 (hippocampus, Hipp) 等脑区。同时,作为该系统的核心脑区,VTA 还接受来自NAc、下丘脑 (hypothalamus) 和外侧缰核 (lateral habenula, LHb) 等与疼痛、情感相关脑区的神经投射(见图1)。越来越多的证据提示中脑边缘DA奖赏系统功能失调是慢性疼痛及其相关情感、认知症状的重要病理机制。使用药理学方法激活VTA DA 能神经元在改善抑郁小鼠社交行为表现的同时也会降低动物的痛阈值。
1. VTA→NAc DA 能投射
NAc 是腹侧纹状体的主要组成部分,核团内有95%的神经元为主要表达DA 1 型 (D1) 和2 型(D2)受体的GABA 能中型多棘神经元 (medium spiny neurons, MSNs)。NAc 从解剖学上可以分为核 (core) 以及包绕核的壳 (shell)。
NAc 是VTA DA 能神经元的重要下游投射脑区,VTA→NAc DA 能投射也是中脑DA 奖赏环路的核心环路。一直以来,这一环路被认为是介导情感、动机相关生理病理过程的重要脑内结构,其内部的DA 和脑源性神经营养因子 (brain-derived neurotrophic factor, BDNF) 信号均参与了抑郁和成瘾行为的调控。2017 年,我们研究发现慢性神经病理性疼痛模型小鼠中,VTA 投射至NAc 的DA 能神经元放电增加,光遗传学抑制这一环路可以缓解动物疼痛行为[9]。但是也有研究发现坐骨神经结扎(sciatic nerve ligation, SNL)和癌痛模型小鼠的VTA DA 能神经元放电频率降低,运用光遗传学技术特异性激活VTA→NAc 的DA 能神经元,可以缓解SNL 和癌痛引起的痛行为[10]。这些结果起初使人困惑,但是结合近年来的研究发现,腹侧VTA 主要投射到NAc 内侧壳,而外侧VTA 则大多数投射到NAc外侧壳,且在小鼠遭受同样的足底电击刺激时,VTA内外侧的神经元出现截然相反的兴奋性变化[11,12]。另外,有研究显示啮齿类动物受到疼痛刺激时NAc 核内的DA 释放增加,而壳内的DA 则在刺激中保持稳定[13]。这些研究结果一方面说明了VTA 投射至NAc 的DA 能神经元在疼痛调控中的重要作用,另一方面也提示VTA→NAc DA 环路可能存在功能不同甚至相反的、核团亚区特异性平行投射。另外,VTA 头尾在细胞类型及功能上的差异也可能是上述研究中出现功能差异的一个重要原因。
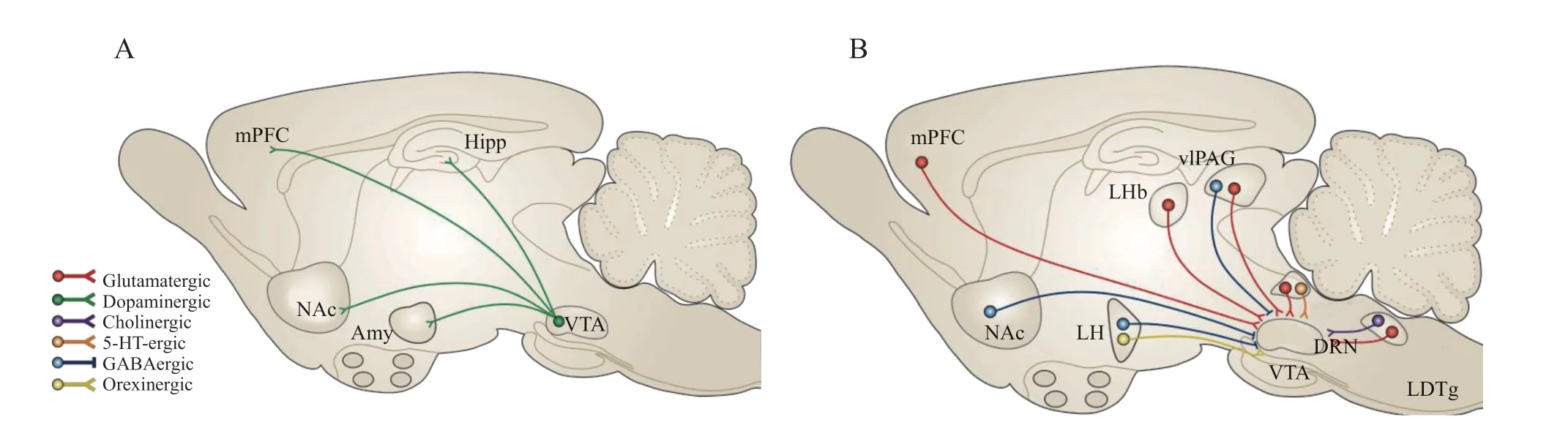
图1 参与疼痛调控的中脑奖赏环路
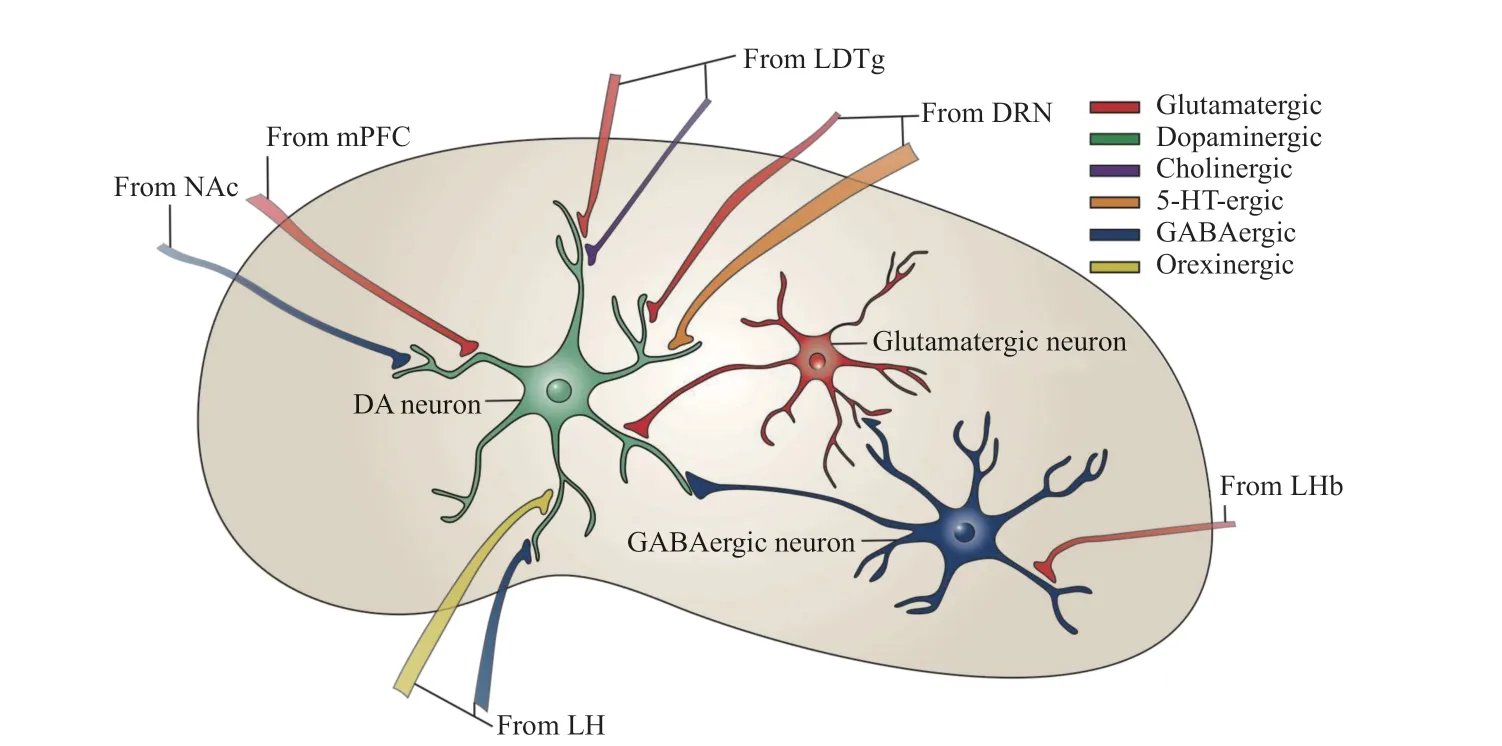
图2 VTA 疼痛相关外来投射与局部神经元之间突触联系示意图
如上所述,NAc 是与情感、动机相关行为密切相关的核团,还被证实是奖赏与厌恶行为调控的重要脑区。这些证据提示 VTA→NAc DA 能投射不仅在疼痛感觉调控中起到关键作用,同时也可能参与了疼痛相关的情感和动机行为改变。
2. VTA→mPFC DA 能投射
内侧前额叶皮质 (medial prefrontal cortex, mPFC) 是中脑边缘系统的重要组成部分,参与调控感觉、决策、判断、工作记忆等诸多高级脑功能。人为抑制mPFC 神经元活动不仅可以缓解选择性神经损伤 (spared nerve injury, SNI) 小鼠的疼痛感觉,同时也能减轻慢性疼痛所伴随的厌恶情绪[14],提示mPFC是调控疼痛感觉及其相关情绪症状的重要脑区。VTA 来源的DA 是mPFC 参与上述脑功能的重要神经递质,D1 受体在mPFC 细胞广泛表达,而D2 受体则主要表达在较深的第5 和6 层 (Layer 5, 6) 细胞,并且两种受体对DA 的结合特性并不相同[15],提示DA 在mPFC 调控动物行为中的作用可能非常复杂。目前的基础研究发现:急性电击能够激活包括mPFC 在内的多个脑区的DA 传递,而慢性疼痛时mPFC DA 则处于较低水平,且mPFC 中注射DA可以缓解慢性疼痛的症状[16,17],这些结果充分说明了mPFC 内的DA 参与了疼痛感觉的调控。此外,Sogabe 等的研究发现: VTA 高频电刺激(50 Hz, 30 s)能抑制机械压尾刺激诱发的大鼠前额叶皮质伤害性反应,并且明确了是PFC 内的D2 受体介导了这种抑制作用[18]。还有研究发现光遗传技术激活VTA投射至mPFC 的神经元末梢能强化条件性位置厌恶,诱发焦虑样行为[19]。上述结果提示VTA→mPFC DA 能投射不仅在疼痛感觉调控中发挥重要作用,同时也参与疼痛相关情感成分的调控。我们前期的研究进一步证实了此观点:在使用慢性不可预知温和应激 (chronic unpredictable mild stress, CMS)构建的抑郁症模型小鼠中,应用药理学方法(核团内注射吗啡或巴氯芬)激活VTA DA 能神经元在改善小鼠抑郁相关行为(如社交、悬尾、旷场与糖水偏好实验)的同时会诱发动物痛行为[20]。
综上所述,在疼痛状态下,VTA→mPFC 的DA 神经元功能失调,能够有效地改变mPFC 内神经元的活动,而这种改变可能会影响各类需要mPFC 参与的高级功能。因此,在VTA→mPFC 通路的痛觉调控功能之外,其在疼痛所伴随的认知、情感、记忆等并发症中的作用也应当引起研究者的注意。
3. VTA→Hipp DA 能投射
海马是脑内调控认知与情感的关键核团,海马除了自身内部复杂的神经网络之外,还接受大量的外来神经纤维输入,包括来自VTA 的DA 能投射。有研究发现激活背侧海马的D1 或D2 受体均可以产生镇痛效应[21],同时也有研究证实激活VTA 投射到背侧海马的DA 能神经元可以增强小鼠维持记忆的能力[22]。海马齿状回(dentate gyrus, DG)的成年海马神经发生 (adult hippocampal neurogenesis, AHN) 对于认知和情感的发生和维持尤为重要。在疼痛相关的研究中,急性的炎性疼痛并不会影响AHN[23],但无论在人类还是啮齿类动物,慢性疼痛均会降低AHN 水平,这种减少可能与慢性疼痛所导致的记忆功能损伤相关。我们最近的研究发现:在通过慢性坐骨神经压迫损伤 (chronic constrictive injury, CCI) 构建的慢性神经病理性疼痛小鼠模型中,VTA 投射到DG 的DA 能神经元兴奋性降低介导了慢性疼痛引起的AHN 减少和空间记忆受损[24]。此外,和慢性疼痛相关的精神疾病(如重度抑郁)也与AHN受损相关,修复AHN 可能是缓解与慢性疼痛相关的记忆损伤和负性情感的有效方法[25]。
这些结果提示海马DA 信号和VTA 投射到背侧海马的DA 能神经元参与了局部的AHN,并且可能通过这一机制调控疼痛感觉及其相关的认知行为。
4. VTA→Amy 的DA 能投射
Amy 是位于颞叶内侧的杏仁状结构,在情绪、应激、以及焦虑抑郁等各类精神疾病中都发挥了重要作用,同时Amy 也是脑内疼痛情感维度的调控中心,并且参与了疼痛的下行易化通路调节。Amy由多个在解剖和功能上都各不相同的亚核构成,主要包括基底外侧杏仁核群(basolateral complex of the amygdala, BLA),杏仁中央核(central nucleus, CeA) 以及夹层细胞群 (intercalated cell clusters, ITC)。其中BLA 是Amy 接受伤害性信号传入的主要部分,含有大量的锥体神经元(85%~90%)以及一部分GABA 能神经元。BLA 将处理后的信息传递给CeA。CeA 又被称作“伤害感受杏仁核”(nociceptive amygdala),是调控疼痛相关情感反应的重要核团,其外侧囊状部 (laterocapsular division, CeLC) 是疼痛相关可塑性发生的重要区域。ITC 是Amy 内抑制性微环路的重要组成部分,主要由GABA 能神经元构成,可以抑制疼痛相关的CeLC 输出[26]。
急性应激激活VTA DA 能神经元,后者向下游脑区释放DA,Amy 内DA 含量要远高于mPFC 或NAc 等脑区[27,28]。DA 各型受体在Amy 内均有分布,但是也存在一定程度的特异性,比如D1 受体在三个区域中均有表达但是在ITC 中最多[29],D2 受体在BLA 内不与D1 共标,而在ITC 内则与D1 受体共存[30]。此外,BLA 更多的接受来自VTA 前外侧区的DA 能神经元的输入[31],而以CeA 为主要注射位置的逆行示踪实验则发现投射到Amy 的DA 能神经元分布于整个VTA 以及黑质致密部[32]。此外,还有报道称激活Amy 内的DA 能神经元末梢可以使CeA 内的一部分神经元产生兴奋性突触后电流[33],慢性疼痛也可激活CeA 神经元,而抑制这些神经元活性可以缓解与慢性疼痛相关的负面情绪[34],提示Amy 外来的DA 输入可能通过影响CeA 神经元活动调控疼痛感觉及其相关的情感症状。而在BLA,DA 则能够提高兴奋性投射神经元的抑制性突触后电流的频率[35]。这些证据提示DA 在Amy 的作用可能具有区域依赖性。
目前有一种关于情绪与疼痛在Amy 相互作用的假说:焦虑、抑郁等消极情感状态能加重疼痛,并且增强Amy 与下游脑区的神经联系;积极的情绪则能抑制Amy 介导的疼痛易化[36]。考虑到VTA DA 能神经元为核心的中脑奖赏系统在疼痛与镇痛调控中的作用[37],以及VTA 到Amy 不同亚区投射的受体和功能差异,中脑DA 能神经元可能通过Amy 来整合疼痛发生发展中的感觉和情感等成分。
5. VTA 的上游神经环路调控疼痛
VTA 神经元接受来自PFC、外侧下丘脑(lateral hypothalamus, LH)、LHb 以及中缝背核 (dorsal raphe nucleus, DRN)、Amy 等多个脑区的兴奋性、抑制性或调节性(5-HT 能和肽能)神经输入。这些上游投射及其与VTA 形成的神经环路也参与了疼痛的调控。
mPFC 发出的谷氨酸能投射可以直接支配VTA中的DA 与GABA 能神经元,激活mPFC 可以增加VTA 谷氨酸释放,激活DA 能神经元,促进DA的释放,具有潜在的疼痛调控作用。中脑导水管周围灰质腹外侧区(ventrolateral periaqueductal grey, vlPAG) 主要向VTA 发出兴奋性谷氨酸能投射,但也有少量抑制性的GABA 能投射,并且这些神经元优先投射到VTA 的非DA 神经元。此外,这条环路在偏头痛的动物模型中被激活,抑制这条环路可以缓解偏头痛所导致的厌恶情绪[38]。
VTA 也接受来自NAc 的大量GABA 能输入。NAc 内的GABA 能神经元能够直接或间接地投射到VTA,这些神经元分别属于直接通路和间接通路。其中直接通路的神经元主要表达激活时可提高细胞兴奋性的D1 受体,其直接投射到黑质和VTA,与奖赏相关。间接通路的神经元则主要表达激活时可抑制细胞兴奋性的D2 受体,其直接投射到苍白球和下丘脑,间接支配VTA 等中脑核团,与厌恶及负面情绪相关。有报道发现外周神经损伤时间接通路神经元兴奋性的上调会加重痛觉异常[39]。
VTA 还接受来自背外侧被盖核 (laterodorsal tegmental nucleus, LDTg) 的胆碱能和谷氨酸能投射[6]。电刺激LDTg 可以激活VTA 中的烟碱乙酰胆碱和离子型谷氨酸受体从而增加NAc 的DA 释放[40],并且LDTg→VTA 胆碱能神经元约有40%会被热痛刺激所激活[41]。还有研究证实,运动可以激活LDTg→VTA胆碱能和谷氨酸能神经元从而缓解疼痛[42]。
此外,VTA 也接受来自LH 的GABA 能以及食欲肽 (orexin,hypocretin) 能投射,使用光遗传学方法激活LH→VTA 的GABA 能神经元可以产生奖赏作用,而食欲肽可以增强VTA 投射到NAc 的DA 能神经元兴奋性[43,44]。VTA 内注射食欲肽A 可以产生镇痛作用,并且这种作用可以被NAc 内注射D1 或D2 受体拮抗剂所拮抗[45]。此外,在炎性痛的大鼠模型中,激活食欲肽神经元可以产生镇痛作用,而拮抗VTA 内的食欲肽受体则可以抑制这种镇痛作用[46]。由此可见,LH→VTA 的食欲肽能投射可能通过影响中脑边缘奖赏系统来调控疼痛。
LHb 也能发出谷氨酸能投射到VTA 的GABA能神经元以及DA 能神经元,慢性疼痛会激活投射至VTA GABA 能神经元的LHb 谷氨酸能神经元,后者通过激活局部的GABA 能神经元抑制DA 能神经元的兴奋性[6,47],但这条通路在疼痛中的作用尚不明确。
DRN 发出5-羟色胺(5-hydroxy trypt amine, 5-HT)能及谷氨酸能投射到VTA,有报道证实抑制这条通路会抑制动物的动机行为[48,49]。DRN 谷氨酸能神经元和一部分5-HT 与谷氨酸递质共存神经元可以通过释放谷氨酸活化突触后DA 能神经元,最终改变 VTA→NAc 环路的兴奋性[49,50],这可能是慢性疼痛时DRN 5-HT 能神经元放电频率明显增加[51],VTA DA 能神经元异常放电的部分原因,干扰这条通路可能会对疼痛及相关症状产生影响。
6. VTA 内部三种神经元之间的相互作用
VTA 包含60%~65%的DA 能神经元、30%~35%的GABA 能神经元和2%~3%的谷氨酸能神经元[8],这些神经元在VTA 内部也存在突触联系,构成局部微环路,参与信息整合。
VTA DA 能神经元接受局部的GABA 能投射,激活后者可以通过GABAA受体抑制DA 能神经元的兴奋性,并且可以影响NAc 内DA 的释放与奖赏行为。鉴于脑内其他核团可能作用于VTA 内的GABA 能神经元,这条局部投射对于间接调控中脑多巴胺奖赏系统的功能可能极为重要,比如LH GABA 能神经元可能通过与VTA GABA 能神经元形成突触联系间接调控VTA→NAc DA 能神经元从而参与焦虑等负性情感以及摄食行为的调控[52]。VTA 内的谷氨酸神经元也被发现与核团内的其他神经元存在突触联系[53]。 同时,VTA 内的谷氨酸能与GABA 能神经元均表达D2 受体[54],提示VTA DA能神经元可能作为突触前成分构成局部微环路。然而,上述微环路在疼痛及其相关症状的调控中发挥怎样的作用尚有待进一步研究。
此外,VTA 星形胶质细胞 (astrocyte) 和小胶质细胞 (microglia) 也参与了痛觉调控。在慢性疼痛动物模型(使用套管构建的慢性坐骨神经压迫损伤)中,VTA 内的小胶质细胞被激活,并通过改变VTA内GABA 能中间神经元胞外的氯离子梯度影响DA依赖的奖赏行为(如可卡因摄入),这一结果提示VTA 内激活的小胶质细胞可能是慢性疼痛时DA 系统功能失调的一个重要原因[55]。此外,星形胶质细胞也能够调节VTA 内GABA 能神经元的兴奋性,光遗传学激活VTA 内的星形胶质细胞可以通过谷氨酸转运体依赖的方式提高局部GABA 能神经元的兴奋性,从而抑制DA 能神经元,诱导小鼠逃避行为;敲除VTA 星形胶质细胞中的谷氨酸转运体能抑制这种逃避行为[56]。以上结果说明VTA 内的胶质细胞也能够通过间接影响神经元兴奋性的方式(主要为GABA 能神经元)参与疼痛及其相关行为的调控。
综上所述,VTA 多巴胺能神经元投射到多个下游核团,也接受多个上游核团的支配。在这些复杂的神经环路中,细胞类型和核团亚区的多样性以及局部复杂的突触联系使得中脑多巴胺奖赏环路在疼痛及其相关神经精神症状的调控中作用也更加复杂。
三、中脑DA 奖赏系统调控疼痛的分子机制
1. DA
DA 是脑内重要的儿茶酚胺类神经递质之一。作为脑内DA 的主要来源,VTA 通过释放到下游脑区(如NAc)的DA 参与奖赏、动机、情绪等多种生理、病理过程。在接受夹尾刺激时,NAc 核内DA 释放增加而壳内DA 含量减少,在刺激消失时,壳内DA 水平增高[13]。在慢性疼痛状态下,VTA→NAc 环路DA 释放减少,D2 受体下调,这种变化与痛敏呈正相关[39,57],提示VTA→NAc 环路DA 可能通过D2 受体产生镇痛作用[58]。在啮齿类动物研究中,与短暂的疼痛刺激(如热板)相比,D2 受体激活在福尔马林等引起的持续性疼痛中更能降低疼痛反应[59]。人体研究表明短暂的DA 浓度降低与疼痛情感而非疼痛感觉相关[60]。在切口痛动物模型中,逆转DA 释放可阻碍外周镇痛产生的条件位置偏好[61]。因此,有学者提出VTA→NAc 环路DA通过影响动机、奖赏过程而调节疼痛感觉[62]。同时,慢性疼痛引起的VTA→NAc 环路DA 释放减少以及D2 受体下调可能与疼痛相关的“奖赏缺陷 (reward deficiency) ”相关,表现为动机减少、负性情感等。在这种“奖赏缺陷”下,镇痛药物如阿片类药物引起的奖赏效应减少,一方面与VTA DA 释放减少、DA 能神经元细胞外调节蛋白激酶 (extracellular regulated protein kinases, ERK) 信号通路功能下降相关[63,64],另一方面与慢性疼痛引起的μ 阿片受体介导的G 蛋白激活减少相关[65]。
2. BDNF
BDNF 广泛分布于中枢神经系统中,在调节突触可塑性以及神经元存活和功能中发挥重要作用。BDNF 与其受体酪氨酸激酶B (Tyrosine kinase, TrKB) 结合,通过下游细胞信号通路发挥相应的生物学效应。在脊髓水平,BDNF 被证实参与调节慢性疼痛下伤害信息传递及中枢敏化过程。在中脑DA 奖赏系统中,BDNF 参与调节DA 能神经元放电、递质释放过程,并促进DA 能神经元存活。同时,VTA DA 能神经元也可以合成BDNF,并且通过向下游脑区释放发挥作用。例如,我们近期研究发现:在CCI 引起的神经病理性疼痛条件下,疼痛状态下VTA 和NAc 的BDNF 蛋白表达增加,而BDNF mRNA 只在VTA 表达增加,提示NAc 增加的BDNF 可能来自VTA;条件性敲除VTA→NAc环路特异性BDNF 能缓解神经病理性痛行为[9]。此外,在慢性疼痛下,海马内BDNF水平出现下降[24,66]。当在DG 过表达BDNF 后,慢性炎性疼痛相关的感觉、情感、认知障碍可被逆转[67]。我们还发现CCI模型引起的神经病理性疼痛条件下,小鼠DG AHN减少,空间学习记忆功能受损,VTA→DG DA 能神经元活性降低,激活这些神经元可改善疼痛相关的空间学习记忆和DG AHN 异常;化学遗传学特异性调控VTA→DG DA 能神经元活性双相调节DG BDNF 蛋白水平;慢性疼痛状态下,VTA BDNF mRNA 减少,DG BDNF 蛋白水平降低,在VTA 过表达BDNF 逆转慢性病理性疼痛相关的AHN 受损和空间学习记忆异常[24]。
综上所述,这些证据高度提示慢性疼痛状态下VTA DA 能神经元活性发生改变,通过影响BDNF蛋白质的合成及其向下游脑区的释放,从而介导慢性疼痛相关的痛觉过敏和学习记忆异常。
3. 阿片受体
阿片类药物通过阿片受体发挥镇痛作用是20 世纪神经科学领域内具有里程碑式意义的发现。阿片受体包括μ (MOR)、δ (DOR)、κ (KOR) 三类,阿片类药物的镇痛作用主要依赖MOR。除了中脑导水管周围灰质,VTA 也是吗啡发挥镇痛作用的关键脑区。一系列的研究表明喙内侧被盖核 (rostromedial tegmental nucleus, RMTg)即VTA 的尾部在这一过程中发挥重要作用[68];病理状态下,VTA 内MOR功能受损,DA 释放减少[69],可能引起疼痛感觉以及动机、情感等相关的症状;阿片药物可能通过突触前GABA 能末梢(来自局部或外部)MOR,抑制GABA 释放,从而去抑制VTA DA 能神经元,增加DA 释放,发挥镇痛作用[70]。同时,VTA DA 能神经元也表达丰富的KOR,并且后者在疼痛及其相关的负性情感调控中可能发挥重要作用。例如,外周神经损伤引起的神经病理性疼痛小鼠会产生位置厌恶的行为学表现,并伴随NAc 中KOR 表达和功能上调,VTA 局部给予KOR 激动剂 (U50488) 能抑制DA 能神经元,减少VTA 及其下游NAc DA 释放,介导条件性位置厌恶行为。条件性敲除VTA DA 能神经元的KOR 后,位置厌恶行为消失[71]。近期一项研究表明在慢性炎性疼痛下,NAc 壳中强啡肽 (dynorphin) 神经元接受的抑制性传入降低,引起强啡肽合成增加,增加的强啡肽作用于投射至NAc 的传入神经突触前KOR 受体使其功能活性增强,改变NAc 中DA、5-HT、谷氨酸和GABA 等递质释放,进而导致负性情感状态[72]。这些证据提示KOR 对DA 环路和奖赏行为的调节可能是慢性疼痛时负性情感发生的重要机制[73]。但是,也有研究表明拮抗NAc 壳中的KOR 并不影响疼痛相关的厌恶行为[74],这可能是由于作用于NAc 壳中不同区域KOR 功能异质性造成的[75]。上述证据提示,中脑DA 奖赏系统的阿片受体在疼痛及其相关的负性情感调控中发挥重要复杂的作用,需要特异性更强的深入研究。
4.谷氨酸及其受体
谷氨酸是中枢神经系统中重要的兴奋性神经递质。中脑DA 奖赏系统除了内在的DA 作为重要的神经递质之外,还接受大量谷氨酸能投射的支配。α-氨-3-羟基-5-甲基-4-异恶唑丙酸受体 (α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptors, AMPAR)、N-甲基-D-天冬氨酸受体 (N-methyl-D-aspartic acid receptor, NMDAR) 和红藻氨酸受体 (kainate receptor, KAR) 是外来谷氨酸发挥作用的重要受体基础。慢性神经病理性疼痛和炎性疼痛下,NAc 中GluA1(AMPAR 的一种亚基)表达增高,使AMPAR 缺乏GluA2,形成钙通透型AMPAR (calcium-permeable AMPARs, CPARs),药理学阻断后者加重疼痛相关抑郁样表现,而激活后缓解抑郁样表现,提示NAc 中CPARs 可能是调节疼痛相关抑郁样行为表现的分子机制[76]。同时,慢性神经病理性疼痛还会引起NAc 壳中NR2B 磷酸化、表达增高,造成NMDAR 兴奋性突触后电位衰减时间延长[39,77]。AMPAR 功能的降低以及NMDAR 动力学改变引起D2 受体阳性MSNs 神经元突触后长时程抑制 (long term depression, LTD),这种突触可塑性改变与慢性疼痛时寻求的奖赏动机行为减少相关[78]。此外,NAc 中D2 神经元突触前囊泡谷氨酸转运体1 (vesicular glutamate transporter, vGluT1) 含量降低,提示谷氨酸能输入减少[79],同时NAc 与mPFC 之间的纤维连接也是减少的[80]。光遗传学激活mPFC→NAc 环路谷氨酸能神经元能够缓解SNI引起的疼痛感觉和抑郁样症状[81]。这些证据提示,mPFC 谷氨酸能投射可能通过调控其与NAc MSNs神经元之间的突触可塑性参与慢性疼痛及其相关负性情感的调控。VTA 本身也包含约2%~3%左右的谷氨酸能神经元,这部分神经元及其下游谷氨酸受体是否参与疼痛调控尚有待进一步研究。
5. 食欲肽
食欲肽是由LH 食欲肽能神经元特异性合成分泌的一种调节觉醒、食欲和其他生理功能的神经肽,作用于两类受体:食欲肽受体1 (orexin receptor 1, OX1R)和食欲肽受体2 (orexin receptor 2, OX2R)。VTA 和NAc 内OX1R 和OX2R 表达丰富,是食欲肽调控疼痛行为的重要靶向脑区[82]。激活VTA 食欲肽受体可增加VTA→NAc 环路DA 的释放[83,84]。LH 内注射卡巴胆碱可有效缓解福尔马林引起的疼痛症状[84],在VTA 或NAc 中应用OX1R 或OX2R 拮抗剂均可阻断这一镇痛作用[83~85],并且在VTA 内拮抗OX1R 的镇痛作用强于拮抗OX2R 的镇痛作用[84],同一受体在VTA 的作用强于在NAc 的作用[83]。这些结果提示食欲肽受体在LH→VTA 环路发挥镇痛作用中扮演重要角色,中脑奖赏系统食欲肽或许可作为慢性疼痛治疗的潜在靶点。
6. 其他分子机制
P 物质 (substance P, SP) 是一种肽类神经递质,通过与神经激肽1 (neurokinin-1 receptor, NK1) 受体、神经激肽2 (NK2) 受体和神经激肽3 (NK3) 受体结合发挥作用。大量证据提示SP 在外周和中枢神经系统中参与疼痛调控。在VTA 神经元中,NK1 和NK3 受体均有分布,但NK1 受体数量少于NK3 受体,并且投射到mPFC 的神经元比投射到NAc 的神经元表达更多的NK3 受体[86]。既往研究表明VTA内局部注射NK1、NK3 受体的选择性激动剂产生镇痛作用[87]。在VTA 中,SP 通过作用于NK1 受体激活GABA 能神经元,作用于NK3 受体激活DA能神经元[88],然而,SP 是否通过作用于VTA 中特定神经元群体影响机体疼痛处理过程仍不清楚。
神经降压素 (neurotensin, NT) 是一段含有13 个氨基酸的神经肽,广泛分布于中枢神经系统中,通过作用于延髓吻段腹侧区“on”或“off”细胞易化伤害性感受或缓解疼痛[89]。同时,NT 可与中脑DA 奖赏系统相互作用,影响机体奖赏过程:NT 通过作用于1 型受体抑制D2 型受体,增加VTA DA 能神经元末梢在NAc 的DA 递质释放,从而影响奖赏过程[90],但NT 与中脑DA 奖赏系统相互作用是否参与调节疼痛,尤其是慢性疼痛和相关的负性情感还需进一步的研究。
其他潜在分子机制还包括且不限于内源性大麻素系统、离子通道和其他神经调节肽等,这些分子可能通过作用于中脑DA 奖赏系统特定受体、改变胞内信号传导通路、影响细胞放电特性、调节突触可塑性等多种机制共同参与调控疼痛的病理生理过程。
四、结语与展望
在疼痛领域有一种根深蒂固的观念认为,疼痛降低DA 的释放,DA 增加反映镇痛产生的奖赏效应,疼痛和DA 是一种此消彼长的关系。病毒工具和遗传学技术的出现与发展促进了人们对中脑DA奖赏系统在疼痛调控中作用更加深入的认识,这一观点也正在被逐渐改变。VTA 及其上下游脑区在解剖和功能上的异质性促使人们对中脑DA 奖赏系统在疼痛调控中作用的研究也向着更加细致的细胞和亚区特异性环路水平方向发展。在认识中脑DA 奖赏环路调控疼痛的精确环路的基础上,分子水平的研究也应该在先进分子生物学技术的辅助下同步进行,如单细胞测序、投射特异性和细胞类型特异性的测序技术等。高度特异性的神经环路和分子机制研究将为开发针对疼痛特定症状的治疗策略或药物开发提供精确的靶点。疼痛是一个复杂的过程,中脑DA 奖赏系统有着复杂的神经网络,因此如何在神经环路水平发现疼痛基于中脑DA 奖赏系统更加全面的机制可能是未来疼痛脑机制研究面临的一个重大挑战。
非阿片镇痛的脑机制及相关药物的研发是疼痛领域内一个热点和难点问题。中脑DA 奖赏环路接受神经降压素等一些神经肽类物质的调控,提示其可能具有参与非阿片镇痛的潜能。因此,探索中脑DA 奖赏环路非阿片镇痛的细胞与分子机制,可能是未来研究的一个方向,为缓解目前日益恶化的全球阿片危机带来希望。
另外,随着人们对疼痛认识的不断深入,越来越多的成分被纳入到疼痛的定义当中,发现中脑DA奖赏系统在除疼痛感觉之外其他成分中的作用,探讨各种成分之间的相互影响,也将是未来很长一段时间里的一个重要方向。虽然本文没有进行阐述,但中脑DA 奖赏系统相关的安慰剂镇痛作用机制、疼痛的表观遗传学机制以及中脑多巴胺奖赏系统相关疾病(如帕金森病)伴随的疼痛行为也一直是疼痛领域内长期需要解决的重要问题。
综上所述,本文从分子与神经环路水平就中脑DA 奖赏系统在疼痛调控中作用进行系统综述,并对这一系统调控疼痛的未来研究方向进行了展望,可能为人们重新认识中脑DA 系统在疼痛与镇痛调控中的作用提供重要参考,为基于这一系统的疼痛研究指出了可能的发展方向。

