二代测序检测非小细胞肺癌多驱动基因突变对临床诊疗的意义
郑文亮,郗彦凤,高 宁,郭江红,白 玮,郭艳琳
肺癌是全球最常见的癌症,也是癌症死亡的主要类型,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌的75%~85%。NSCLC患者一般在确诊时已是晚期,预后较差。近年来,NSCLC的治疗在驱动基因抑制剂、效应通路抑制剂和免疫抑制剂的研发等方面取得发展。在治疗前全面了解NSCLC驱动基因突变谱,能够帮助临床选择合适的靶向药物进行治疗,从而有效延长患者的生存期。目前临床病理常用的检测技术尚存一定的局限性,无法同时进行多基因、多位点的定性定量检测。本实验通过二代测序技术(next-generation sequencing, NGS)对209例NSCLC进行10种驱动基因突变联合检测,分析这些驱动基因突变特点及其与临床病理特征的关系;对NGS检测与FISH、免疫组化(IHC)、RT-PCR检测结果进行一致性分析,探讨应用NGS技术对NSCLC驱动基因联合检测的临床意义。
1 材料与方法
1.1 材料收集2016年3月~2018年3月山西省肿瘤医院手术切除且经病理确诊的209例中晚期NSCLC石蜡包埋组织。其中,男性128例,女性81例;年龄范围31~82岁,中位年龄59岁,分为两组:≥60岁104例,<60岁105例;有吸烟史110例,无吸烟史99例;临床分期:Ⅲ期87例,Ⅳ期122例;腺癌178例,非腺癌(包括肺大细胞癌、肺鳞癌、肺神经内分泌癌及肺腺鳞癌)31例。收集入组病例往期院内EGFR-PCR检测结果,ALK融合FISH和IHC检测结果,ROS1-PCR检测结果。
1.2 DNA提取与突变检测209例肺癌组织样本按照厦门艾德的核酸提取试剂(FFPE DNA/RNA闽厦械备20150082号)提取DNA用于Illumina MiniSeq测序平台(Illumina NextSeqCN500贝瑞合康)进行测序,根据厦门艾德人类癌症多基因突变联合检测试剂盒说明书进行基因突变检测。
1.3 统计学分析采用SPSS 25.0软件进行统计学分析,变量组间比较采用χ2检验,理论频数<5的则采用Fisher确切概率法,不同检测方法之间的一致性分析采用Kappa检验。
2 结果
2.1 10种驱动基因联合检测突变情况209例NSCLC中10种驱动基因突变联合检测总体突变阳性率为69.9%(146/209),分别是EGFR(37.6%,80/209)、ALK(13.1%,28/209)、KRAS(11.3%,24/209)、ROS1(3.3%,7/209)、HER-2(1.9%,4/209)、PIK3CA(1.4%,3/209)、BRAF(0.9%,2/209)、RET(0.5%,1/209)、MET(0,0/209)、NRAS(0,0/209)。有3例为两种基因共存突变(表1)。
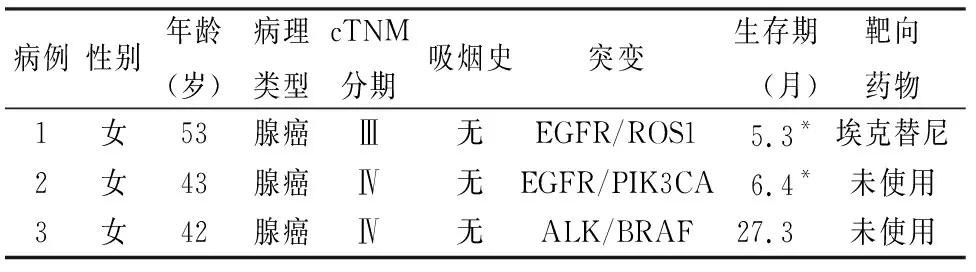
表1 3例多基因共存突变病例
2.1.1EGFR基因突变情况 在EGFR基因单一突变的78例患者中单位点突变74例,Exon19占48.7%,Exon21占43.6%,Exon20占2.6%;4例双位点突变(5.1%)。主要包括Exon19del、Exon19delins;Exon20ins、T790M、S786I;Exon21 L858R、L861Q(表2)。
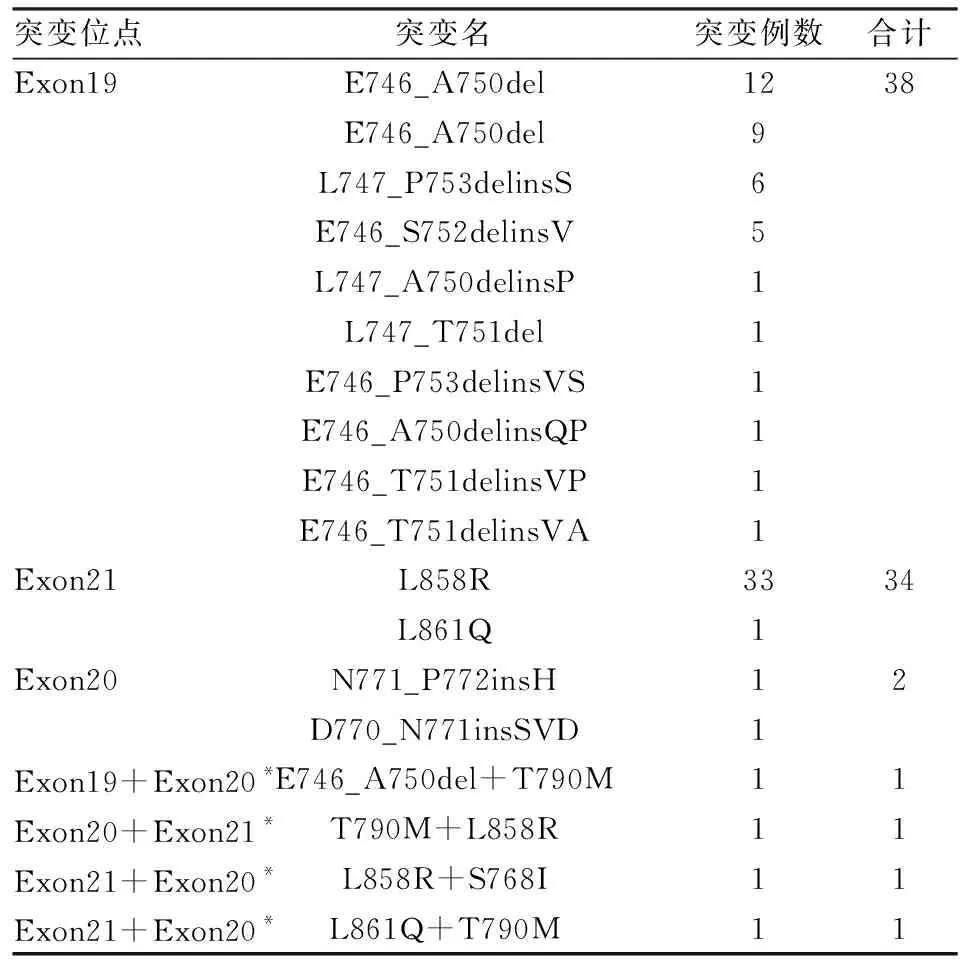
表2 EGFR突变位点情况
2.1.2ALK基因融合突变情况 27例ALK基因融合突变,包括EML4 Exon13-ALK Exon20(51.8%),EML4 Exon6-ALK Exon20(33.3%),EML4 Exon18-ALK Exon20(7.4%),EML4 Exon20-ALK Exon20(3.7%),EML4 Exon13-ALK Exon20(3.7%)。
2.1.3KRAS基因突变情况 24例KRAS基因突变中Exon2突变占95.8%(23/24),包括G12C(33.3%),G12V(33.3%),G12A(20.8%)、G12D(4.2%)、G12S(4.2%);Exon3-Q61H突变1例(4.2%)。
2.1.4其他基因突变情况 7例ROS1融合突变,包括6例CD74-ROS1、1例GOPC-ROS1。HER-2突变4例,均为p.A775_G776insYVMA突变。PIK3CA基因H1047R突变2例。BRAF V600E突变2例。RET融合(KIF5B-RET融合)1例。未检出MET和NRAS突变阳性病例。
2.2 NGS检测结果与临床标准方法检测结果一致性分析
2.2.1EGFR基因突变检测结果一致性分析 209例NSCLC样本NGS检测结果显示EGFR阳性突变80例(包含2例双基因突变),阳性率为38.3%,分别为19del 40例,L858R 36例,T790M 3例,20ins 2例,L861Q 2例,S768I 1例。RT-PCR检测结果显示EGFR阳性突变72例,阳性率为34.4%,分别为19del 38例,L858R 34例,T790M 2例,L861Q 2例,S768I 1例。一致性分析结果显示具有极强一致性(Kappa=0.897,P<0.000 1,表3)。NGS检测与院内RT-PCR检测EGFR基因突变位点19del、L858R和其他几种稀有突变一致性分析,均具有极强的一致性(Kappa值分别为0.905、0.897、0.829)。

表3 EGFR基因NGS检测与PCR检测结果一致性分析
2.2.2ALK融合检测结果一致性分析 209例NSCLC中205例有ALK院内FISH检查结果,NGS结果与FISH检测结果一致性分析显示,两者具有极强一致性(Kappa=0.898,P<0.000 1)。NGS结果与IHC检查结果一致性分析,两者具有极强一致性(Kappa=0.920,P<0.000 1,表4)。

表4 ALK融合NGS检测与FISH、IHC检测结果的一致性分析
2.2.3ROS1检测结果一致性分析 将本次对ROS1融合基因的NGS检测结果与院内PCR结果进行一致性分析结果显示,两者具有极强一致性(Kappa=0.931,P<0.000 1,表5)。

表5 ROS1融合突变NGS检测与PCR检测结果一致性分析
2.3 各驱动基因突变情况与NSCLC临床病理特征的关系EGFR突变与患者性别、是否吸烟、TNM分期、组织学类型具有相关性,与患者年龄、肿瘤的发生部位无关。ALK基因融合与患者性别、是否吸烟具有相关性。KRAS基金突变与患者性别、年龄具有相关性。ROS1基因融合与TNM分期具有相关性(表6)。
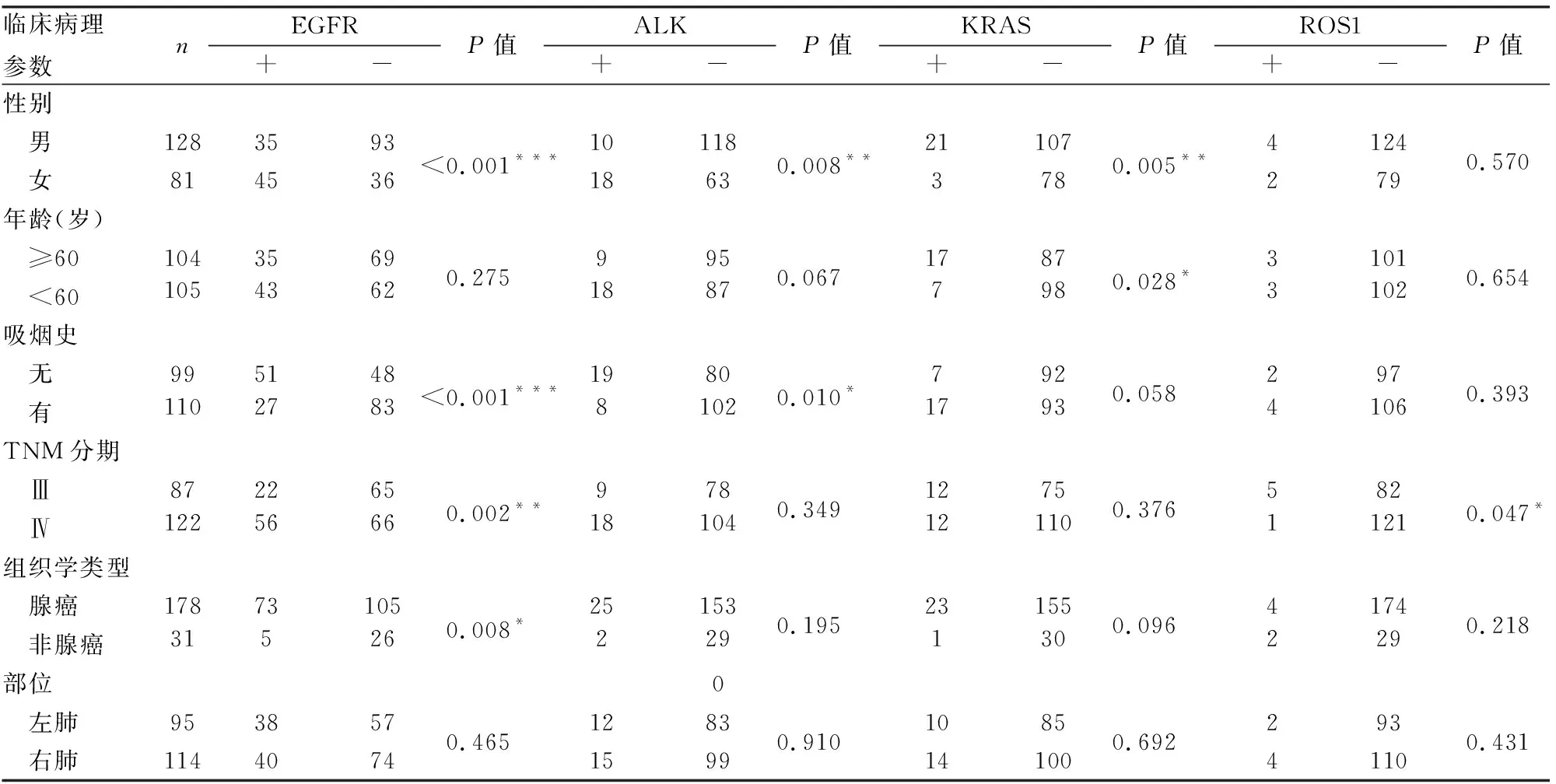
表6 各基因突变与非小细胞肺癌临床病理特征的关系
3 讨论
我国NSCLC驱动基因EGFR突变阳性率最高,其次是KRAS和ALK,ROS1和BRAF突变阳性率相对较低[1],本组NSCLC驱动基因检测EGFR突变阳性率为37.6%,KRAS阳性率为11.3%,ALK为13.1%,ROS1为3.3%,BRAF为0.9%,与该研究结果基本一致。EGFR突变在Exon19高发,其次是Exon21,Exon20相对较少[2]。在本组EGFR阳性病例中,Exon19突变占48.7%,Exon21占43.6%,Exon20占2.6%,与之前的研究结果一致。KRAS突变绝大多数发生在Exon2,Exon3阳性率较低[2]。KRAS基因突变类型中G12C和G12V最为常见[3]。本组中KRAS阳性Exon2突变占95.8%,主要突变类型是G12C和G12V(66.6%),与之前的报道基本一致。ALK-EML4是ALK融合的主要类型,并且均为腺癌患者[4],本组27例均为ALK-EML4融合,在腺癌中的比率为92.6%。本组结果与文献报道基本吻合,不同研究可能会因为检测方法和检测样本的不同导致检测结果存在一定的差异。
EGFR突变好发于具有以下特征人群:亚洲人、女性、非吸烟者、腺癌[5],本组EGFR突变在性别、是否吸烟及组织学类型的统计结果与文献报道相一致。另外,Ⅳ期较Ⅲ期突变阳性率高,差异有显著性,与黄清洁等[6]报道一致。ALK重排在女性患者、非吸烟人群及腺癌中多见[7]。本组中ALK阳性在患者性别和是否吸烟组差异具有显著性,与该报道一致。我国男性NSCLC患者KRAS基因突变阳性率高于女性,并且在腺癌中多见[8],在本组中KRAS突变多为60岁以上男性患者。KRAS突变与吸烟的关系存在争议,在本组中KRAS突变阳性吸烟者明显高于非吸烟者。
在NSCLC中,极少数患者有2个或3个基因突变共存,其中EGFR/KRAS最常见,其次是ALK/KRAS[1]。EGFR与ALK在NSCLC中也有共存现象,尽管这种共存突变的几率相对较小[9],其他研究中也有报道EGFR和ALK联合突变的病例[10]。本组中发现共存突变EGFR/ROS1、EGFR/PIK3CA、ALK/BRAF各1例。MAPK/ERK和PI3K/AKT信号通路调节细胞生长、增殖、分化、迁移和凋亡,而EGFR、ALK、ROS1、BRAF和PIK3CA对这两种信号通路均有调节作用[11]。这几种基因在单独突变激活状态下都可能导致肿瘤的发生和发展,但是对于基因共存突变的发生机制以及共存状态下是否彼此影响尚不清楚。另外,联合突变是否比单一突变患者的预后更差尚不清楚。相关的临床靶向治疗研究发现,当EGFR突变合并有其他驱动基因改变时,会降低对EGFR-TKIs的敏感性[12]。说明驱动基因共存状态下可能产生了某种“协同作用”,从而产生了靶向药物抵抗。因此,多基因共存突变的发生机制以及在肿瘤中作用机制的研究应当引起重视。
在NSCLC靶向治疗前,全面了解肿瘤突变情况才能针对肿瘤的高度异质性实施有效治疗。许多新的治疗方案也在开发中,比如联合不同肿瘤的靶向药物进行治疗[13],联合同一突变基因各代靶向药物进行治疗[14]。患者基因突变表型需要进行准确且全面的掌握,甚至需要动态检测。目前在临床病理中使用的检测技术尚有不足,FISH价格昂贵、技术要求高,IHC无法明确融合基因类型[15];RT-PCR对于从福尔马林固定石蜡包埋样品组织中提取的RNA质量较差;Sanger测序法成本高、通量低。而且临床靶向药物的多样化导致检测项目增多,在实际诊断检测过程中微量标本难以满足多项检测,而NGS技术只需从福尔马林固定石蜡包埋组织样品中提取10 ng DNA或RNA,就能有效地扩增和测序多个基因。本组对NGS与其他几种检测技术结果的一致性进行分析,结果证明其准确性极高。因此,NGS检测正是目前临床病理诊断以及靶向药物治疗优秀的辅助检测手段,可以为临床NSCLC驱动基因突变的诊疗提供可靠支持。

