肝细胞肝癌中Piwil2表达与临床病理特征及预后的关系
王申涛,叶冬雪,陈云庆,李 宏,时维平,周 璇,项锋钢,
肝细胞肝癌(hepatocellular carcinoma, HCC)是多因素引起的消化系统恶性肿瘤,病死率高[1]。近年虽对HCC的诊疗取得一定的进展,但多数患者发现时已处于中晚期,预后较差,且对其癌变与侵袭的分子机制尚不清楚。因此,探索HCC侵袭、转移及预后的临床标志物具有重要的现实意义。Piwil2属于Argonaute蛋白家族PIWI亚家族成员[2]。Argonaute蛋白是RNA诱导沉默复合物(RISC)的主要部件,在RNA沉默、干细胞的繁殖更新及转录调控中均发挥重要作用[3]。有研究证实Piwil2在甲状腺癌、结肠癌、子宫颈癌、肺癌等多种癌症和癌细胞系中表达异常,且其表达与肿瘤转移复发均有关联[4]。但是尚未见其在HCC中的表达及与患者预后的相关性报道。本文采用免疫组化PV 6000法检测Piwil2在HCC组织及对应癌旁非瘤组织中的表达,分析其表达与HCC临床病理特征的关系及对患者预后的影响,探讨Piwil2表达在HCC发生发展、侵袭转移和预后中的意义。
1 材料与方法
1.1 材料收集2015年8月~2016年10月青岛大学附属医院存档的手术切除并经病理证实的HCC标本163例,包括HCC组织及对应癌旁非瘤组织(距癌组织≥5 cm,镜下排除HCC及瘤变)。入组HCC病例临床病理资料均完整,且术前均未实施其他方案治疗。其中男性135例,女性28例;年龄32~83岁,中位年龄57.6岁;HCC依据Edmondson标准进行分级:Ⅰ+Ⅱ级88例,Ⅲ+Ⅳ级75例;有包膜侵犯91例,无包膜侵犯72例;有脉管侵犯69例,无脉管侵犯94例;TNM分期:Ⅰ+Ⅱ期138例,Ⅲ+Ⅳ期25例;HBsAg阳性128例,阴性35例。所有患者术后随访3年以上,目前持续随访中,以电话随访为主,患者复诊为辅。随访过程中163例HCC患者有26例失访,有完整随访信息者137例。本实验获得青岛大学附属医院伦理委员会批准,所有患者均知情同意。
1.2 试剂兔抗人多克隆抗体Piwil2购自美国Proteintech公司;通用型免疫组化PV 6000检测试剂盒购于北京中杉金桥公司;组织芯片由上海芯超公司制作并提供技术支持。
1.3 方法
1.3.1设计与制备组织芯片 将符合入选标准的HCC组织及对应癌旁非瘤组织蜡块行HE染色,采用双盲法由经验丰富的病理科医师对石蜡标本(包括HCC组织及对应癌旁非瘤组织)中有代表性的部位进行标记。根据收集的标本例数(每例患者两个组织芯,包括HCC组织和癌旁非瘤组织)设计为5个组织阵列,用细针打孔(直径1.5 mm),将供体蜡块中标记好的组织芯取出并整齐排列到受体蜡块上,制成组织芯片蜡块。置于55 ℃温箱中10 min,待阵列融合完全后取出,4 μm厚连续切片,冷水漂片,45 ℃温水中展片2 min,捞片,拷片备用。将制备好的组织芯片进行HE染色,复检以确认芯片质量。
1.3.2免疫组化 将制备好的组织芯片行免疫组化PV 6000法染色,Piwil2抗体工作浓度为1 ∶50。先将切片脱蜡和水化,抗原修复,添加一、二抗,DAB显色,复染,中性树胶封固。具体操作步骤严格按抗体和试剂盒说明书进行,用试剂盒附带的已知阳性切片作为阳性对照,用PBS液代替一抗作为阴性对照。
1.4 结果判断Piwil2蛋白表达主要定位于细胞质,未着色为阴性,淡黄色为弱阳性,棕黄色为中度阳性,棕褐色为强阳性。显微镜下每个组织芯中随机选取5个高倍视野(400×),每个视野计数100个癌细胞,取平均数。按阳性细胞百分率计分:阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。按细胞染色强度计分:阴性为0分,弱阳性为1分,中度阳性为2分,强阳性为3分。将两项评分标准所得分值相加所得总分进行结果判定:0~3分为低表达,4~7分为高表达。
1.5 统计学分析所有数据应用SPSS 23.0软件进行统计学分析,计数资料采用χ2检验;用Kaplan-Meier曲线评估Piwil2表达与生存期的关系,并进行Log-rank检验。总生存期定义为手术日期与患者死亡日期之间的间隔;无瘤生存期定义为手术日期和复发日期之间的间隔。使用Cox比例风险模型评估Piwil2表达和HCC各临床病理变量的风险比和95%CI,以P<0.05为差异有统计学意义。
2 结果
2.1 HCC及癌旁非瘤组织中Piwil2的表达163例HCC组织中Piwil2低表达85例(52.15%),高表达78例(47.85%);Piwil2在对应的癌旁非瘤组织中均呈低表达,149例(91.41%)为阴性,14例(8.59%)为弱阳性(图1~4)。Piwil2在HCC组织中的表达显著高于癌旁非瘤组织(χ2=102.532,P<0.001,表1)。
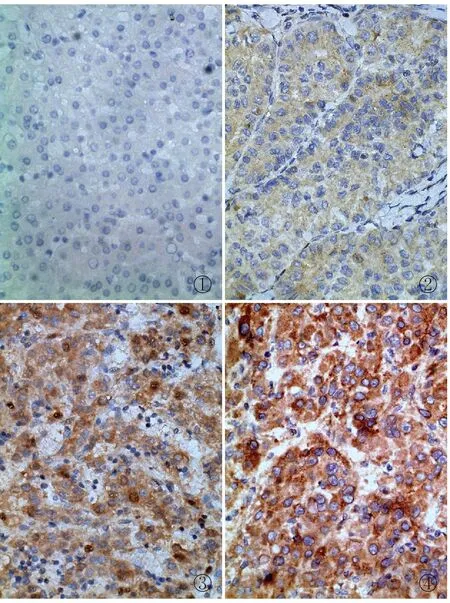
①②③④

表1 肝细胞肝癌组织和癌旁非瘤组织中Piwil2的表达[n(%)]
2.2 HCC中Piwil2表达与临床病理特征的关系Piwil2表达与肿瘤病理分级、TNM分期、包膜侵犯、脉管侵犯有关(P均<0.05)。TNM分期Ⅲ+Ⅳ期患者的高表达率为68%,高于Ⅰ+Ⅱ期(44.2%)(P=0.028);病理分级Ⅲ+Ⅳ级高表达率为73.33%,高于Ⅰ+Ⅱ级(26.14%)(P<0.001)。有包膜侵犯、有脉管侵犯患者的高表达率也高于无包膜和脉管侵犯者(54.95%vs38.89%,P=0.042;63.77%vs36.17%,P<0.001);Piwil2表达与患者年龄、性别、肿瘤直径、HBsAg无关(P均>0.05,表2)。

表2 肝细胞肝癌中Pwil2表达与临床病理特征的关系[n(%)]
2.3 Piwil2表达与HCC患者预后的关系本组患者有26例失访,将有完整随访信息的137例患者进行Kaplan-Meier预后生存分析,结果显示,Piwil2高表达组患者的总生存期(P<0.001,图5A)和无瘤生存期(P<0.001,图5B)较低表达组短。Piwil2高表达组和低表达组的总生存时间分别为(31.74±1.90)个月和(42.14±0.43)个月;无瘤生存时间分别为(26.67±2.25)个月和(40.63±0.52)个月。另外,TNM分期Ⅲ+Ⅳ期患者Piwil2高表达组总生存时间(P=0.004,图5C)和无瘤生存时间(P=0.010,图5D)比低表达组短;病理分级Ⅲ+Ⅳ级患者Piwil2高表达组总生存时间(P=0.018,图5E)和无瘤生存时间(P=0.001,图5F)比低表达组缩短。
发生包膜侵犯和脉管侵犯者Piwil2高表达组总生存时间(P=0.003,图5G)和无瘤生存时间(P=0.001,图5H)亦比低表达组短。
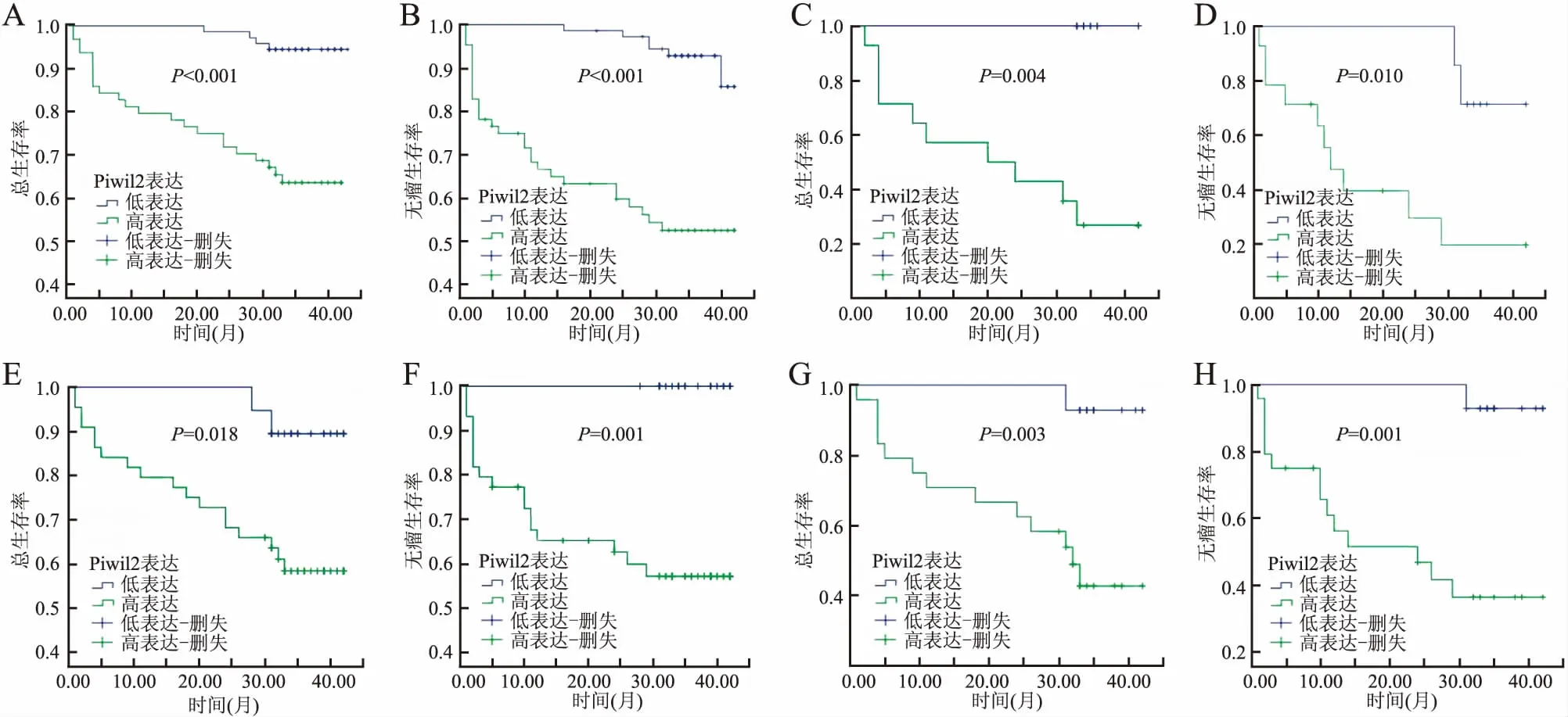
图5 Piwil2表达与肝细胞肝癌患者生存期的关系:A.总生存期;B.无瘤生存期;C.TNM Ⅲ+Ⅳ期患者总生存期;D.TNM Ⅲ+Ⅳ期患者无瘤生存期;E.病理分级Ⅲ+Ⅳ级患者总生存期;F.病理分级Ⅲ+Ⅳ级患者无瘤生存期;G.有包膜和脉管侵犯患者总生存期;H.有包膜和脉管侵犯患者无瘤生存期
2.4 HCC患者预后的Cox单因素和多因素分析将各临床因素进行Cox单因素回归分析发现,HBsAg(P=0.035)、肿瘤直径(P=0.030)、病理分级(P=0.002)、TNM分期(P=0.001)、包膜侵犯(P=0.015)、脉管侵犯(P=0.008)、Piwil2表达(P<0.001)是影响患者术后总生存期的危险因素;TNM分期(P<0.001)、脉管侵犯(P=0.020)、Piwil2表达(P<0.001)是影响患者术后无瘤生存期的危险因素。Cox多因素回归分析发现,TNM分期(P=0.007)、Piwil2表达(P<0.001)是影响HCC患者术后总生存期的独立风险因素;同时TNM分期(P=0.005)、Piwil2表达(P<0.001)也是术后无瘤生存期的独立风险因素(表3、4)。

表3 单因素和多因素Cox回归分析肝细胞肝癌患者术后总生存期的影响因素

表4 单因素和多因素Cox回归分析肝细胞肝癌患者术后无瘤生存期的影响因素
3 讨论
HCC在我国的发生率较高,占原发性肝癌组织学类型的90%,且晚期患者占比较高。近年HCC的诊断与治疗虽取得进展,但由于其高恶性程度、高转移率、高复发率,患者预后仍不能令人满意[5]。Piwi蛋白首先在果蝇的生殖细胞中被人们发现。Piwil2属于Piwi蛋白的一个亚型,有PAZ和Piwi两个保守的结构域,在生殖细胞的维持中发挥作用,且在癌症干细胞中显著表达[6],并可通过RNA干扰和miRNA对目标mRNA的降解作用参与染色质修饰和抑制相关基因的表达,在肿瘤进程中发挥癌基因的作用,还可促进肿瘤细胞的细胞周期和增殖,通过调节参与细胞生长、代谢、凋亡和致癌作用的众多基因的表达来促进恶性转化和癌症进展[7-8]。已有研究证明Piwil2在多种肿瘤组织中表达异常[4],且其表达与肿瘤的发生发展、侵袭转移、复发预后密切相关。但是Piwil2在HCC中的表达情况研究较少,尚未见Piwil2表达与HCC临床病理特征及预后之间的研究报道。
Wang等[9]发现Piwil2在癌旁非瘤组织、结肠腺瘤、结肠癌中的阳性率呈上升趋势。Feng等[10]研究发现Piwil2在子宫颈癌组织中的阳性率明显高于正常子宫颈上皮组织,并且证实Piwil2在诱导体细胞恶性转化中起重要作用。本实验采用组织芯片技术和免疫组化法检测163例HCC组织和对应癌旁非瘤组织中Piwil2的表达,发现Piwil2在HCC组织中的表达水平明显高于癌旁非瘤组织,提示Piwil2可能参与早期HCC的恶性转化过程。Sarvestani等[11]发现Piwil2在乳腺癌中高表达,且其表达与肿瘤浸润深度、TNM分期、病理分级和淋巴结转移有关。Yang等[12]的研究发现在前列腺癌中Piwil2高表达,敲低PC-3细胞中Piwil2的表达,显著降低了PC-3细胞的侵袭和转移能力。本组实验发现异常表达的Piwil2主要定位于细胞质,在分化程度低、TNM分期晚的患者中Piwil2表达增高;有包膜侵犯和脉管侵犯的患者中Piwil2表达水平高于无侵犯者。提示Piwil2高表达促进肿瘤细胞的增殖与浸润,参与HCC的侵袭和转移过程。
有研究发现Piwil2表达与多种肿瘤预后相关,Piwil2高表达是神经胶质瘤[13]和膀胱尿路上皮癌[14]患者预后不良的重要决定因素,但是Li等[15]在胰腺癌中的研究发现Piwil2高表达患者的总体生存期较长,其高表达反而提示患者预后良好。由此可见,Piwil2对不同类型癌症患者预后的影响存在差异。本组Kaplan-Meier生存分析显示,Piwil2高表达HCC患者的总生存时间和无瘤生存时间比低表达者短,提示Piwil2高表达预示患者预后不良。此外,本组还对病理分级Ⅲ+Ⅳ级、TNM分期Ⅲ+Ⅳ期、有包膜侵犯和脉管侵犯的患者进行了生存分析,发现Piwil2高表达患者的总生存时间和无瘤生存时间均短于低表达患者。进一步提示Piwil2表达是影响HCC患者预后的重要因素。邓鑫[16]研究发现Piwil2高表达可激活PI3K/AKT通路,促进癌细胞增殖;还可激活TGF-β/Smad通路,促进肿瘤侵袭转移,这或许导致了HCC患者术后的高复发与较差的预后。通过Cox回归模型分析发现,Piwil2表达、TNM分期是影响HCC患者术后总生存期和无瘤生存期的独立影响因素。以上结果表明,Piwil2与HCC患者预后显著相关,其高表达提示患者预后不良。因此检测其表达对HCC患者的诊疗有重要临床意义。
综上所述,本实验发现Piwil2在HCC中的表达明显增高,表明Piwil2与HCC的发生、发展有一定关联;其表达与临床病理特征和患者预后之间的关系,表明其在HCC的侵袭、转移机制中发挥作用并可能由此影响患者预后。在以后的工作中,作者将采用细胞系及荷瘤动物继续深入探讨Piwil2在HCC发生、发展中的具体作用机制,为HCC的临床治疗和预后判断提供新指标。

