8例成人噬血细胞综合征临床分析
邹文婷,青胜兰,张 娜,阳 毅
德阳市人民医院血液科,四川 德阳 618000
噬血细胞综合征(hemophagocytic syndrome,HPS),又称噬血细胞性淋巴组织细胞增多症(HLH),是一组多种致病因素导致活化的淋巴细胞和组织细胞增生,分泌大量炎症性细胞因子所引起的多器官高炎症反应综合征[1]。目前认为HPS的发病机制主要是免疫调节障碍或免疫失衡,使T细胞和单核-巨噬细胞过度分泌淋巴细胞因子、单核细胞因子,炎症细胞因子形成瀑布式发展[2],高度激活巨噬细胞使其噬血能力增强,以及炎症因子抑制造血祖细胞增殖,导致全血细胞的减少。临床表现以持续发热、肝脏及脾脏肿大、全血细胞减少及出血等为特征,可引起全身严重感染、出血、急性肝肾衰竭等,该病起病急、病情重、致死率极高[3-4]。本研究是对德阳市人民医院过去2 年的8例噬血细胞综合征患者进行回顾性分析,具体报告如下。
1 资料与方法
1.1 一般资料
8 例患者来源于2017 年1 月—2019 年9 月德阳市人民医院血液科初诊的资料完整的HPS 患者,7 男1 女,患者平均年龄(46.13±16.65)岁。其中淋巴瘤3 例,实体肿瘤1例,感染4例。
1.2 诊断标准
根据HPS-2004[5]诊断标准,经分子生物学检查明确存在HPS 遗传学缺陷或者以下指标8 条中符合5 条即可诊断为HPS:(1)发热,持续>7 d,体温>38.5 ℃;(2)脾脏肿大(肋缘下≥3 cm);(3)血细胞减少(累及外周血两系或三系),血红蛋白<90 g/L,中性粒细胞绝对值<1.0×109/L,血小板<100×109/L;(4)高甘油三酯血症和(或)低纤维蛋白原血症:甘油三酯>3 mmol/L,纤维蛋白原<1.5 g/L;(5)骨髓检查/活检或脾、淋巴结、皮肤穿刺/活检发现噬血细胞,无恶性病证据;(6)自然杀伤细胞(NK)活性降低或完全缺少;(7)血清铁蛋白增高(≥500 μg/L);(8)sCD25(可溶性白细胞介素-2受体)升高(≥2 400 U/mL)。
1.3 方法
通过B 超或CT 了解患者肝、脾、淋巴结肿大;血常规、肝功、肾功、凝血功能、乳酸脱氢酶、血清铁蛋白、血脂、骨髓细胞学检查或骨髓活检、EB 病毒、可溶性CD25、NK细胞活性检测等实验室检查辅助诊断。
2 结果
2.1 病因分析
8 例HPS 患者中淋巴瘤3 例(NK/T 细胞淋巴瘤2 例,外周T细胞淋巴瘤1例),实体肿瘤1例(直肠癌1例),感染4例(EB病毒感染2例,食道真菌感染1例,肺部感染1例)。
2.2 临床表现
8 例HPS 患者均有发热(100%)表现,最高温在39 ℃~41 ℃之间,其中3 例反复3~6 月之久,多种抗生素治疗无效;其次为淋巴结肿大(50%)、肝脾肿大(50%)。
2.3 实验室检查
8 例HPS 患者中全部有白细胞减低(100%)、血小板降低(100%)、铁蛋白升高(100%),大部分有贫血(75%),其次还有乳酸脱氢酶升高(87.5%)、甘油三酯升高(75%)、纤维蛋白原降低(37.5%)的表现,另外87.5%患者存在可溶性CD25升高、75%伴NK细胞活性降低,见表1。
2.4 感染、肿瘤相关2组HPS的实验室检查比较
比较病因,感染相关和肿瘤相关HPS 组得知,2 组HPS 患者发病时WBC、 PLT、LDH、TG、FBG 的差异均无统计学意义(P>0.05)。HB、Ferr 有统计学意义(P<0.05)。 可见肿瘤相关HPS 组的HB、Ferr水平明显高于感染相关性HPS 组(P<0.05),见表2。
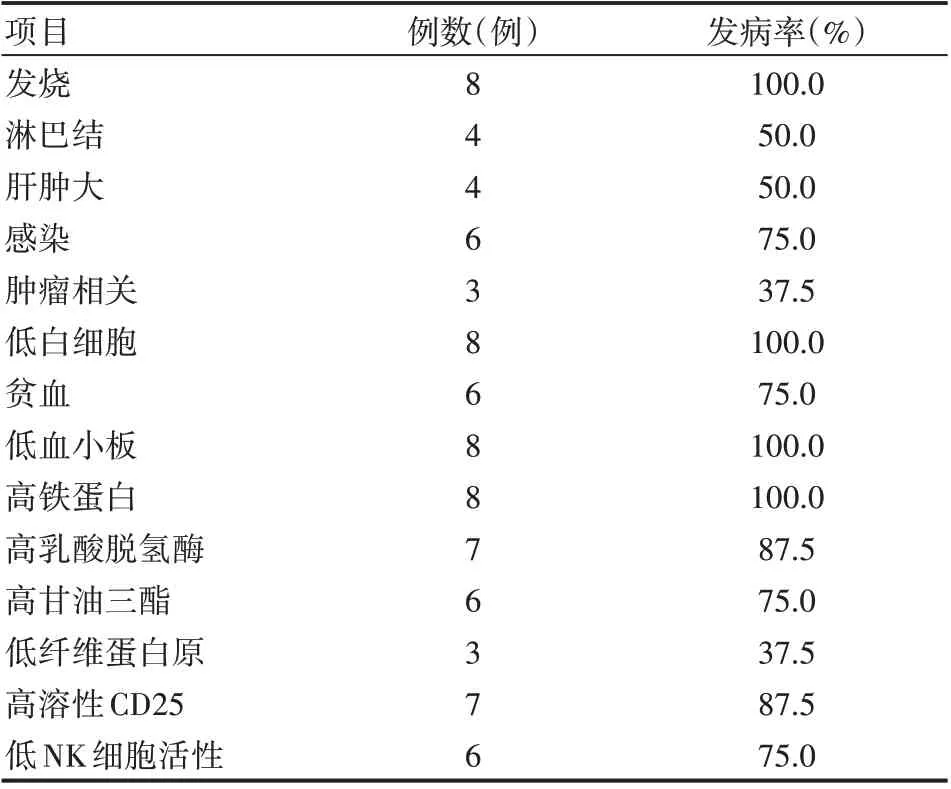
表1 8例HPS患者临床表现及实验室检查
2.5 EB 病毒感染与非EB 病毒感染2 组HPS 的实验室指标比较
2PLT、Ferr、LDH、TG、FBG 的差异均无统计学意义(P>0.05),见表3。
2.6 转归
8例HPS患者的转归情况:死亡6例(75%),好转或治愈2 例(25%)。比较死亡和生存组患者WBC、HB、PLT、LDH、TG、FBG 的差异均无统计学意义(P>0.05),Ferr有统计学意义(P<0.05),见表4。
3 讨论
噬血细胞综合征(HPS)是一组临床综合征,表现为高炎症因子的“炎症风暴”。其根据病因不同分为原发性和继发性两类:原发性噬血细胞综合征(familial hemophagocytic lymphohistiocytosis,FHL)是指具有分子遗传学异常的一大类,常见于儿童,目前已经明确的有5 个亚型,分别累及9q 21.3~22(FHL一型)、 穿孔素基因突变(FHL二型)、UNC13D 基因突变(FHL 三型)、STX11 基因突变(FHL 四型)及STXBP2(又称Munc18-2)基因突变(FHL 五型)[6-12]。继发性噬血细胞综合征(secondary hemophagocytic lymphohistiocytosis,sHLH)可由感染(细菌、真菌、病毒等)、恶性肿瘤、自身免疫性疾病等[13]引起机体的免疫系统失衡,导致大量的细胞因子释放,由此带来的一系列临床表现[14]。
表2 感染、肿瘤相关2组HPS的实验室检查比较(±s)
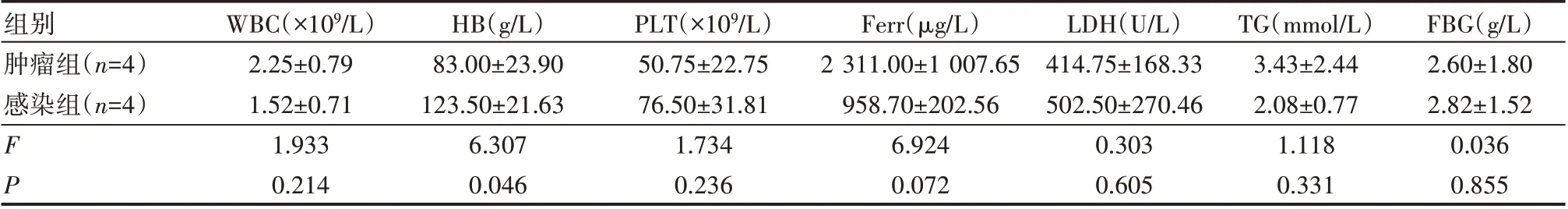
表2 感染、肿瘤相关2组HPS的实验室检查比较(±s)
组别肿瘤组(n=4)感染组(n=4)FP WBC(×109/L)2.25±0.79 1.52±0.71 1.933 0.214 HB(g/L)83.00±23.90 123.50±21.63 6.307 0.046 PLT(×109/L)50.75±22.75 76.50±31.81 1.734 0.236 Ferr(μg/L)2 311.00±1 007.65 958.70±202.56 6.924 0.072 LDH(U/L)414.75±168.33 502.50±270.46 0.303 0.605 TG(mmol/L)3.43±2.44 2.08±0.77 1.118 0.331 FBG(g/L)2.60±1.80 2.82±1.52 0.036 0.855
表3 EB病毒感染与非EB病毒感染2组实验室检查比较(±s)
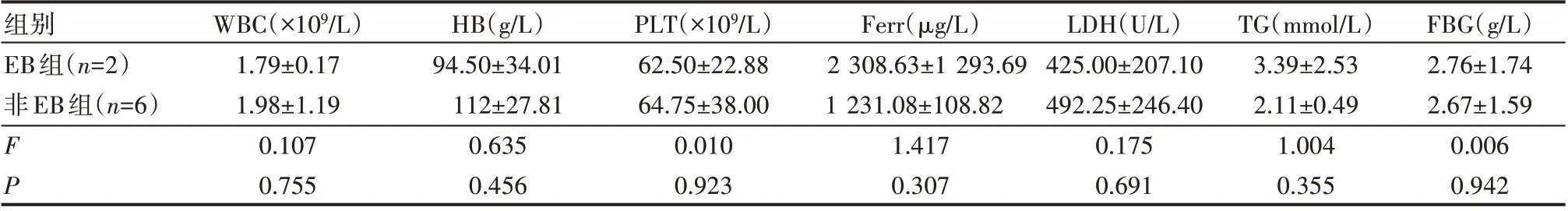
表3 EB病毒感染与非EB病毒感染2组实验室检查比较(±s)
组别EB组(n=2)非EB组(n=6)FP WBC(×109/L)1.79±0.17 1.98±1.19 0.107 0.755 HB(g/L)94.50±34.01 112±27.81 0.635 0.456 PLT(×109/L)62.50±22.88 64.75±38.00 0.010 0.923 Ferr(μg/L)2 308.63±1 293.69 1 231.08±108.82 1.417 0.307 LDH(U/L)425.00±207.10 492.25±246.40 0.175 0.691 TG(mmol/L)3.39±2.53 2.11±0.49 1.004 0.355 FBG(g/L)2.76±1.74 2.67±1.59 0.006 0.942
表4 死亡组和生存组HPS实验室检查比较(±s)

表4 死亡组和生存组HPS实验室检查比较(±s)
Groups死亡组(n=6)生存组(n=2)FP WBC(×109/L)2.12±0.66 1.19±0.99 0.626 0.171 HB(g/L)90.67±22.59 141.00±7.07 1.448 0.125 PLT(×109/L)53.50±25.34 94.00±15.56 1.433 0.084 Ferr(μg/L)1 895.58±1 017.24 852.65±145.45 5.523 0.019 LDH(U/L)521.33±212.102 270.50±23.34 5.055 0.164 TG(mmol/L)3.14±1.98 1.58±0.02 1.657 0.332 FBG(g/L)2.55±1.73 3.20±1.07 1.063 0.643
而临床上以继发性噬血细胞综合征多见。本研究中8例HPS患者均为继发性噬血细胞综合征,其中感染相关占50%,肿瘤相关占50%,而其中EB 病毒感染相关的又占50%,与文献报道相符[15-16]。sHLH 的患者因EB 病毒感染发病率之高,且病预后差,死率高,本研究中6 例死亡的患者2 例感染了EB 病毒,但国内外文献对此报道并非一致[17]。追其发病机制可能为EBV 感染的B 细胞诱导细胞毒性T 细胞的增殖和巨噬细胞的激活,导致不受控制的免疫激活和诱导高细胞因子血症[18]。另一份报道表明,EB病毒通过CD21 靶向感染CD8+T 或NK 细胞引起广泛的淋巴组织细胞活化[19],导致细胞因子不受控制的产生。故死亡风险随之升高。
HPS-2004 诊断标准中涵盖了HPS 的主要临床表现:包括发热、肝脾淋巴结肿大、黄疸、出血等,实验室检查两系或两系以上血细胞减少、甘油三酯升高、纤维蛋白原降低、血清铁蛋白升高、凝血功能异常、乳酸脱氢酶增高、sCD25升高、自然杀伤细胞(NK)活性降低或完全缺少以及骨髓中可见噬血现象。本研究中8 例患者100%的发热表现,所以对于不明原因持续高热(体温>39℃)且抗生素治疗无效,合并肝脾淋巴结肿大、血细胞减少的患者应高度警惕HPS。本研究中的另外两项实验室检查:NK 细胞活性和CD25可作为HPS早期诊断敏感指标[20]。CD25是一种敏感的生物标志物,反映了T 细胞的活化程度,且在HPS 中有较高的水平,因此积极地分析CD25 水平对HPS治疗反应的评估很有用的[21]。
本研究还发现,HPS 死亡组患者的铁蛋白水平明显高于存活组患者,提示铁蛋白可能是HPS 的不良预后因素,与文献报道一致[22]。而血清铁蛋白则是目前被公认的与噬血细胞综合征诊断密切相关并且可以监测病情变化及了解预后的指标,刘潇潇等人的研究表明铁蛋白的显著升高(SF>500 μg/L)是重症HPS 的主要特点,其水平越高、病情恢复越慢,提示病情越重[23]。有研究[24]表明噬血细胞综合征患者铁蛋白的水平显著升高可能与多因素有关:(1)红细胞被大量活化的巨噬细胞吞噬并溶解,使释放出的血红蛋白进一步降解,而作为血红蛋白的降解产物之一的Fe2+ 亦参与了铁蛋白的合成;(2)过度的炎症反应致使全身多处组织损伤,受损的组织细胞中的铁蛋白释放到血液循环中;(3)炎症因子IL-1 有促使由转铁蛋白结合态转化成铁蛋白结合态的作用;(4)炎性反应导致铁蛋白受体表达降低,从而血清中铁蛋白不能顺利清除。综合以上多种因素共同作用使血清铁蛋白水平升高。所以铁蛋白升高可以作为判断HPS预后的指标之一。
综上所述,噬血细胞综合征是一种多因素,具有复杂发病机制及多样临床表现的一组综合征,发热、肝脾淋巴结肿大、血细胞减少为主要表现,低纤维蛋白原、甘油三酯升高、铁蛋白及乳酸脱氢酶明显升高可作为确诊的有力佐证。该病病情凶险、预后不良、病死率高,常引起多器官衰竭,临床上难以判断,易误诊。故需对提高对HPS的认识,早诊断、早治疗以提高生存率。

