口腔鳞状细胞癌外周血、癌组织及癌旁组织中CD4+T、CD8+T淋巴细胞上TIM-3的表达及临床意义
闫秋杰,南丽君,赵芳源,李俊冉,张媛媛
(郑州大学第一附属医院 口腔科,河南 郑州 450052)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一,全球每年新发病例约35万例[1]。虽然近年来OSCC的诊断方法及综合治疗不断改进,但OSCC的5 a生存率仍仅为50%左右[2]。T淋巴细胞介导的细胞免疫在抗肿瘤反应中发挥核心作用。负性共刺激分子常位于T淋巴细胞或肿瘤细胞表面,在多种肿瘤细胞和免疫细胞上表达上调,使T淋巴细胞功能发生障碍,直接或间接促进肿瘤细胞免疫逃逸,进而导致肿瘤治疗失败。目前,针对免疫检验点PD-1单克隆抗体已被批准用于治疗OSCC在内的头颈部鳞状细胞癌,然而由于患者体内免疫耐受的产生,单一的免疫治疗效果并不理想。故采用联合免疫治疗来控制疾病的进展。有研究报道,T淋巴细胞免疫球蛋白黏蛋白分子-3(T cell immunoglobulin mucin molecule-3,TIM-3)是大多数免疫细胞表面共抑制分子,半乳凝素-9是其配体,两者结合后可以抑制免疫应答,从而促进肿瘤的发生[3]。已在多种肿瘤中发现TIM-3在免疫调节中发挥关键作用。然而,TIM-3表达在OSCC中的生物学和临床价值尚未得到系统的阐明。本研究观察OSCC患者外周血、癌组织及癌旁组织中T淋巴细胞上TIM-3的表达情况,并分析其临床意义,旨在探讨TIM-3与疾病的关系,为OSCC的免疫靶向治疗提供理论基础。
1 资料与方法
1.1 一般资料选取2018年4月至2019年10月郑州大学第一附属医院收治的41例OSCC患者作为OSCC组,其中男25例,女16例,年龄36~87岁,平均(61.24±12.91)岁。选取同时期在郑州大学第一附属医院接受体检的20例健康体检者作为对照组,其中男13例,女7例,年龄37~83岁,平均(59.00±11.17)岁。两组性别、年龄比较,差异无统计学意义(P>0.05)。受试者知晓本研究内容并签署同意书。本研究经郑州大学第一附属医院医学伦理委员会批准。
1.2 入组标准(1)选取标准:①首次诊断为OSCC,且经病理HE染色确诊;②临床病理资料完整。(2)排除标准:①既往放化疗及免疫治疗史;②非原发肿瘤,或合并其他肿瘤;③伴有其他的口腔黏膜病,如口腔白斑、口腔扁平苔藓等;④合并其他系统性疾病。
1.3 标本采集与制备清晨空腹状态下采集受试者2 mL外周静脉血,置于肝素抗凝管内,2 h内上机检测。收集手术切除的OSCC组织以及癌旁2 cm以上的正常组织标本(苏木精-伊红染色证实无肿瘤细胞)。样本制备:取部分癌组织和对应癌旁组织在无菌操作台上剪成约1 mm3的碎块,分别加入含有链霉素(500 mg·L-1)、青霉素(500 IU·mL-1)及庆大霉素(900 IU·mL-1)的培养液内,并放入消化酶混合液中(体积分数为2%的胎牛血清,1 mg·L-1的CollagenaseⅠ、CollagenaseⅣ,25 mg·L-1的脱氧核糖核酸酶)消化30 min,采用100目滤网过滤溶液制备单细胞悬液。
1.4 检测方法流式法检测在CD4+T、CD8+T淋巴细胞上TIM-3的表达。取外周抗凝血、癌组织及癌旁组织单细胞悬液各100 μL分别置于EP管中,然后分别加入荧光标记(抗TIM-3-PE,抗FITC-CD8、抗PerCP-Cy5.5-CD4、抗APC-PD-1)抗体各5 μL至相应流式细胞管中,同型对照组各加入5 μL对应荧光标记的鼠抗人IgG抗体。避光孵育20 min后,于外周血离心管内分别加入1×的红细胞裂解液2 mL,震荡混匀,避光孵育15 min。癌组织和癌旁组织则无需此过程。取2 mL PBS缓冲液重悬洗涤2次,离心,弃上清。采用流式细胞仪BD FACSCantoTMⅡ上机分析。
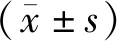
2 结果
2.1 OSCC组和对照组外周血中CD4+T、CD8+T淋巴细胞上TIM-3的表达OSCC组外周血中CD4+T、CD8+T淋巴细胞上TIM-3表达水平[(4.02±0.68)%、(4.22±0.72)%]较对照组[(0.94±0.42)%、(1.24±0.65)%]高(t1=21.683,P1<0.001;t2=16.213,P2<0.001)。见图1。

图1 OSCC组和对照组外周血中CD4+T、CD8+T淋巴细胞上TIM-3的表达水平
2.2 癌组织与癌旁组织中CD4+T、CD8+T淋巴细胞上TIM-3的表达OSCC癌组织中CD4+T、CD8+T淋巴细胞上TIM-3表达水平[(23.03±3.61)%、(24.33 ±3.83)%]较对照组[(10.84±2.03)%、(10.62±1.28)%]高(t1=14.656,P1<0.001;t2=16.624,P2<0.001)。见图2。
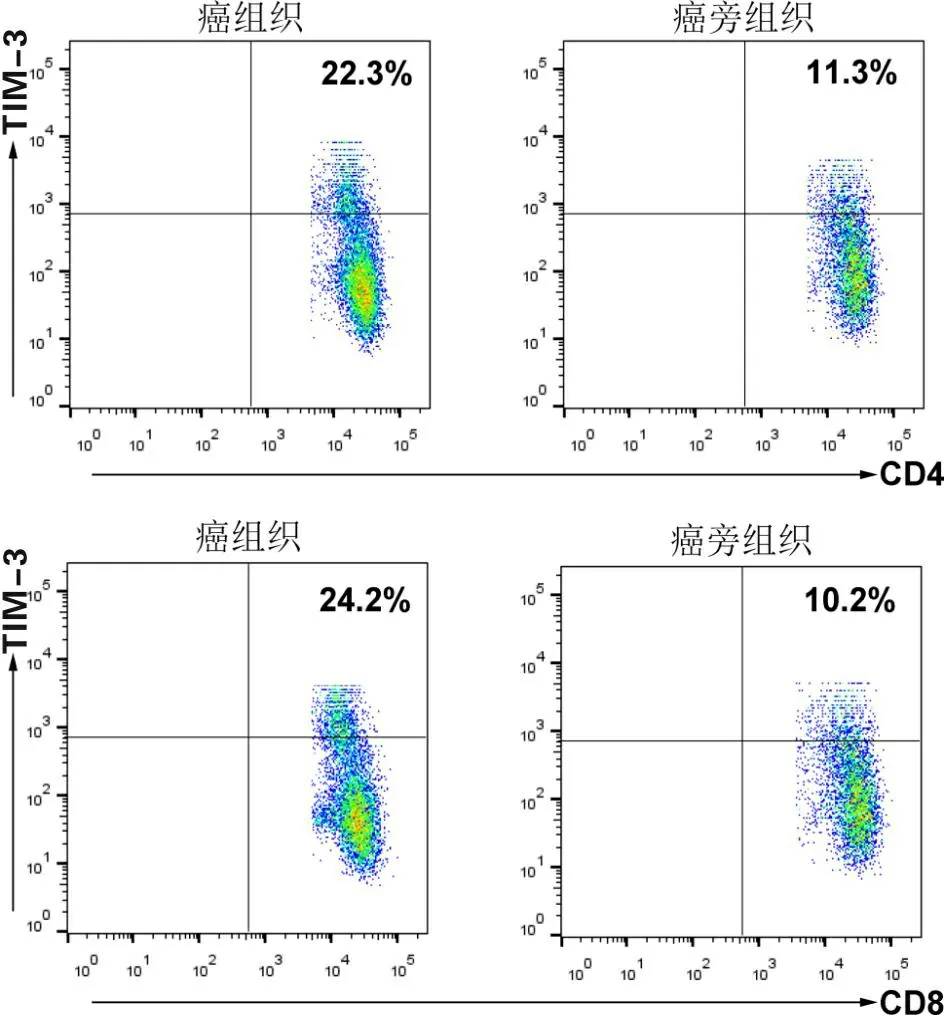
图2 OSCC患者癌组织和癌旁组织中CD4+T、CD8+T淋巴细胞上TIM-3的表达水平
2.3 OSCC患者外周血中CD4+T、CD8+T淋巴细胞上TIM-3表达与临床病理指标的关系有淋巴结转移的OSCC患者外周血中CD4+T、CD8+T淋巴细胞上TIM-3的表达水平高于无淋巴结转移的患者(P<0.05),OSCC患者外周血中CD4+T、CD8+T淋巴细胞上TIM-3的表达水平与年龄、性别、部位、肿瘤大小、病理学分级、TNM分期无关(P>0.05)。见表1、2。

表1 OSCC患者外周血中CD4+T淋巴细胞上TIM-3的表达与临床病理特征的关系

表2 OSCC患者外周血中CD8+T淋巴细胞上TIM-3的表达与临床病理特征的关系
2.4 OSCC患者癌组织中CD4+T、CD8+T淋巴细胞上TIM-3的表达与临床病理指标的关系TIM-3在OSCC患者癌组织中CD4+T、CD8+T淋巴细胞上的表达水平与年龄、性别、部位、肿瘤大小、病理学分级、TNM分期、淋巴结转移无关(P>0.05)。见表3、4。

表3 OSCC患者癌组织中CD4+T淋巴细胞上TIM-3的表达与临床病理特征的关系

表4 OSCC癌组织中CD8+T淋巴细胞上TIM-3的表达与临床病理特征的关系
3 讨论
负性共刺激分子介导的T淋巴细胞功能障碍机制复杂,研究报道单纯抗PD-1/PD-L1治疗有效率低[4]。Shayan等[5]研究显示,应用PD-1阻断剂治疗头颈部肿瘤有效率<20%,这些提示仅阻断PD-1/PD-L1并不能完全恢复T淋巴细胞功能,可能存在多种负调控途径参与抗肿瘤免疫反应。TIM-3是除PD-1之外重要的T淋巴细胞耗竭标志,应用PD-1阻断剂后TIM-3补偿性上调,TIM-3的上调可抑制T淋巴细胞的免疫功能,双重阻断TIM-3和PD-1可以恢复耗竭性T淋巴细胞分泌细胞因子的能力,增强其抗肿瘤效应。TIM-3在CD4+T、CD8+T淋巴细胞上表达上调与各种肿瘤发生发展密切相关,但对TIM-3在OSCC患者CD4+T、CD8+T淋巴细胞上的表达相关研究较少。本研究采用流式细胞术检测OSCC患者外周血、癌组织及癌旁组织中T淋巴细胞上TIM-3表达情况,探讨其与OSCC临床病理特征的关系,为OSCC的免疫靶向治疗提供理论基础。
T淋巴细胞参与适应性免疫应答在肿瘤发生发展中处于核心地位[5]。成熟的T淋巴细胞表面仅表达CD4+或CD8+[6]。CD4+辅助T淋巴细胞在适应性免疫反应的招募、激活和调节多个方面发挥着关键作用。CD8+T淋巴细胞应答的产生依赖于激活的CD4+T淋巴细胞的帮助。CD8+T淋巴细胞能特异性识别MHC-Ⅰ类分子呈递内源性抗原,CD4+T淋巴细胞辅助CD8+T淋巴细胞参与肿瘤免疫反应,进而杀伤肿瘤细胞[7]。研究表明,相比于PD-1,TIM-3更能作为体内T淋巴细胞耗竭的标志物,PD-1-TIM-3+CD8+T淋巴细胞使T淋巴细胞增殖分泌能力降低,而PD-1+TIM-3-CD8+T淋巴细胞与T淋巴细胞功能无明显相关性[8]。本研究发现,OSCC患者外周血CD4+T、CD8+T淋巴细胞上TIM-3表达水平均高于对照组,与结肠癌、骨肉瘤及OSCC体内研究结果[9-11]一致,提示TIM-3在OSCC患者CD4+T、CD8+T淋巴细胞上高表达可能抑制下游信号通路及细胞因子的分泌,致使外周T淋巴细胞功能障碍,导致肿瘤的发生。
此外,本研究发现,OSCC患者癌组织CD4+T、CD8+T淋巴细胞上TIM-3表达水平高于癌旁组织,与徐本玲等[12]研究结果一致,提示宿主与肿瘤之间的免疫反应极其复杂,肿瘤微环境中可能存在诱导其表达的因素,致使CD4+T、CD8+T淋巴细胞出现功能障碍,从而导致肿瘤微环境免疫抑制,促进肿瘤的发生发展。
本研究结果显示,OSCC患者外周血中CD4+T、CD8+T淋巴细胞上TIM-3的表达水平与年龄、性别、部位、肿瘤大小、病理学分级、TNM分期无关,仅与有无淋巴结转移相关,与以往的研究结果[10]一致,表明TIM-3在OSCC的发生发展中起负性调节作用,可能使T淋巴细胞出现功能障碍,耗竭性T淋巴细胞对肿瘤细胞杀伤能力减弱,从而促进肿瘤的发生与进一步转移[13]。Cheng等[14]研究显示胃癌癌组织中CD4+T、CD8+T淋巴细胞上TIM-3的表达水平与淋巴结转移、TNM分期等临床病理特征相关,而本研究中OSCC癌组织中CD4+T、CD8+T淋巴细胞上TIM-3的表达水平与年龄、性别、部位、肿瘤大小、病理学分级、TNM分期、淋巴结转移无关,可能是由于CD4+T、CD8+T淋巴细胞上TIM-3在不同肿瘤间表达存在差异。有研究证实,TIM-3、PD-1在多个肿瘤浸润淋巴细胞及外周血T淋巴细胞上均存在高表达、共表达现象,且与疾病的发生发展有关[15-16]。因此,TIM-3、PD-1在OSCC患者中的表达水平可共同作为判断OSCC患者预后的参考指标和治疗靶点。
综上所述,本研究结果支持TIM-3参与OSCC的免疫逃逸,TIM-3的过表达与OSCC的淋巴结转移有关,可能与OSCC的预后有关。但由于未对患者术后进行长期随访,不能准确分析患者的预后,这也将是下一步研究的重点。

