铝胁迫下生长调节剂对杉木幼苗生长及光合特性的影响
吕蒙蒙, 武忆寒, 马志慧, 陈 宇, 林思祖
(1.福建农林大学林学院,福建 福州350002;2.国家林业和草原局杉木工程技术研究中心,福建 福州350002)
杉木[Cunninghamia lanceolata(Lamb.) Hook]又名沙木、沙树等,属松柏目杉科乔木,为亚热带地区优质速生针叶树种,林业价值高,且分布广[1,2].杉木的主要栽培区遍及我国南方17 个省区,而我国南方土壤以酸性红壤为主,加之工业化发展和人类活动等,导致大面积杉木受到酸雨的侵害,土壤酸化加剧.而土壤酸化往往与铝毒相伴而生,酸性土壤中的固定铝溶出,活性铝不断增加,对植物的生长造成严重的抑制作用.随着杉木人工林的增加,土壤pH 值下降,进一步加剧土壤的铝毒害[3,4].
植物生长调节剂是人工合成的,具有与天然植物激素类似的生长发育调节作用.现已发现具有调控植物生长和发育功能物质有胺鲜酯(DA-6)、氯吡脲、复硝酚钠、生长素、赤霉素、乙烯、细胞分裂素、脱落酸、油菜素内酯、水杨酸、茉莉酸、多效唑和多胺等,在农业生产上,可有效调节作物的生育过程,达到稳产增产、改善品质、增强作物抗逆性等目的[5,6].李婧等[7]通过对栝楼耐铝的研究发现,低浓度脱落酸有利于增强栝楼在铝胁迫下的的抗逆性,缓解铝对栝楼的毒害作用,高浓度脱落酸则表现出抑制作用;张永福等[8]研究发现,水杨酸处理可有效提高铝胁迫下葡萄的光合色素含量以及根系活力,降低其MDA 含量,进而缓解铝毒害.郭天荣等[9]通过喷施适宜浓度的6-KT 可提高铝胁迫下大麦幼苗的抗氧化能力,有效缓解铝对大麦的毒害,并改善植株的生长状况;如果浓度过高,则具有促氧化作用,甚至加剧铝毒造成的氧化胁迫.宋佳琦等[10]发现20 mg·L-16-BA 可提高盛花期苜蓿叶片的光合速率、抗氧化酶活性,减小光合机构的损伤,有利于苜蓿叶片的光合作用,提高苜蓿结荚率及种子产量.
光合作用是一系列复杂代谢反应的总和,是生物界赖以生存的基础.当植物遭遇逆境胁迫时,植物光合作用减弱,可以通过植物受胁迫时的各项指标变化来判定调节作用[11-13].铝对杉木形态、生理等方面的影响已有大量研究,但是植物生长调节剂对铝胁迫杉木生长的影响尚未见报道[14-16].
本研究以杉木实生苗为试验材料,探讨萘乙酸(NAA)、吲哚乙酸(IAA)和6-苄氨基腺嘌呤(6-BA)3种植物生长调节剂对铝胁迫下杉木幼苗生长及光合特性的影响,为进一步改善杉木在酸性土壤中的生长状况提供理论依据.
1 材料与方法
1.1 供试材料
以福建尤溪国有林场提供的杉木三代种子园35 号家系种子为原始材料,经培育后获得长势较一致的实生苗.
1.2 苗木管理
杉木种子用去离子水清洗3 遍后,置于初始温度为45 ℃的超纯水中浸泡24 h,期间用玻璃棒搅动;然后去掉浮于水面的瘪粒和涩粒,用3 g·L-1的KMnO4消毒0.5 h,再用去离子水清洗干净,静置待用.将浸泡好的种子放在滤纸板上,置于25 ℃下光照14 h,22 ℃下暗处理10 h,在光强110 μmol·m-2·s-1、相对湿度75%的气候箱中,萌发15 d 后,挑选长势良好的幼苗移栽至盛有Hoagland-Arnon 营养液(pH 为5.5)的培养框中(温室);在25 ℃下12 h 光照、12 000 lx 光照强度下培养,每7 d 更换1 次营养液;水培30 d 后选取长势一致的幼苗[17].胁迫开始后pH 均为4.5,分别在10、20、30 d 采样,测定各项指标.
1.3 试验处理
采用单因素试验[18],选择NAA、IAA、6-BA 3 种生长调节剂,并各设置3 个处理:NAA 含量分别为20、60、100 mg·L-1;IAA 含量分别为10、30、50 mg·L-1;6-BA 含量分别为10、30、50 mg·L-1.铝浓度均为1 mmol·L-1(铝源为AlCl3·6H2O).设置两个对照:无Al3+、pH 4.5 的Hoagland-Arnon 营养液(CK);有Al3+、pH 4.5 的Hoagland-Arnon 营养液(CK(AL)).
1.4 指标测定
1.4.1 生长指标测定 在处理30 d 时分别测定杉木幼苗的根伸长量和根冠比[19,20].
根伸长量测定:处理前,每个处理选10 株苗,做好标记,用尺子测量根尖到根基部的长度L0;试验结束前测量长度L30,根伸长量=L30-L0.根冠比=地下部分/地上部分鲜重.
1.4.2 光合参数测定 每3 株叶片为1 个重复,共计3 个重复,测定时间为9:00—11:00.采用LI-6400/XT便携式光合仪测定其光合速率(photosynthetic rate, Pn)、气孔导度(stomatal conductance, Cs)、胞间二氧化碳浓度(intercellular carbon dioxide concentration, Ci)、蒸腾速率(transpiration rate, Tr)等光合指标[21].
1.4.3 光合色素含量测定 采用丙酮乙醇法测定光合色素含量[22].称取0.05 g 杉木叶片放入5 mL 离心管,在液氮中冷冻10 min,用高通量研磨仪研磨成粉,加入体积比为1 ∶1 的3 mL 丙酮与无水乙醇配成的提取液,于4 000 r·min-1转速的离心机离心5 min,在645、663、470 nm 测定光密度.
1.5 数据分析
采用SPSS 17.0 进行单因素方差分析,采用WPS 2019 软件作图.
2 结果与分析
2.1 生长调节剂对铝胁迫下杉木幼苗生长的影响
2.1.1 生长调节剂对铝胁迫下杉木幼苗根长的影响 由图1 可知,与CK 相比,CK(AL)处理下的根伸长量明显下降,表明铝胁迫抑制了根的生长.与CK(AL)相比,不同生长调节剂处理下的根伸长量总体上明显提高,表明生长调节剂在一定程度上促进了根的生长,20 mg·L-1NAA、30 mg·L-1IAA 和10 mg·L-16-BA 处理的根长分别提高了90.1%、203.8%、89.3%.
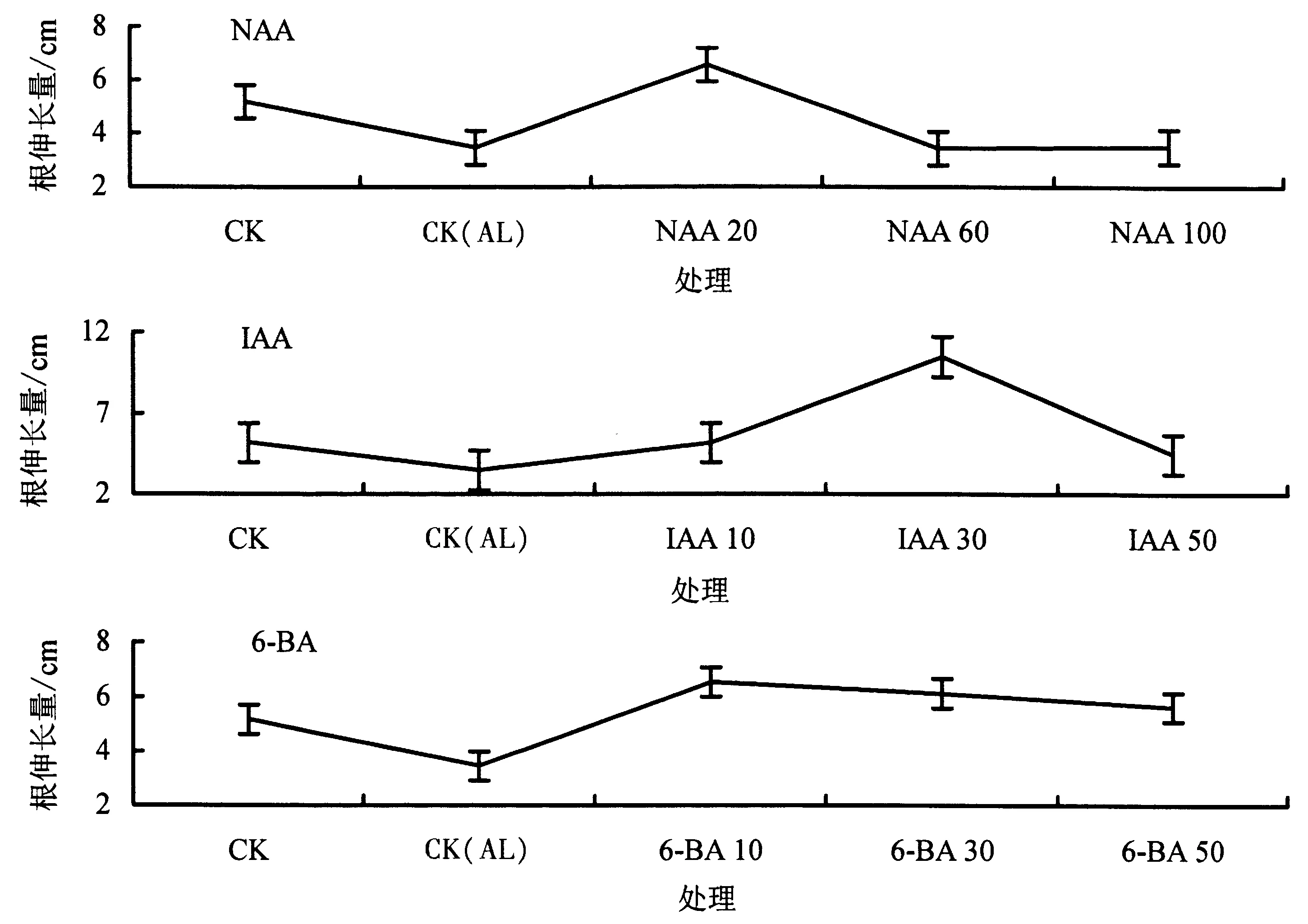
图1 不同生长调节剂对铝胁迫下杉木幼苗根伸长量的影响Fig.1 Effects of different growth regulators on root elongation length of Chinese fir under Al stress
2.1.2 生长调节剂对铝胁迫下杉木幼苗根冠比的影响 由图2 可知,与CK 相比,CK(AL)处理下的根冠比明显降低.与CK(AL)相比,不同生长调节剂处理下的根冠比总体上得到明显提高,20 mg·L-1NAA、30 mg·L-1IAA 和50 mg·L-16-BA 处理的根长分别提高了20.7%、15.6%、13.2%.
2.2 生长调节剂对铝胁迫下杉木幼苗光合参数的影响
2.2.1 不同生长调节剂对铝胁迫下杉木幼苗Pn 的影响 由图3 可知,与CK 相比,CK(AL)处理下的Pn明显下降.与CK(AL)相比,胁迫第10 天时,20 mg·L-1NAA、30 mg·L-1IAA、30 mg·L-16-BA 处理的Pn增幅最大,分别提高87.4%、251.3%、82.4%;胁迫第20 天时,100 mg·L-1NAA、50 mg·L-1IAA、10 mg·L-16-BA 处理的Pn 增幅最大,分别提高289.6%、94.1%、296.1%;胁迫第30 天时,60 mg·L-1NAA、50 mg·L-1IAA、30 mg·L-16-BA 处理下的Pn 增幅最大,分别提高47.4%、181.6%、90.5%.
2.2.2 生长调节剂对铝胁迫下杉木幼苗Cs 的影响 由图4 可知,与CK 相比,CK(AL)处理的Cs 在总体上明显下降.与CK(AL)相比,胁迫第10 天时,20 mg·L-1NAA、10 mg·L-1IAA、10 mg·L-16-BA 处理的Cs 增幅最大,分别提高149.0%、20.4%、65.3%;胁迫第20 天时,20 mg·L-1NAA、50 mg·L-1IAA、10 mg·L-16-BA 处理的Cs 增幅最大,分别提高103.2%、67.7%、109.7%;胁迫第30 天时,60 mg·L-1NAA、50 mg·L-1IAA 处理的Cs 分别下降了49.7%、1.2%,而30 mg·L-16-BA 处理下的Cs 提高了0.7%.
2.2.3 生长调节剂对铝胁迫下杉木幼苗Ci 的影响 由图5 可知,与CK 相比,CK(AL)处理的Ci 明显升高.与CK(AL)相比,胁迫第10 天时,100 mg·L-1NAA、30 mg·L-1IAA、30 mg·L-16-BA 处理的Ci 降幅最大,分别降低了29.2%、40.9%、10.1%;胁迫第20 天时,100 mg·L-1NAA、30 mg·L-1IAA、10 mg·L-16-BA 处理的Ci 降幅最大,分别降低了45.8%、17.8%、48.4%;胁迫第30 天时,60 mg·L-1NAA、50 mg·L-1IAA、50 mg·L-16-BA 处理的Ci 降幅最大,分别下降了53.7%、40.9%、39.9%.
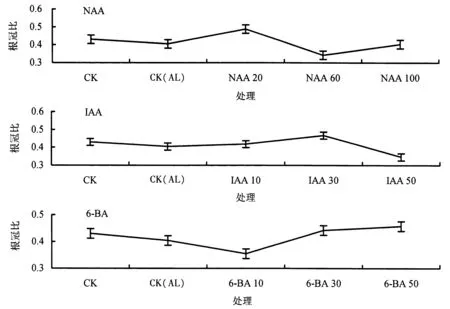
图2 不同生长调节剂对铝胁迫下杉木幼苗根冠比的影响Fig.2 Effects of different growth regulators on root-cap ratio of Chinese fir seedlings under Al stress
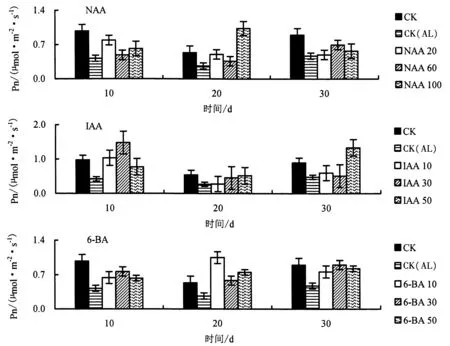
图3 不同生长调节剂对铝胁迫下杉木幼苗Pn 的影响Fig.3 Effects of different growth regulators on photosynthetic rate of Chinese fir seedlings under Al stress
2.2.4 生长调节剂对铝胁迫下杉木幼苗Tr 的影响 由图6 可知,与CK 相比,CK(AL)处理的Tr 总体上明显下降.与CK(AL)相比,胁迫第10 天时,20 mg·L-1NAA、10 mg·L-1IAA、10 mg·L-16-BA 处理的Tr增幅最大,分别提高131.4%、40.7%、82.7%;胁迫第20 天时,100 mg·L-1NAA、50 mg·L-1IAA、10 mg·L-16-BA 处理的Tr 增幅最大,分别提高52.0%、46.3%、77.0%;胁迫第30 天时,3 种生长调节剂处理的Tr 均明显下降,60 mg·L-1NAA、50 mg·L-1IAA、30 mg·L-16-BA 处理下的Tr 分别下降了50.9%、3.8%、0.7%.
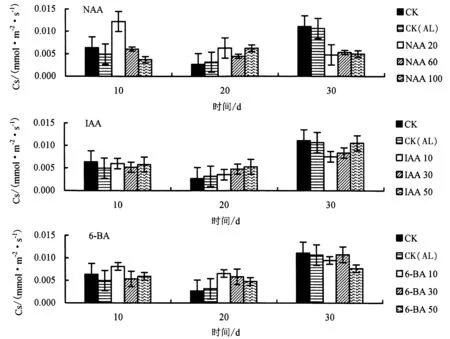
图4 不同生长调节剂对铝胁迫下杉木幼苗Cs 的影响Fig.4 Effects of different growth regulators on stomatal conductance of Chinese fir seedlings under Al stress
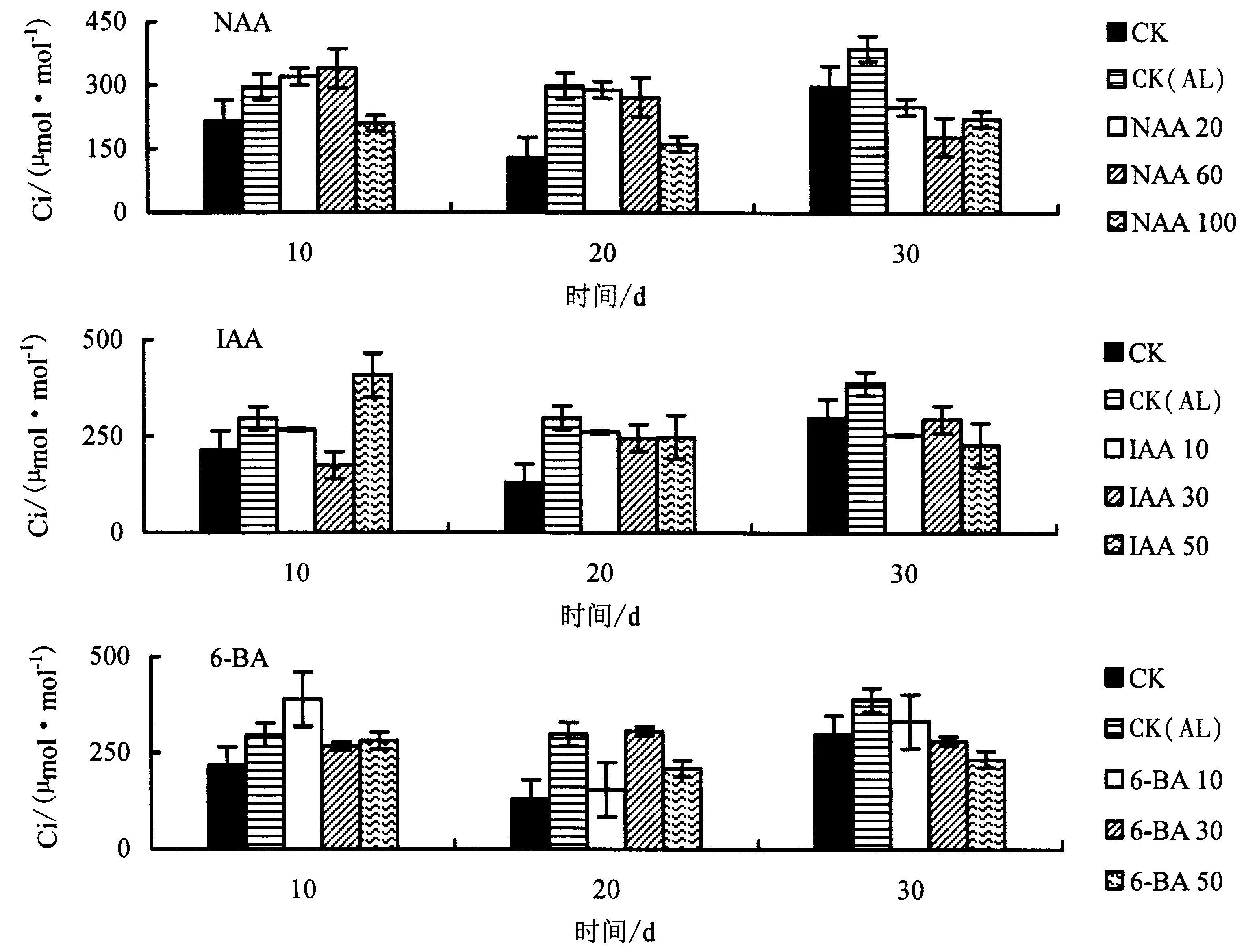
图5 不同生长调节剂对铝胁迫下杉木幼苗Ci 的影响Fig.5 Effects of different growth regulators on intercellular carbon dioxide concentration of Chinese fir seedlings under Al stress
2.3 生长调节剂对铝胁迫下杉木幼苗光合色素的影响
2.3.1 生长调节剂对铝胁迫下杉木幼苗叶绿素a 含量的影响 由图7 可知,与CK 相比,CK(AL)处理的叶绿素a 含量总体上明显降低.与CK(AL)相比,胁迫第10 天时,20 mg·L-1NAA、50 mg·L-1IAA、10 mg·L-16-BA 处理的叶绿素a 含量增幅最高,分别提高了24.3%、12.0%、10.0%;胁迫第20 天时,60 mg·L-1NAA、50 mg·L-1IAA、50 mg·L-16-BA 处理的叶绿素a 含量增幅最高,分别提高了22.1%、8.4%、17.6%;胁迫第30 天时,60 mg·L-1NAA、30 mg·L-1IAA、10 mg·L-16-BA 处理的叶绿素a 含量增幅最高,分别提高了32.2%、22.4%、24.4%.
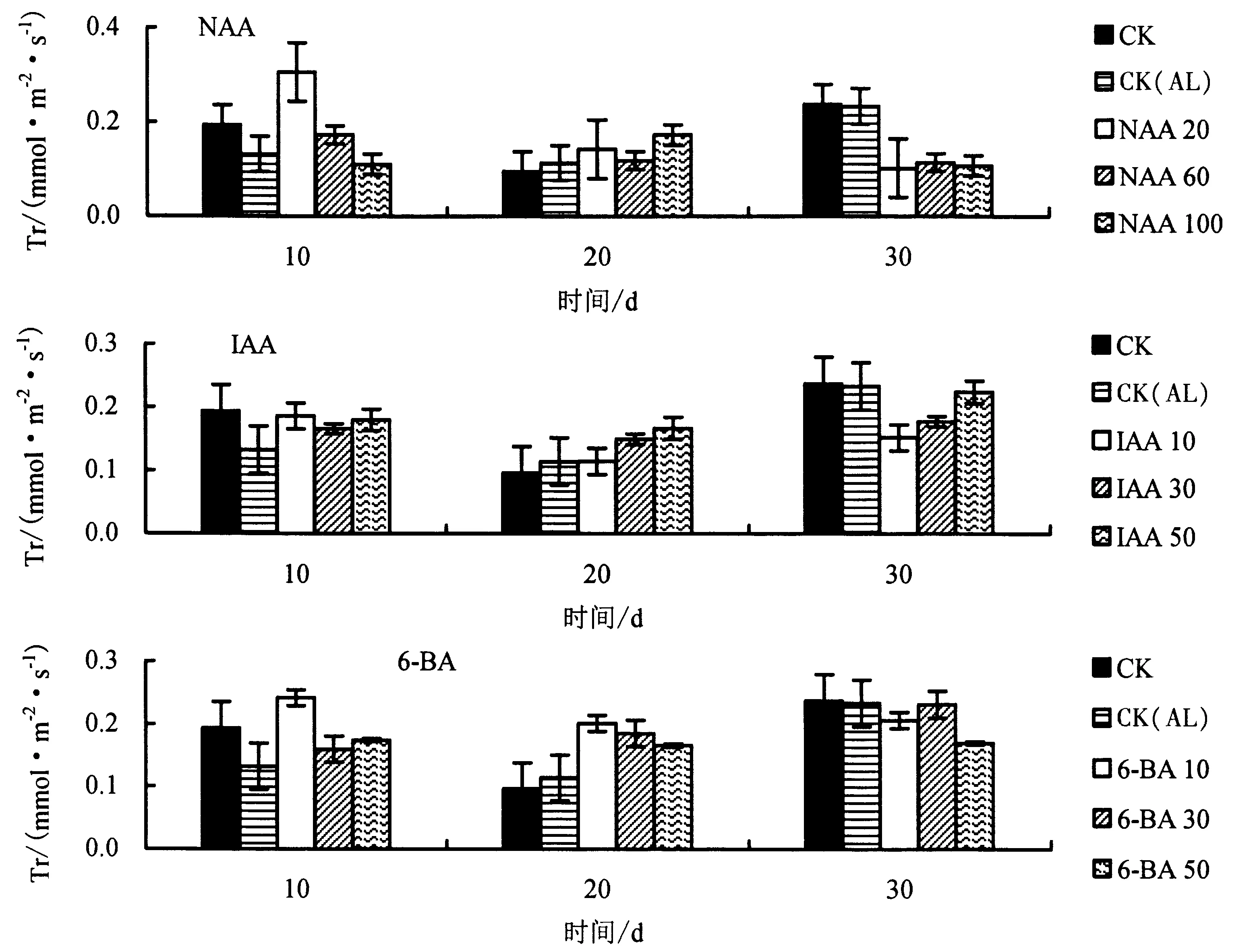
图6 不同生长调节剂对铝胁迫下杉木幼苗Tr 的影响Fig.6 Effects of different growth regulators on transpiration rate of Chinese fir seedlings under Al stress
2.3.2 生长调节剂对铝胁迫下杉木幼苗叶绿素b 含量的影响 由图8 可知,与CK 相比,CK(AL)处理的叶绿素b 含量总体上明显降低.与CK(AL)相比,胁迫第10 天时,20 mg·L-1NAA、50 mg·L-1IAA、10 mg·L-16-BA 处理的叶绿素b 含量增幅最高,分别提高了22.6%、11.4%、8.6%;胁迫第20 天时,60 mg·L-1NAA、50 mg·L-1IAA、10 mg·L-16-BA 处理的叶绿素b 含量增幅最高,分别提高了24.4%、13.4%、25.3%;胁迫第30 天时,60 mg·L-1NAA、30 mg·L-1IAA、10 mg·L-16-BA 处理的叶绿素b 含量增幅最高,分别提高了18.6%、14.1%、16.6%.
2.3.3 生长调节剂对铝胁迫下杉木幼苗叶绿素总含量的影响 由图9 可知,与CK 相比,CK(AL)处理的叶绿素总含量整体上明显降低.与CK(AL)相比,胁迫第10 天时,20 mg·L-1NAA、50 mg·L-1IAA、10 mg·L-16-BA 处理的叶绿素总含量增幅最高,分别提高了23.7%、10.9%、9.2%;胁迫第20 天时,60 mg·L-1NAA、50 mg·L-1IAA、50 mg·L-16-BA 处理的叶绿素总含量增幅最高,分别提高了22.7%、9.8%、18.3%;胁迫第30 天时,60 mg·L-1NAA、30 mg·L-1IAA、10 mg·L-16-BA 处理的叶绿素b 含量增幅最高,分别提高了27.8%、19.8%、21.9%.
2.3.4 生长调节剂对铝胁迫下杉木幼苗类胡萝卜素含量的影响 由图10 可知,与CK 相比,CK(AL)处理的类胡萝卜素含量总体上明显降低,表明铝胁迫在一定程度上抑制了类胡萝卜素的合成.与CK(AL)相比,胁迫第10 天时,20 mg·L-1NAA、50 mg·L-1IAA、10 mg·L-16-BA 处理的类胡萝卜素含量增幅最高,分别提高了24.2%、6.6%、9.3%;胁迫第20 天时,60 mg·L-1NAA、30 mg·L-1IAA、10 mg·L-16-BA 处理的类胡萝卜素含量增幅最高,分别提高了24.3%、12.3%、18.8%;胁迫第30 天时,60 mg·L-1NAA、30 mg·L-1IAA、10 mg·L-16-BA 处理的类胡萝卜素含量增幅最高,分别提高了22.7%、20.0%、22.0%.
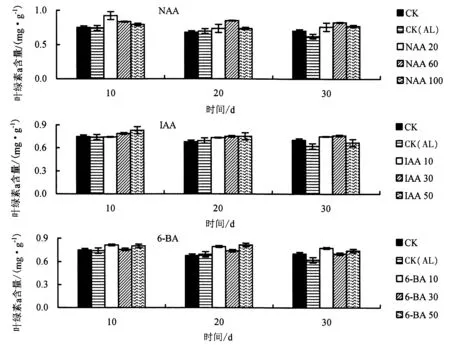
图7 不同生长调节剂对铝胁迫下杉木幼苗叶绿素a 含量的影响Fig.7 Effects of different growth regulators on chlorophyll a content in Chinese fir seedlings under Al stress
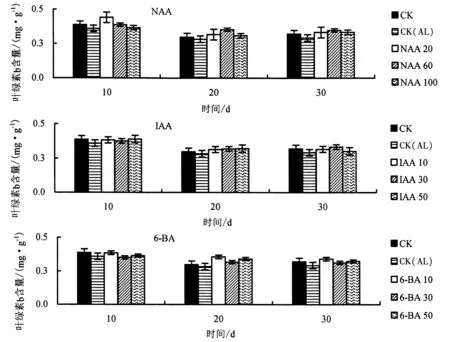
图8 不同生长调节剂对铝胁迫下杉木幼苗叶绿素b 含量的影响Fig.8 Effects of different growth regulators on chlorophyll b content in Chinese fir seedlings under Al stress
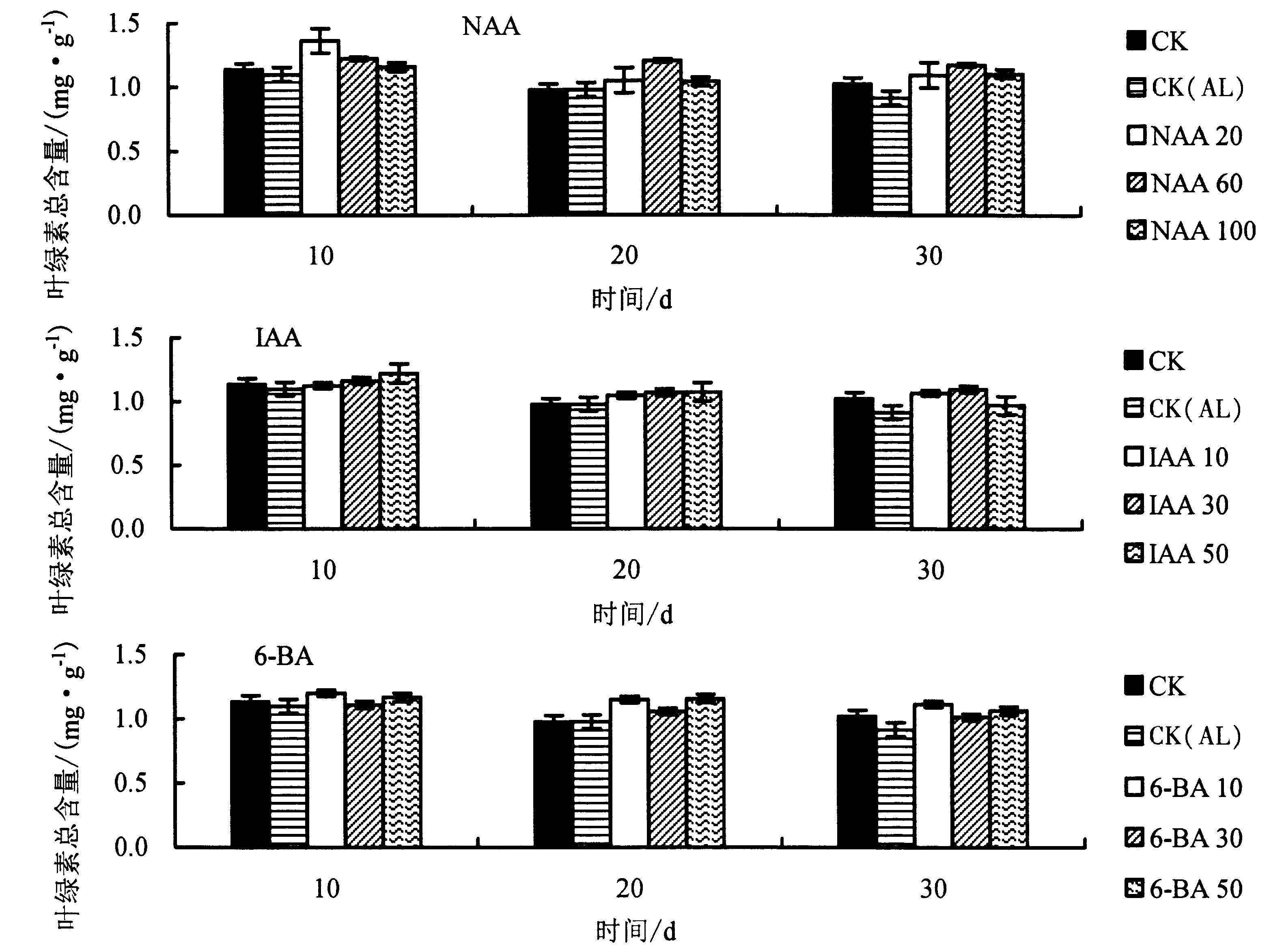
图9 不同生长调节剂对铝胁迫下杉木幼苗叶绿素总含量的影响Fig.9 Effects of different growth regulators on total chlorophyll content of Chinese fir seedlings under Al stress
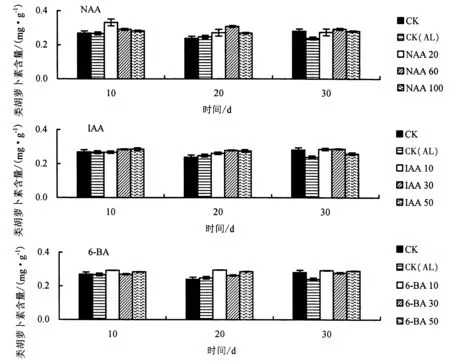
图10 不同生长调节剂对铝胁迫下杉木幼苗类胡萝卜素含量的影响Fig.10 Effects of different growth regulators on the carotenoid content of Chinese fir seedlings under Al stress
3 小结与讨论
一般来说,铝毒害最明显的症状就是抑制根的生长,铝在根尖细胞壁上的积累是铝对植物根尖产生铝毒的先决条件,是植物铝毒敏感性的重要特征.铝胁迫下的根伸长量可以直接地反映植物对铝毒的敏感程度[23].根冠比是指植物地下部分与地上部分的鲜重或干重的比值,它体现了植物地下部分与地上部分的相关性,是反映植物生长状态的指标之一[24].研究[25]表明,油茶在受到铝胁迫时,根系生长受到抑制,影响了营养物质的积累,根冠比下降.徐春明等[26]研究发现,在铝胁迫下番红花根尖生长明显受到抑制,添加1 mmol·L-1多胺可显著改善铝胁迫下番红花的生长状况.王平等[27]也发现,外源添加IAA 可以明显缓解铝胁迫对大豆主根生长的抑制作用,并且能显著促进侧根的发育以及生物量的增加,提高大豆幼苗的主根长、侧根数、侧根长、根冠比和总鲜重.这与本试验结果基本一致.本研究结果表明,与CK 相比CK(AL)处理的根伸长量和根冠比明显下降;铝胁迫抑制了根的生长,3 种生长调节剂总体上提高了铝胁迫下杉木幼苗的根长和根冠比,IAA 和NAA 对提高根伸长量和根冠比的效果最好.
当植物遭遇逆境胁迫时,植物光合作用减弱,可以通过植物受胁迫时的各项指标变化来判定调节作用.研究[28]表明,逆境胁迫下叶片Pn 下降,Ci 提高,非气孔性因素是导致植物光合作用能力下降的主要因素.肖祥希等[29-31]也发现,铝胁迫影响了龙眼的光合作用,导致光合效率降低,非气孔因子成为限制光合作用的主要因子.本试验结果也表明在铝胁迫下杉木幼苗的Pn、Cs 及Tr 均显著下降,而Ci 则显著升高.植物光合作用主要通过光合色素实现,如叶绿素和类胡萝卜素等.叶绿素主要由叶绿素a 和叶绿素b 组成,是植物进行光合作用的主要色素;类胡萝卜素是一类重要的天然色素的总称,能将吸收的光能传递给叶绿素a,是光合作用不可少的光合色素.因此,一般而言植物光合能力的大小与光合色素含量密切相关[32].研究[32]表明,铝胁迫处理显著降低杉木叶片叶绿素和类胡萝卜素含量,表明铝胁迫可使光合色素的合成受阻,从而抑制杉木叶片对光能的吸收和利用,最终降低植物的光合速率.可见,光合色素含量的下降也是导致光合速率下降的主要原因之一,这与本试验中铝胁迫导致叶绿素及类胡萝卜素含量降低基本一致.高培培等[33]研究发现,外源水杨酸(SA)通过提高栝楼的叶绿素含量及光合相关指标来增强栝楼抗铝毒能力.任晓燕等[34]通过喷施IAA 可使铝胁迫下紫花苜蓿叶绿素含量明显提高.孟长军等[35]也发现,外源SA 可使铝胁迫下白苦瓜幼苗的叶绿素含量和净光合速率得到显著提高,对气孔的负面影响也得到显著缓解,以60 umol·L-1SA 效果最佳.练华山等[36]研究发现,适宜浓度的脱落酸ABA 浸种处理能缓解铝胁迫对萝卜幼苗生长的抑制,提高铝胁迫下萝卜幼苗叶片光合色素含量,提高净光合速率、气孔导度和蒸腾速率,增强光合作用,从而缓解缓解铝毒对萝卜的伤害,且以5 umol·L-1效果最佳.本研究中3 种生长调节剂可以有效地提高杉木叶片的Pn、Cs、Tr,以及叶绿素和类胡萝卜素含量,降低Ci,从而缓解铝毒对杉木幼苗光合作用的不良影响[37,38].

