拉曼光谱技术的发展及其在生物医学领域中的应用
郭晓湲,排尔哈提·亚生,刘晨阳,郑炜平,戴鲁筠
(1. 浙江大学医学院,浙江 杭州 310058; 2. 福建省立医院,福建 福州 350001; 3. 浙江大学医学院附属杭州市第一人民医院,浙江 杭州 310058)
0 引言
细胞活动的动态过程涉及各种生物分子(例如蛋白质,核酸和代谢产物)的构象、 分布和相互作用的动态变化. 在生命科学研究中,使各种生化成分显像是了解组织细胞生命活动的关键方法. 传统的显微技术包括光学显微镜明场观察、 相差显微术、 荧光显微术等. 明场观察和相差显微术可无损地观察细胞,但缺乏衬度和特异性; 荧光显微术通过荧光发色团提供化学衬度,但荧光染料可干扰细胞正常代谢甚至杀死细胞.
疾病的发生和发展通常涉及生物分子的过量、 缺乏或功能异常. 监测生物系统内微环境的变化,可以更好地了解细胞生命过程和各种疾病的发病机制,并建立可靠且高度敏感的诊断方法. 而如何非侵入性评估组织的健康状况变得至关重要. 拉曼光谱技术(以下也称为“拉曼”)提供了无标记和非破坏性评估人体中细胞和组织功能的能力,具有对多种疾病辅助诊断的重要价值.
然而,传统拉曼光谱技术存在信号强度低、 荧光干扰强等缺点,应用比较受限. 为克服这些缺点,随之发展了许多新技术,包括表面增强拉曼散射(surface enhanced Raman spectroscopy, SERS)、 相干反斯托克斯拉曼光谱(coherent anti-Stokes Raman spectroscopy, CARS)、 受激拉曼光谱(stimulated Raman spectroscopy, SRS)、 共振拉曼光谱(resonance Raman spectroscopy, RRS)、 空间位移拉曼光谱(spatially offset Raman spectroscopy, SORS)等. 这些新技术的固有特点也使得其在生物医学领域的特定研究中有着独特优势和关键应用. 本研究将简要概述拉曼光谱技术的原理,介绍为了增强和改善自发拉曼光谱信号而后续延伸出的技术,并了解其在生物医学领域中的部分应用.
1 拉曼相关技术发展
1.1 传统拉曼光谱技术

图1 拉曼散射的原理Fig.1 Principle of Raman scattering
1928年,Raman等[1]在一次涉及光学的实验中观察到与原始入射波长不同波长的散射光. 这种现象被称为“拉曼散射”,与瑞利散射不同,拉曼散射是一种非弹性散射, 即散射前后的光波长发生改变,其中波长增加的散射光称为斯托克斯光,波长减少的散射光称为反斯托克斯光. 入射光子和散射光子之间的能量差异对应于激发特定分子振动所需的能量(如图1),对这些散射光子进行检测即可得到拉曼光谱. 不同的波段对应于不同官能团的振动频率. 因此,根据分子的化学键及其特定的振动频率,每个分子都有一个独特的光谱,称之为“指纹”[2].
拉曼光谱的优点之一是能够确定细胞的化学成分,其过程不需要标记或染色,根据细胞内的蛋白质、 脂质和DNA的振动光谱即可对这些物质进行半定量分析,甚至对其在细胞内的分布进行可视化. 然而,自发拉曼散射是一个强度较弱的过程,只有大约1×108个光子发生了非弹性散射[2]. 到了1940年, 拉曼光谱不再受到研究者们的重视,主要是因为拉曼效应太弱(约为入射光强的10-6),研究者难以观测拉曼散射信号, 进而无法测量研究二级以上的高阶拉曼散射效应. 除此之外,要求被测样品的体积必须足够大、 无色、 无尘埃、 无荧光等. 20世纪60年代,红宝石激光器的问世,使得拉曼散射的研究有了很大的进步. 由于激光器具有单色性能好,方向性能强,而且功率密度高等特点,所以用它作为激发光源,很大程度提高了激发效率.
1.2 表面增强拉曼光谱
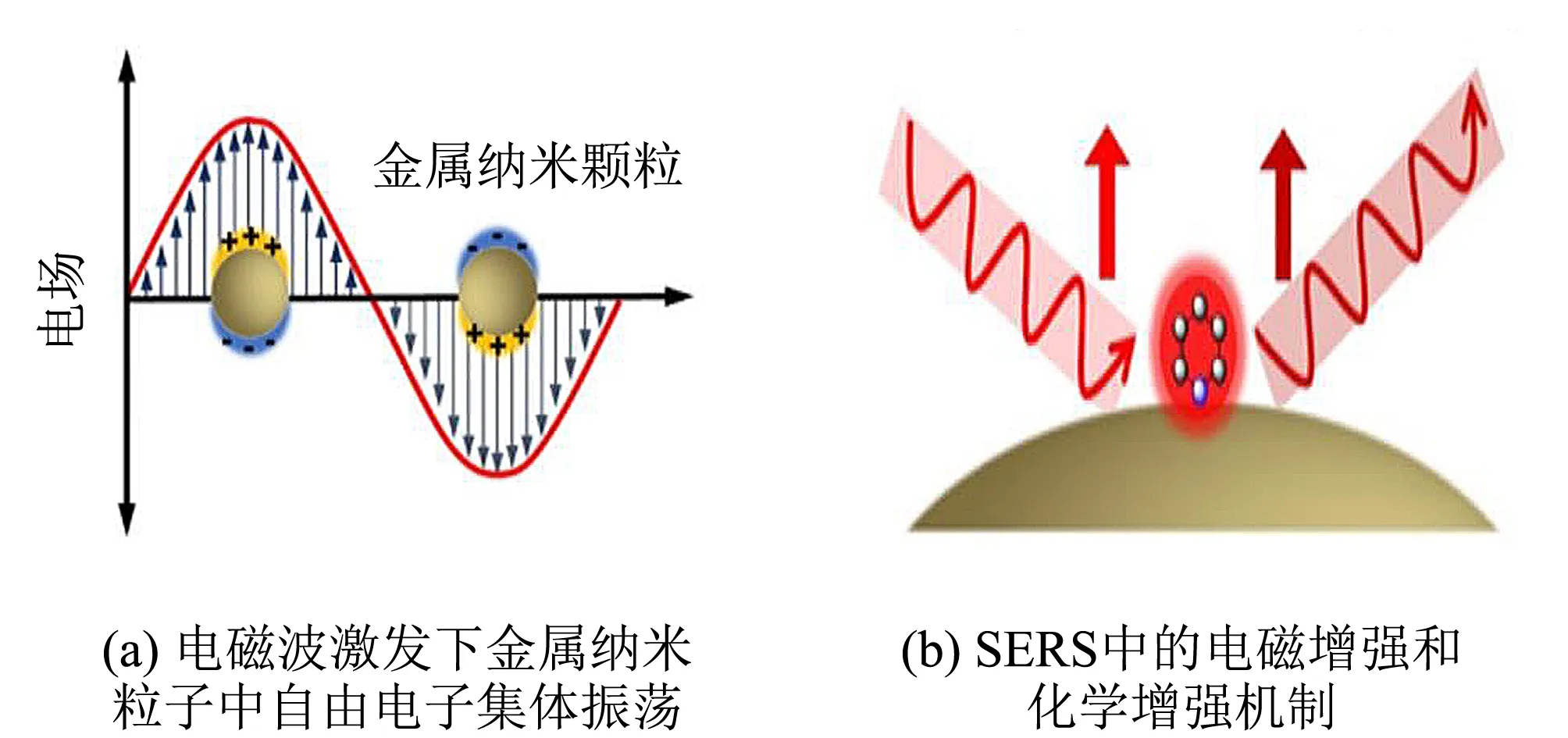
图2 表面增强拉曼光谱的原理[4]Fig.2 Principle of surface enhanced Raman spectroscopy[4]
1974年,Fleischmann等[3]发现吸附在粗糙化处理的银表面上的吡啶分子产生的拉曼光谱信号比预期的强度高几个数量级. 这种增强效应与特殊介质的粗糙表面相关,其对应的光谱技术称为表面增强拉曼光谱(SERS)技术. 常用的介质包括银、 金、 铜等. 近年来,在解释SERS的各种机制中,电磁增强(electromagnetic enhancement,EM)学说和化学增强(chemical enhancement,CM)学说是最为广泛接受的两种学说,如图2所示[4]. 目前较为公认由范迪恩提出的EM机制在SERS增强中起主要作用,可以将拉曼光谱信号增强4~11个数量级[5]. 当入射激光撞击金属和导电界面时,电磁波可以驱动金属纳米颗粒(NP)的离域电子集体振荡. 当入射光的频率与金属中自由电子的固有振荡频率匹配时,就会发生表面等离子共振(SPR). 共振频率取决于粒子的大小、 形状、 导电环境、 粒子的电子密度和有效电子质量等. 在金属纳米结构中,SPR可以高度定位在特定位置,称为局部SPR(LSPR). LSPR将导致入射光的共振吸收或散射. 因此,入射光能可以有效地耦合到金属纳米粒子中,从而导致纳米粒子表面局部电磁场强度提高[6]. CM是由报告分子(具有特征的振动且信号强度高的一类化学物质)和纳米结构之间的电荷转移引起的,需要分子在金属表面上直接吸附或化学结合,并且通常比EM弱[7].
SERS在医学领域应用广泛. 在细胞分子层面上其为DNA,为蛋白质检测提供了新的方法. SERS可以通过等离子体纳米孔检测DNA碱基,为DNA分析和新一代单分子测序平台的新方法铺平道路[8]. 作为一种无标记技术,SERS可快速监测生物基质中低浓度的物质,使其成为对部分治疗窗口狭窄药物的高效实时检测工具[9]. 由多重耐药细菌引起的慢性感染可造成严重后果,对细菌感染性疾病进行监测也是追踪和验证治疗效果的必要条件. 使用SERS不仅可以检测伤口表面细菌生长情况,也可在一定程度起到杀菌或抑菌作用[10].
近年来,SERS标签结合激光拉曼光谱及显微镜技术在光学标记、 显像上展现了独特潜力. SERS标签通常由附着有拉曼报告分子的金属纳米颗粒组成,这些分子发出强烈而独特的拉曼信号. 通过结合特异性识别分子,SERS标签可作为光学标记工具,用于对靶标生物分子的体外、 体内间接检测和成像. 与传统的外部标记试剂(如有机染料、 荧光染料)相比,SERS标签具有超高的灵敏度及高光稳定性,仅需一个激光即可激发所有SERS标签,最大限度地减少了来自细胞和组织的自发荧光[7, 11]. 癌症手术期间无法完全切除肿瘤是致死性复发和转移的主要原因,然而术中准确界定肿瘤边缘非常困难. SERS伪彩色成像系统利用SERS标签可实现无创、 高效的组织分类判别,为外科手术领域带来了新的变革[12].
1.3 相干拉曼散射
相干拉曼散射(coherent Raman scattering, CRS)是一种通过非线性光学过程诱导产生相干光的效应,该过程中目标分子特定的振动可作为成像所需的衬度,由此产生了一种新的光学显微成像方法,即相干拉曼散射显微术. 相较于自发拉曼散射,相干拉曼散射光谱比自发拉曼光谱至少强3个数量级[13],成像速度提高3~4个数量级. CRS技术通常使用高峰值功率、 高重复频率的近红外光作为激发光,生物样品的吸收和散射较小,因而其对细胞的损伤也较低. 相干拉曼散射主要有相干反斯托克斯拉曼散射(CARS)和受激拉曼散射(SRS)两种,能级变化如图3所示.
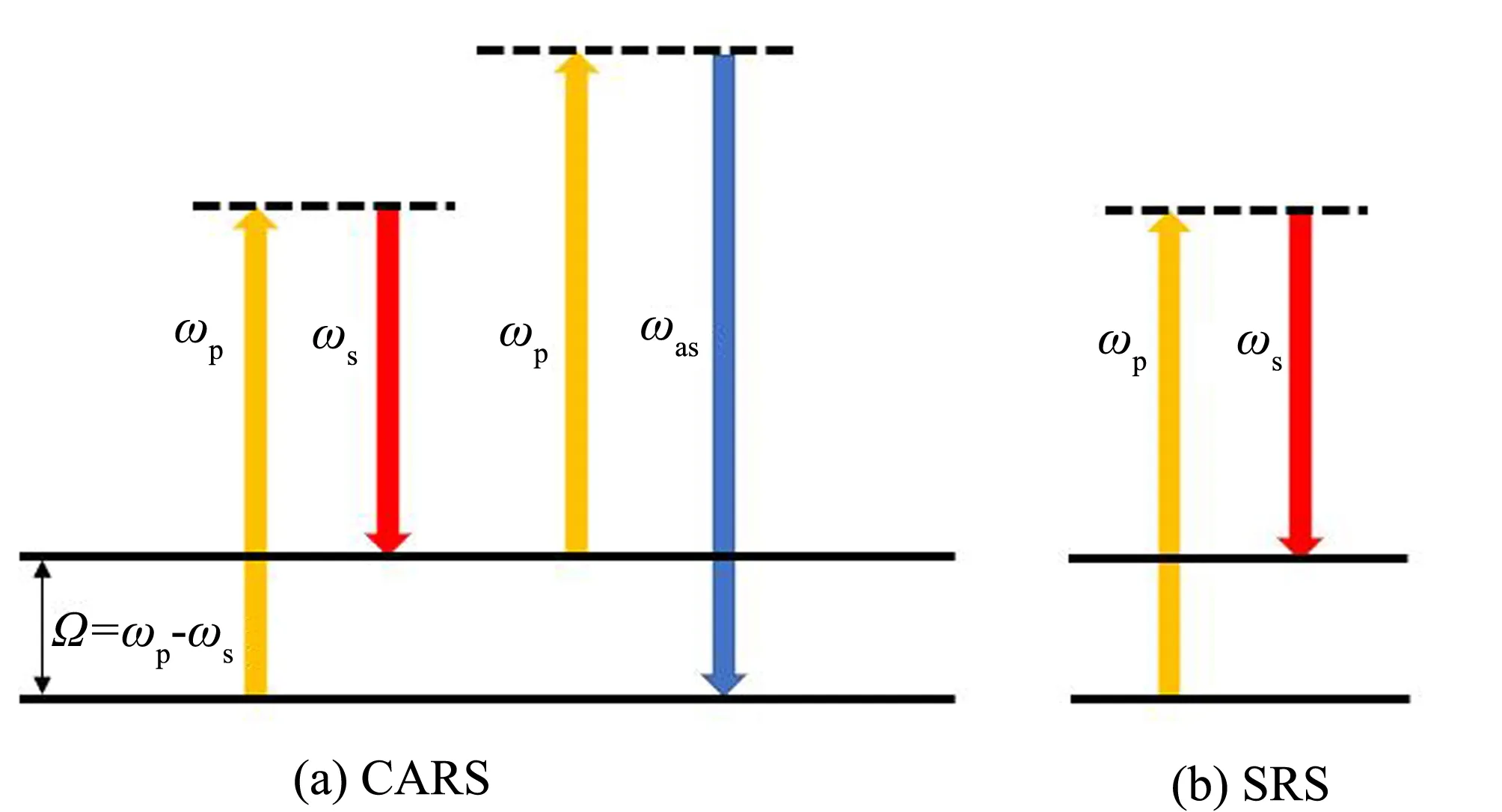
图3 相干反斯托克斯拉曼散射、 受激拉曼散射的能级变化Fig.3 Energy level changes of coherent anti-Stokes Raman scattering and stimulated Raman scattering
1.3.1相干反斯托克斯拉曼散射
相干反斯托克斯拉曼光谱通过两束光(ωp、ωs)来激发样品,当这两束入射光频率之差与样品某一化学键的振动频率一致(Ω=ωp-ωs)且满足一定的相位匹配条件即可发生共振产生相干的反斯托克斯光(ωas). 在这一共振过程中光谱信号得到加强,同时缩短了光谱采集时间、 降低荧光干扰,实现成像.
由于脂质中 C—H 键数量多、 散射面大、 信号相对强,生物医学领域中常通过CARS探测脂质信号研究细胞的活动. 过去的研究常使用脂溶性染料对脂肪标记成像,但外源染料会影响细胞正常代谢,甚至造成不可逆损伤. 使用CARS能够无标记、 无损害地对活细胞、 秀丽隐杆线虫[14]等进行观察. Xie课题组[15]对未染色成纤维细胞中的脂滴实现选择性成像,与荧光染色结果的对照验证了CARS的准确性. Le等[16]研究了肿瘤细胞在高脂环境中的行为,发现对于内脏脂肪组织或血浆游离脂肪酸过多的小鼠,其循环血中的肿瘤细胞数量早期即明显增多,并更易转移. 通过CARS成像,研究者证实了在原发、 循环中和转移灶肿瘤细胞中大量脂质堆积,而过量的游离脂肪酸进入癌细胞可改变膜的特点,使肿瘤细胞侵袭能力增强. CARS也用于观察细胞的迁移、 分化等过程[17-18]. 此外,CARS技术也可获得细胞内氨基酸、 核酸的成分信号[19]. Rajaofara等[20]使用CARS技术通过识别核仁、 核边界、 染色体、 内质网等细胞器结构成功实现了对细胞周期的可视化研究.
利用CARS对目标分子特征的探测,可以无标记地对活体、 离体和病理组织切片成像, 辅助疾病诊断. 例如,CARS对含脂病变,如动脉粥样硬化[21]、 神经脱髓鞘改变[22]等尤为敏感. CARS也用于肿瘤组织探测,结合等双光子激发荧光(TPEF)、 二次谐波(SHG)等非线性光学方法有助于对特异成分的显像[23]. 随着技术的发展,CARS内窥镜技术在临床活体组织探查上也有着广泛的发展前景[24].
1.3.2受激拉曼散射
受激拉曼散射原理与CARS类似,不同的是,SRS发生了光子与分子的能量转移,再通过调制器解调即可提取信号,作为成像对比度来源. 与CARS技术相比,SRS成像技术特点在于:其一,CARS成像中可产生非共振背景,而SRS的激发必须严格满足一定的共振条件,所以不会产生非共振背景; 其二,CARS成像时信号峰会发生移位,而SRS 光谱与自发拉曼散射光谱是完全一致的,故可直接利用拉曼光谱数据库进行组分分析; 其三,SRS的信号强度与分子浓度呈线性正相关,使定量分析更加简便.
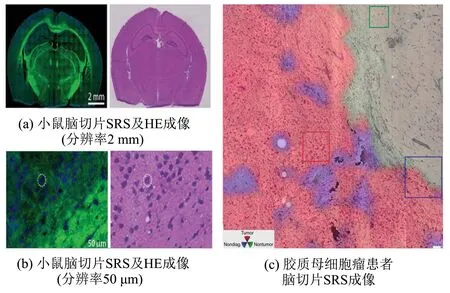
图4 受激拉曼组织学的应用Fig.4 Applications of stimulated Raman histology
同样,利用SRS成像技术可对物质进行选择性成像,研究细胞的脂质、 蛋白等信号,及细胞内特定物质的代谢和分布,如维甲酸[25]等. 近年来甚至发展了基于SRS的流式细胞术成像技术,较传统荧光标记的流式细胞术避免了对细胞本身代谢的干扰[26]组织学上,使用SRS对鼠坐骨神经髓鞘的脂质成分的信号探测可以早期观察肌萎缩性侧索硬化(ALS)的周围神经的退化[27]. 受激拉曼组织学对组织切片成像可以达到模拟HE染色的效果,甚至可实现小鼠术中肿瘤边界探测[28]. 另有研究者利用SRS对脑肿瘤成像,结合深度卷积神经网络机器学习,能识别包括正常组织、 各中枢神经系统肿瘤在内的共13种组织类型,准确率达到94.6%,可与目前病理检测媲美[29],如图4所示. 图4(a)、 (b)为小鼠脑切片的SRS显微成像、 HE染色成像对比[28],左为SRS成像,脂质显像为绿色,蛋白质显像为蓝色; 右为HE成像. 图4(c)为一位胶质母细胞瘤患者的脑切片SRS成像,红色代表肿瘤区域,绿色代表非肿瘤区域,蓝色表示非诊断区域[29].
为了提高信号识别的特异性,近年来拉曼标签被广泛应用于SRS中. 利用拉曼标签具有的特异拉曼信号特征可以改变待测物质原本的信号,从而在没有细胞内源物质干扰的信号沉默区(1 800~2 800 cm-1)实现特异性检测,同时不会对细胞本身代谢产生影响. 常用的拉曼标签有氘、 炔烃等. 使用氘作为标记,可使C—H键的2 800~3 000 cm-1处信号转移至C—D键的2 100~2 300 cm-1信号,有助于对细胞内蛋白质、 脂质的合成、 代谢研究[30-31]. 炔烃在2 125 cm-1附近有一特征性的拉曼峰,且该峰比C—D键高40倍. 炔烃可以在代谢过程中与包括核酸、 蛋白质、 脂类和聚糖在内的生物分子结合,因此利用受激拉曼散射(SRS)显微镜可对各种带有炔烃标记的生物分子进行生物正交拉曼成像[32-33].
1.4 共振拉曼光谱
当激发光频率接近或等于分子的一个电子吸收峰时, 部分特定的拉曼带强度会急剧增加. 利用这一效应产生的技术称为共振拉曼光谱(RRS)技术. 相较于常规拉曼,RRS能将拉曼光谱信号增强4~6个数量级[34],提高检测灵敏度,缩短检测时间. 其缺点在于,由于激发光子能量需与分子的电子跃迁频率一致,一般在紫外光到可见光的范围内,需要频率连续可调的激光器,以满足各种分子最低允许的电子跃迁频率; 此外,与常规拉曼相比,共振拉曼光谱的荧光背景更加显著,其信噪比降低,谱带易变形失真.
共振拉曼光谱选择性地增强生物分子特定发色基团的振动,因而能对色素分子的进行非破坏性检测,如番茄红素、 类胡萝卜素[35]、 叶绿素[36]、 血红素[37-38]等. 相对于可见光激发,大部分蛋白质等生物分子吸收位于紫外区. 选择紫外光提高了拉曼散射截面,且260 nm以下激发光没有荧光干扰,可提高信噪比,因此,紫外共振拉曼光谱(ultraviolet resonance Raman,UVRR)在生物医学研究中更具优势,现已用于实时定量生化反应监测[39]、 体液低浓度抗生素检测[40]、 生物分子结构的特异性识别[41-43]等.
1.5 空间位移拉曼光谱
传统的拉曼光谱分析方法仅能分析接近样品表面的区域或分析透明包装内样品的次表层组分,在应用上受到了限制. 2001年,Everall等[44]深入研究并阐述了拉曼散射光子迁移理论. 随后,2005年Matousek等[45]在此理论基础上提出了空间偏移拉曼光谱 (spatially offset Raman spectroscopy, SORS) 技术,从而实现了对数毫米深度内,及不透明包装内材料的化学分析.
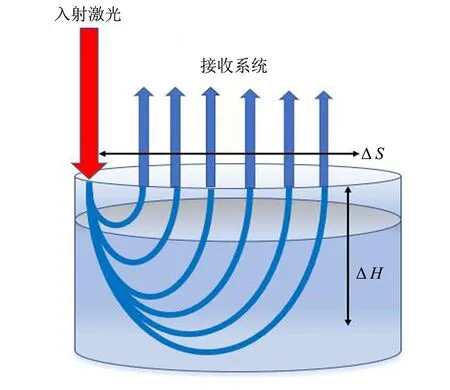
图5 空间偏移拉曼光谱技术原理 Fig.5 Principle of spatially offset Raman spectroscopy
在SORS中,激光到达样品内部的不同深度ΔH所产生的散射光在返回表层后与激光光源入射点产生了偏移距离ΔS. 通过改变空间偏移距离ΔS的大小,结合多元数据分析处理方法即可获得样品内部不同深度的拉曼光谱,如图5所示. SORS技术除了具备传统拉曼光谱的固有优点外,还具有诸多独特的优点[46]:① 由于是偏移测量,结合光谱散射,可有效抑制荧光,提高检测灵敏度; ② 在一定范围内,偏移距离越大,收集的拉曼信号中更深层样品的信号越大,穿透深度越深,能够实现深层检测; ③ 在检测过程中可以不破坏包装对样品进行检测,从而降低用户的检测和生产成本.
罗彻斯特大学光学研究所研究人员采用空间位移拉曼光谱无创检测小鼠体内骨骼强度[47],并得出了体内骨骼最大扭矩的估计值. Nicolson等[48]成功实现SORS技术与SERS的纳米颗粒的结合,并成功检测了15 mm深度的3D乳腺肿瘤模型[49]. 这些都揭示了SORS技术在医学领域的独特应用.
2 讨论
综上,近几年来,拉曼光谱技术及其衍生发展而来的其他技术凭借其无创、 实时、 可重复性高等特点,在生物医学方面,特别是在肿瘤的诊断、 治疗、 预后等许多方面有了广泛应用. 病理诊断是肿瘤诊断的金标准,而许多实验研究已证明拉曼光谱对生物组织及其切片具有适用性. 然而,拉曼光谱要转化为临床工具,至少还必须具备以下几项方面的支持:组织光谱数据库、 分类方法、 用于诊断的统计模型等.
以下以结直肠癌为例讨论不同拉曼技术具备的特点. 如前所述,传统拉曼光谱技术中,散射光与入射光间的能量差异揭示了散射介质中分子的振动及转动状态的变化,因此被称为“指纹光谱”,但其散射强度较弱,应用有限. 使用表面增强拉曼光谱可增强分析物的拉曼散射效应. 由于其可将拉曼报告分子固定在纳米颗粒上,与肠癌患者血液中生物标记物、 DNA结合,而为分子标记物的实验室检测提供更多的选择. 然而其制备要求高,设备配置繁杂等缺点为表面增强拉曼光谱技术转化为临床工具带来挑战. 共振拉曼光谱最大的优势对显色基团的检测非常灵敏,其可以用来研究虾青素(虾青素是一种在植物和海鲜中发现的类胡萝卜素,具有抗增殖、 抗氧化和抗癌的特性)在培养的结肠腺癌细胞中的分布,为抗肿瘤药物研究提供了新的方向[50]. 已有证据表明,游离脂肪酸(FFAs)诱导的癌细胞膜变化可介导富含脂质的肿瘤发生癌症转移. 受激拉曼光谱、 相干反斯托克拉曼光谱对于脂质信号较为敏感,因此,推测其可用于无标记检测早期癌症转移. 利用受激拉曼光谱、 相干反斯托克斯拉曼光谱的成像能力,可实现高度组织特异的成像效果,有助于区分肿瘤组织和正常组织,可为结直肠癌的边界判断、 术中切缘选择提供依据. 拉曼光子穿过介质的路径长度可以体现拉曼波段相对变化程度,即波段变化,从而编码矩阵内物体深度的信息. 空间位移拉曼光谱对深度光谱检测较为有效,其具备协助诊断体内肿瘤病变深度的能力,从而在确定肿瘤分期、 决定后续治疗方面具有应用前景. 各种拉曼光谱技术的比较如表1所示.
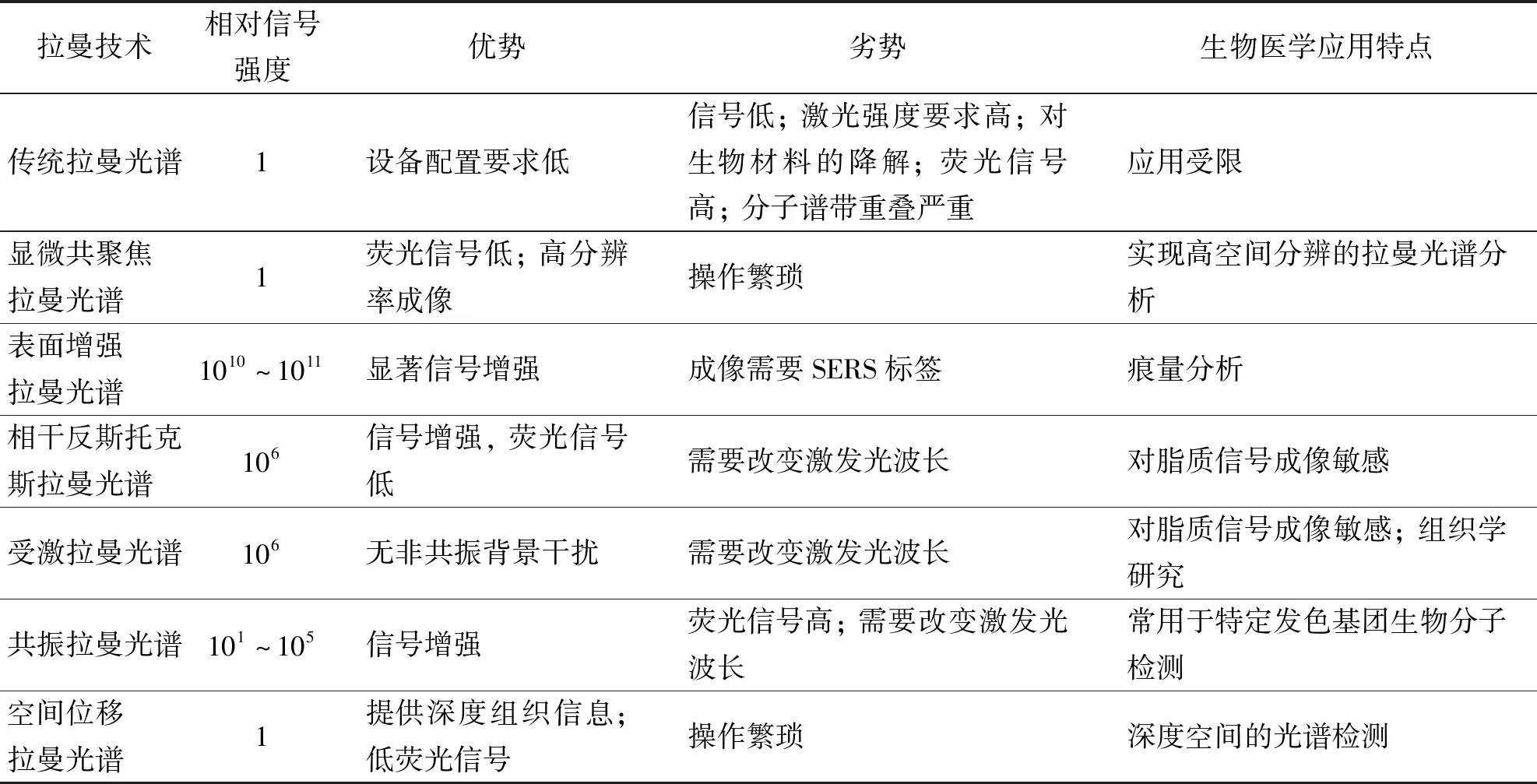
表1 不同拉曼光谱技术比较
3 结语与展望
自1928年Raman发现拉曼效应以来,拉曼光谱就成为检测分析物质结构的重要手段. 拉曼光谱技术是一种检测分子振动以表征样品潜在化学结构的光谱技术. 传统的拉曼光谱强度弱、 存在一定的荧光干扰,而新的拉曼技术的不断发展改进了上述缺点,大大拓宽了其应用范围.
目前,拉曼光谱技术已经成为一种多功能的生物医学分析工具. 单细胞拉曼光谱通常包含上千个拉曼光谱带,可以提供丰富的细胞分子信息,例如核酸、 蛋白质、 脂质等,并可反映细胞的基因型、 表型和生理状态[51]. 而阻碍其发展的有“两座大山”:其一为被认为拉曼光谱生理缺陷的“信号强度低”; 其二为由于振动模式接近的生物分子造成的“重叠的光谱带[52]”. 为了跨过“第一座大山”,可以运用表面增强拉曼光谱等技术实现信号增强; 而要跨过“第二座大山”,可以运用拉曼探针等技术实现分子的特异性检测. 拉曼光谱在分子水平上对细胞和组织进行无标记的化学定量和空间分布评估,证明了拉曼显微成像在细胞病理学和组织病理学中的潜力,并已应用于细胞代谢的动态观察、 细胞特征和分类、 疾病的诊断和检测、 三维成像等.
目前,拉曼光谱仍有一定的改进空间和巨大的发展前景. 在技术上可进一步提高的方向包括改进激发光源、 提高灵敏度、 缩短图像采集时间等; 在应用方面,发展自动成像成为专用的显微技术,与其他成像方式的结合优化成像,形成基于拉曼数据的细胞和组织诊断的客观分类程序,与人工智能结合进一步提高诊断准确率等. 随着拉曼技术的不断发展,未来拉曼光谱将在科学研究的各领域得到更加广泛的应用.

