拮抗牛呼吸系统疾病主要病原菌乳酸菌的筛选及特性研究
党 乔,吴信豪,贾博岩,刘 磊,马珺杨,刘树明,孔令聪,3,马红霞,3
(1. 吉林农业大学食品科学与工程学院,吉林 长春 130118 ;2.吉林农业大学动物科学技术学院,吉林 长春 130118 ;3. 动物生产及产品质量安全教育部重点实验室,吉林 长春 130118)
近年来,牛呼吸系统疾病(Bovine respiratory disease,BRD)已成为影响我国乃至世界养牛业的主要疾病之一,该病多发于经长途运输的育肥架子牛中,通常可导致65%~80%的发病率和45%~75%的死亡率[1-2]。引起BRD的主要病原菌为溶血性曼氏杆菌(Mannheimiahaemolytica)、牛荚膜A型多杀性巴氏杆菌(Pasteurellamultocidaof bovine capsular type A)和牛支原体(Mycoplasmabovis,M.bovis)等[3-6]。其中,牛支原体是引发牛群感染的主要病原菌,可引发牛肺炎、关节炎、乳房炎等多种疾病,并且还可通过引起免疫抑制进一步造成牛荚膜A型多杀性巴氏杆菌、化脓隐秘杆菌、溶血性曼氏杆菌等病原的继发性感染,给畜牧养殖业造成巨大的经济损失[7]。
目前,针对BRD主要采用抗生素治疗,然而随着抗生素压力的持续存在,BRD主要病原已对兽医临床常用药物产生了耐药性,因BRD主要病原耐药性产生而造成的抗感染失败已屡见不鲜[8]。乳酸菌由于具有安全性高、抑菌谱广、不易使致病菌产生耐药性等优点,已作为生物保护剂被广泛应用。Santagati M等[9]已证明呼吸道可作为益生菌的潜在靶点,乳酸杆菌可抑制人和小鼠呼吸道中的细菌病原体[10],并且可在鼻咽部定植。我们推测,采用对BRD主要病原具有拮抗作用的乳酸菌改善长途运输肉牛的呼吸系统菌群结构,很可能会极大降低该病的发病率。为此,本研究从发酵食品中筛选出对牛溶血性曼氏杆菌、牛荚膜A型多杀性巴氏杆菌和牛支原体具有拮抗作用的乳酸菌,进一步对乳酸菌的拮抗性能进行分析,为防治BRD生物制剂的研发提供科学依据。
1 材料与方法
1.1 菌株来源 试验所用乳酸菌分离自酸奶、泡菜、益生菌制剂、青贮饲料等;牛荚膜A型多杀性巴氏杆菌、牛溶血性曼氏杆菌、牛支原体均保存于吉林省新兽药研发与创制重点实验室菌种保藏库。
1.2 培养基 MRS培养基、BHI培养基,均购自青岛海博生物技术有限公司。
1.3 抗生素 氨苄西林、庆大霉素、卡那霉素、红霉素、氯霉素和四环素,均购自北京鼎国昌盛生物技术有限责任公司;环丙沙星、左氧氟沙星、头孢曲松、头孢呋辛和克林霉素,均购自中国兽医药品监察所;链霉素、环丙沙星、左氧氟沙星,均购自上海易恩化学技术有限公司。
1.4 酶制剂 胰蛋白酶、胃蛋白酶、木瓜蛋白酶、蛋白酶K和过氧化氢酶,均购自北京索莱宝科技有限公司。
1.5 方法
1.5.1 乳酸菌发酵液的制备 将活化3代后的乳酸菌以2%接种量接种于MRS液体培养基中,37 ℃厌氧培养48 h后12 000 r/min离心10 min取上清液,经0.22 μm滤膜过滤得到无细胞上清液。
1.5.2 指示菌菌悬液的制备 牛荚膜A型多杀性巴氏杆菌和牛溶血性曼氏杆菌,在BHI培养基中进行增菌培养至麦氏比浊度0.5,使用无菌生理盐水调节其浓度为1×105CFU/mL。
牛支原体接种于PPLO培养基中,调节其菌液浓度,参考《支原体学》采用倍比稀释法对牛支原体的颜色变化单位(Color change unit,CCU)进行测定,《支原体学》推荐使用的牛支原体AST菌液最佳浓度为104CCU /0.2 mL[11]。
1.5.3 乳酸菌抑菌能力测试 采用牛津杯法测定乳酸菌对2株病原菌的抑菌能力。调整病原菌浓度为105CFU/mL,取100 μL均匀涂布于BHI固体培养基,每个牛津杯中加入200 μL 乳酸菌CFS,以加入pH 4.0 MRS液体培养基的牛津杯为空白对照。将平板置于37 ℃培养箱中培养18 h,测定抑菌环直径。每个样品进行3次重复试验。
调节牛支原体菌液浓度为104CCU/0.2 mL后加入10%的乳酸CFS,置于37 ℃温箱中培养48 h后再进行牛支原体颜色变化单位测定来观察乳酸CFS对其抑菌活性。每个样品进行3次重复试验。
1.5.4 乳酸菌溶血活性测定 用无菌棉棒蘸取适量乳酸菌菌液,以“Z”字行涂布于含有5%(V/V)商业无菌羊血的琼脂培养基上,置于37 ℃厌氧培养48 h[12]。
1.5.5 乳酸菌抗生素敏感性检测 参照美国临床和实验室标准协会(CLSI) 推荐的琼脂稀释法测定乳酸菌对12种临床常用抗生素的最低抑菌浓度(MIC)[13]。每批试验均使用大肠肝菌ATCC25922和金黄色葡萄球菌ATCC25923作为质控株,要求质控株的药物敏感性在CLSI规定范围内。
1.5.6 酶对乳酸菌抑菌活性的影响 将乳酸菌CFS调节至各酶最适pH后,分别加入胰蛋白酶(pH 7.5)、 胃蛋白酶(pH 2.0)、木瓜蛋白酶(pH 7.0)、蛋白酶K(pH 8.0)、H2O2酶,使其终浓度达到1.0 mg/mL,37 ℃水浴反应2 h,调节pH为初始状态,测定其抑菌活性。
1.5.7 pH对乳酸菌抑菌活性的影响 使用1 mol/L HCl和1 mol/l NaOH调节乳酸菌CFS pH分别为2、3、4、5、6,使用相同pH的MRS培养基作为对照,测定其抑菌活性。
1.5.8 温度对乳酸菌抑菌活性的影响 乳酸菌CFS分别在40、60、80、100 ℃和121 ℃下处理30 min, 测定其抑菌圈直径。
1.5.9 紫外照射对乳酸菌抑菌活性的影响 将乳酸菌CFS置于紫外灯下连续照射8、16 h和24 h,测定其抑菌圈直径。
2 结果
2.1 具有拮抗作用乳酸菌的筛选 采用牛津杯法测定乳酸菌CFS对BRD主要病原菌的生长抑制作用,从204株食源性乳酸菌中筛选出10株具有拮抗BRD主要病原菌功能的乳酸菌。菌株抑菌效果如表1所示。其中P5鼠李糖乳杆菌抑菌效果最好,为此选择此株菌进一步研究。如表2所示,添加5%乳酸菌CFS和添加10%乳酸菌CFS后,牛支原体由104CCU/0.2 mL降至103~101CCU/0.2 mL,添加20%乳酸菌CFS则完全杀灭牛支原体,因此,选择乳酸菌CFS添加量10%进行后续乳酸菌对牛支原体拮抗性能研究。

表1 乳酸菌对病原菌拮抗效果Table 1 Antagonistic effect of Lactobacillus against pathogen

表2 乳酸菌对牛支原体拮抗效果Table 2 Antagonistic effect of Lactobacillus on Mycoplasma bovis
2.2 乳酸菌溶血活性测定 血琼脂平板上未出现溶血环,表明此菌株不具有溶血性。
2.3 乳酸菌抗生素敏感性检测 表3药物敏感性结果显示,P5仅对卡那霉素和左氧氟沙星耐药,且乳酸菌对这2种抗生素为固有耐药,一般不会引起耐药基因转移的问题,因此这株乳酸菌具有较高的安全性。
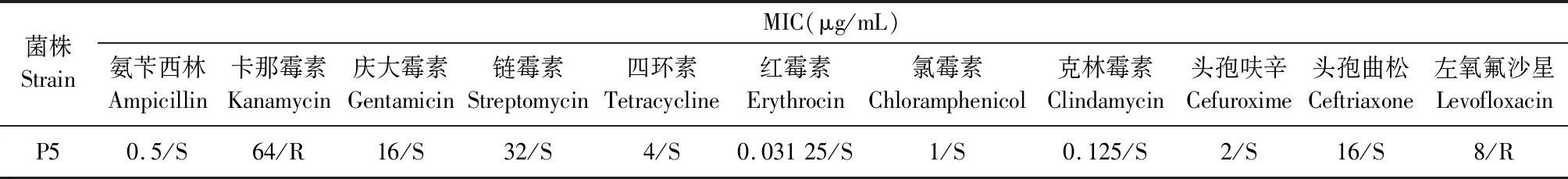
表3 乳酸菌最低抑菌浓度(MIC)及其耐药谱Table 3 Minimum inhibitory concentration (MIC) and drug resistance spectrum of Lactobacillus
2.4 酶处理对乳酸菌抑菌活性的影响 如图1所示,乳酸菌CFS经胃蛋白酶和蛋白酶K处理后,对牛荚膜A型多杀性巴氏杆菌活性显著降低,经胰蛋白酶和蛋白酶K处理后,对牛溶血性曼氏杆菌抑菌活性显著下降,经胰蛋白酶和蛋白酶K处理后,对牛支原体抑菌活性显著下降。结果表明,其抑菌成分有部分是蛋白类物质。使用终浓度为1 mg/mL的H2O2酶处理乳酸菌CFS,采用牛津杯法测定其抑菌圈。H2O2酶处理后,抑菌圈直径无明显变化,表明H2O2不是其抑菌成分中主要物质。
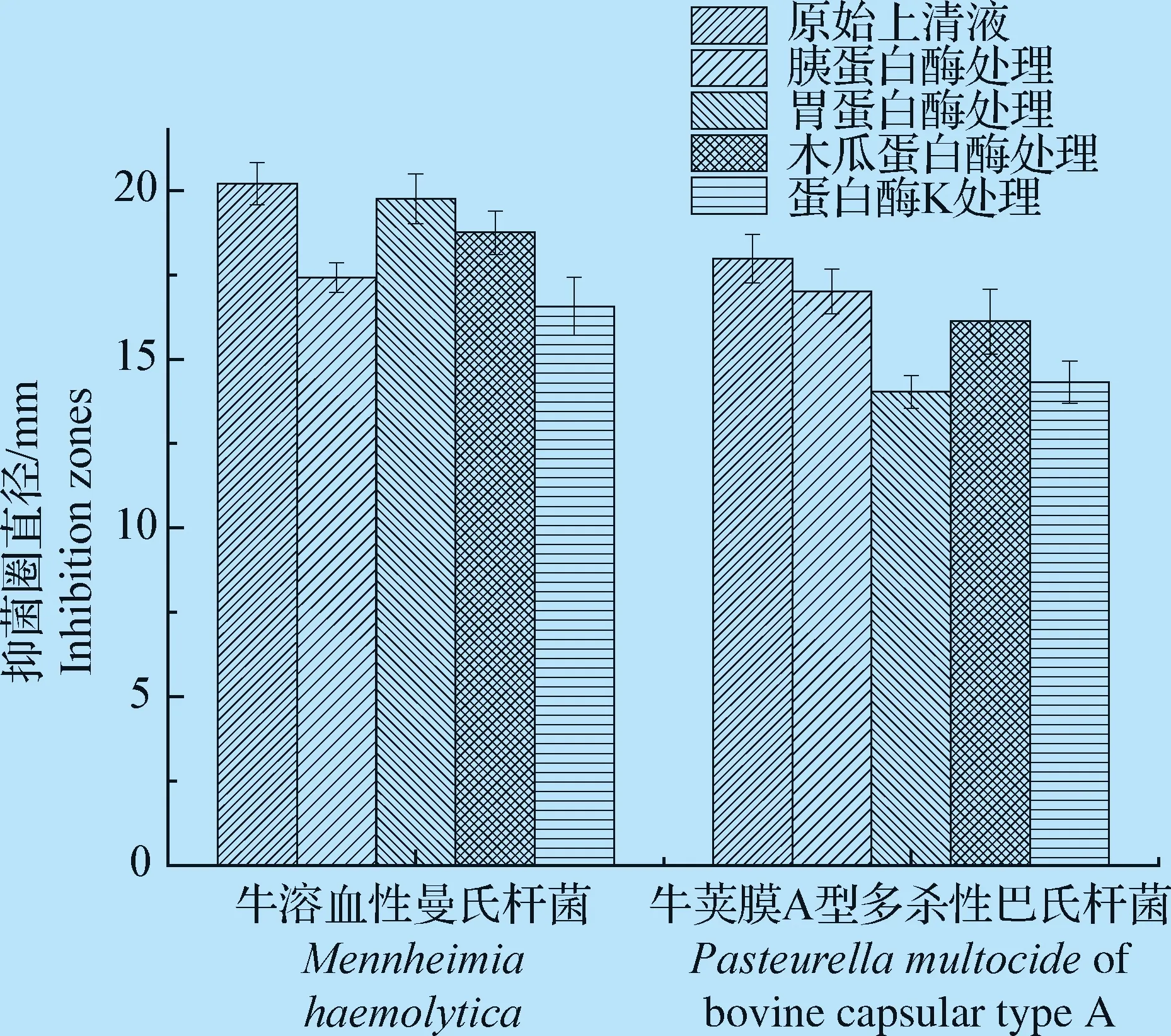
图1 蛋白酶处理对乳酸菌抑菌活性的影响Fig.1 Effect of protease treatment on bacteriostatic activity of Lactobacillus
2.5 pH对乳酸菌抑菌活性的影响 不同pH 条件下乳酸菌CFS对病原菌的抑菌性能如图2所示。

图2 pH对乳酸菌抑菌活性的影响Fig.2 Effect of pH on bacteriostatic activity of Lactobacillus
随着pH的升高,乳酸菌对病原菌的抑菌能力逐渐下降。在pH为2~4时,乳酸菌CFS对病原菌的抑菌能力与对照组相比增强或保持不变,pH为5~6 时,抑菌能力显著减弱,对牛支原体的抑菌能力几乎丧失。
2.6 温度对乳酸菌抑菌活性的影响 乳酸菌CFS经 40、60、80、100 ℃和121 ℃处理30 min后,乳酸菌CFS抑菌能力与对照组相比无显著差距,表明其代谢产物具有良好的热稳定性。
2.7 紫外线照射对乳酸菌抑菌活性的影响 乳酸菌 CFS经紫外线照射8、16 h和24 h后抑菌能力与对照组相比无变化,表明其具有良好的抗紫外线稳定性。
3 讨论

本试验进一步对抑菌产物性能进行了分析,使用H2O2酶处理后,抑菌活性无变化,使用蛋白酶处理后,抑菌活性稍有下降,抑菌活性随pH降低而增强,推测其抑菌物质为蛋白和有机酸类物质,并且在酸性条件下活性较好。赵煜[19]筛选得到4株乳酸菌,与空肠弯曲杆菌共培养后均能抑制空肠弯曲杆菌的生长。常林杰[20]利用扫描电镜与透射电镜对经乳酸菌抑菌产物处理的大肠杆菌和金黄色葡萄球菌进行观察,推测乳酸菌抑菌产物抑菌机理为破坏细胞壁。但本试验筛选出的对BRD主要病原的抑菌机制还需要进一步展开研究。
本试验从发酵食品中筛选得到1株对牛溶血性曼氏杆菌、牛荚膜A型多杀性巴氏杆菌和牛支原体具有良好抑菌性能的鼠李糖乳杆菌,其抑菌性能稳定。经初步分析,抑菌物质为在酸性条件下活性较好的酸和蛋白类物质,为防治牛呼吸系统疾病益生制剂的研发及减少抗生素的使用提供了科学基础。我们应进一步对该乳酸菌的抑菌机制开展研究,为BRD的生物防治提供理论依据。

