通用型和O型口蹄疫病毒二重荧光定量RT-PCR检测方法的建立及初步应用
王淑娟,王东方,刘 影,杨海波,赵胜杰,曹伟伟,王 翠,赵雪丽,马震原,闫若潜
(河南省动物疫病预防控制中心,河南 郑州 450008)
口蹄疫(Foot-and-mouth disease,FMD)是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV)引起的一种急性、烈性、高度传染性、水疱性疾病,以发热,唇部、口腔黏膜、乳房及蹄部出现烂斑或水疱性病理变化为典型的临床特征[1-3]。该病主要感染牛、水牛,绵羊、山羊和猪在内的70多种偶蹄目动物[4]。该病广泛流行于世界各地,严重影响畜牧业生产、动物及其产品的流通和国际贸易,造成巨大的经济损失,世界动物卫生组织(OIE)和联合国粮农组织(FAO)将其列为A 类动物传染病之首,我国也将其列为一类动物疫病。
FMDV分为O型、A型、C型、亚洲Ⅰ型 (AsiaⅠ型)等7 个血清型[5],各血清型的分布极其不均匀,A 型、O型、C型和AsiaⅠ型广泛分布,主要在欧洲、美洲、亚洲、非洲地区出现[6]。亚洲以东亚、东南亚和邻接中东地区疫情较严重,流行血清型以 A 型和 O 型为主[7],我国以O型为主[8]。
FMDV感染猪以后引起的临床症状与塞尼卡病毒病、猪水疱病和水疱性口炎等难以区分,仅凭借临床症状和病理变化诊断FMDV存在一定困难。因此,建立一种快速、特异、敏感地检测FMDV的检测方法势在必行。病毒分离是检测病毒最可靠的方法,但该方法操作麻烦,检测周期长且需在特定的实验室中才能进行。病原核酸检测是实验室诊断最常用的方法,目前国内外已经建立了多种FMDV 核酸检测方法。酶联免疫吸附试验(ELISA)、反向间接血凝试验等方法敏感性不高; 国内外学者建立的RT-PCR和多重反转录聚合酶链式反应(mRT-PCR) 方法[9-10],虽然具有较快速、特异的特点,但需要制胶、电泳等后续鉴定工作,操作复杂,而且增加了对实验室的污染 ; Madi等[11],李金海等[12]建立了检测FMDV的荧光定量PCR (FQ-PCR)可以快速、敏感地检测FMDV,但不能分型。
本试验针对不同亚型FMDV通用序列(以下简称FMDV通用型)和O型FMDV序列设计了特异性引物和探针,提供了一种FMDV通用型(T型)和O型的二重TaqMan MGB FQ-PCR检测方法,在一个PCR体系中可同时对通用型和O型FMDV核酸进行快速、特异、敏感的检测,在确定是否为FMDV感染的同时,又能确定是否是O型FMDV感染,该方法不需要电泳鉴定,能够简化操作,为FMDV提供了快速、特异、灵敏的检测方法。
1 材料与方法
1.1 毒株、菌种与重组质粒 经灭活的口蹄疫病毒O型、A型与Asia Ⅰ型标准株细胞培养物,均购自国内某公司试剂盒阳性对照。BHK-21细胞、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、塞尼卡病毒(SVV)等,均由河南省动物疫病预防控制中心实验室提供。pGEM-T/FMDV-T(通用型)和pGEM-T/FMDV-O(O型)重组质粒:长度633 bp FMDV-T和234 bp FMDV-O特异性PCR扩增片段分别克隆入pGEM-T Easy载体,提取重组质粒后,通过紫外可见光分光光度计测定其OD260和OD280值,重复5次,确定质粒DNA的浓度,参考Kim等[13]介绍的方法计算其浓度,定量并稀释至 1.0×1010拷贝/μL,于-20 ℃冻存备用。
1.2 仪器和试剂 ABI 7500荧光定量PCR仪,购自美国ABI公司;KingFisher全自动核酸提取仪,购自美国Thermo Fisher公司;磁珠法核酸全自动提取试剂盒,购自Ambion生物科技公司;ExTaqDNA聚合酶、dNTPs、DNA回收试剂盒等,均购自宝生物工程(大连)有限公司;MLV反转录酶、RNA酶抑制剂、pGEM-T Easy载体、JM109感受态细胞,均购自Promega公司。
1.3 引物设计和合成 经大量比对GenBank中FMDV基因序列,选取不同亚型FMDV共有基因和O型 FMDVVP1基因高度保守且具有型特异性基因序列为模板,设计了1条特异性反转录引物FMDVR P0,2对特异性引物对FMDVT-F P1、FMDVT-R P2、FMDVO-F P3、FMDVO-R P4,2条TaqMan MGB探针FMDVT-MGB-FAM-Probe Probe-P5、FMDVO-MGB-VIC-Probe Probe-P6,引物和探针均由Invitrogen公司合成(表1)。

表1 引物与探针序列Table 1 The primers and probes sequences
1.4 样品核酸的提取和反转录 参照磁珠法核酸提取试剂盒说明书,采用Kinfisher全自动核酸仪分别提取经灭活的口蹄疫病毒O型、A型与Asia Ⅰ型标准株细胞培养物、BHK-21细胞对照、PEDV、TGEV、SVV的总RNA。经反复试验确定的最佳反转录体系为:M-MLV 5×Reaction Buffer(含Mg2+) 4 μL; 2.5 mmol/L dNTPs 4 μL;M-MLV 0.5 μL;RNA酶抑制剂 0.5 μL;反转录引物P0共1 μL;总体积10 μL。然后加入提取的不同样品总RNA共10 μL后,37 ℃水浴1 h进行反转录,反应结束后,70 ℃ 15 min 灭活反转录酶,反转录产物(cDNA)直接用于下步PCR扩增或-20 ℃冻存备用。
1.5 通用型和O型口蹄疫病毒二重FQ-PCR反应条件的优化 将pGEM-T/FMDV-T 和pGEM-T/FMDV-O重组质粒分别稀释至终浓度1.0×106拷贝/μL作为检测模板,P1/P2、P3/P4引物对分别稀释为终浓度0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 μmol/L 和1.0 μmol/L,Probe-P5、Probe-P6探针分别稀释到终浓度为0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 μmol/L和1.0 μmol/L,应用荧光PCR仪采用矩阵法筛选不同浓度的FMDV-T/FMDV-O引物和探针组合,筛选针对FMDV-T/FMDV-O的二重FQ-PCR最佳引物浓度、探针浓度和最佳反应条件。
1.6 敏感性试验和标准曲线的建立 将pGEM-T/FMDV-T和pGEM-T/FMDV-O重组质粒分别作等量混合,将其作为标准品,分别10倍系列稀释至终浓度为1.0×106~1.0×10-1拷贝/μL,共8个稀释度,按步骤1.5优化的FQ-PCR反应条件进行FMDV-T/FMDV-O二重FQ-PCR敏感性试验。分别以pGEM-T/FMDV-T和pGEM-T/FMDV-O重组质粒起始模板数的对数为X轴,以二重FQ-PCR循环次数Ct值为Y轴作回归曲线,建立二重FQ-PCR方法的标准曲线。
1.7 特异性检验 利用建立的二重FQ-PCR方法对PEDV、TGEV、SVV进行扩增,同时以经灭活的口蹄疫病毒O型、A型与Asia Ⅰ型标准株细胞培养物混合物为阳性对照,正常BHK-21细胞培养物为阴性对照,以验证该方法的特异性。
1.8 稳定性和重复性试验 分别将4个浓度(1.0×105~1.0×102拷贝/μL)的10倍系列稀释的pGEM-T/FMDV-T和pGEM-T/FMDV-O重组质粒等量混合物进行二重FQ-PCR扩增,每个系列设定3个重复,以验证该方法的稳定性和重复性。
1.9 应用试验 依据建立的FMDV-T/FMDV-O二重FQ-PCR和口蹄疫病毒O型、A型与AsiaⅠ型三重RT-PCR普通检测方法,配制检测试剂,以口蹄疫病毒O型、A型和Asia Ⅰ型细胞灭活病毒标准株单一培养物的等量混合物为阳性对照,正常BHK-21细胞培养物为阴性对照,对15份临床疑似FMDV感染样品(样品编号为:1~15)进行了应用检测,对这2种方法的检测结果进行比较分析,并与其测序结果比较。
2 结果
2.1 质粒DNA浓度的测定 通过紫外分光光度计分别测定pGEM-T/FMDV-T 和pGEM-T/FMDV-O重组质粒OD260平均值分别为2.360和2.457,OD280平均值分别为1.197和1.311,OD260/OD280平均值分别为1.971和1.873;参考质粒DNA拷贝数计算方法,计算出pGEM-T/FMDV-T 和pGEM-T/FMDV-O质粒拷贝数分别为1.81×1010拷贝/μL和1.88×1010拷贝/μL,均稀释至1.0×1010拷贝/μL。
2.2 FMDV-T/FMDV-O二重FQ-PCR反应条件 二重FQ-PCR反应体系25 μL:2.5 mmol/L dNTPs 2 μL,10×ExTaq缓冲液 2.5 μL,5U/μLExTaq酶 0.25 μL;引物(20 μmol/L)P1/P2、P3/P4各0.5 μL,探针(10 μmol/L)Probe-P5 0.6 μL,探针(10 μmol/L)Probe-P6 0.8 μL;1.0×106拷贝/μL的质粒模板 2 μL,补ddH2O至25 μL。二重FQ-PCR反应程序:94 ℃预变性5 min;94 ℃变性15 s,60 ℃退火30 s,40个 循环。最佳反应条件下的FQ-PCR结果见图1。

图1 FMDV-T/FMDV-O 二重FQ-PCR的扩增曲线Fig.1 The kinetic curve for FMDV-T/FMDV-O FQ-PCR1:FAM探针FMDV-T扩增曲线; 2:VIC探针FMDV-O扩增曲线; 3~4:阴性对照1:Kinetic curve for FMDV-T of FAM probe; 2:Kinetic curve for FMDV-O of VIC probe; 3~4:Negative control
2.3 FMDV-T/FMDV-O二重FQ-PCR敏感性及标准曲线 二重FQ-PCR检测FMDV-T和FMDV-O最低检出限均为1.0×101拷贝/μL(图2和图3)。由敏感性检测结果建立FMDV-T标准曲线,相关系数为0.999,斜率为-3.11,截距为36.10,从而可以得出拷贝数(X)与Ct值之间的线性关系表达式:Ct=-3.11×logX+36.1(图4);由敏感性检测结果建立FMDV-O标准曲线,相关系数0.995,斜率为-3.28, 截距为35.29,从而可以得出拷贝数(X)与Ct值之间的线性关系表达式:Ct=-3.28×logX+35.29(图5)。

图2 FMDV-T FQ-PCR 的扩增曲线Fig.2 The kinetic curve for FMDV-T FQ-PCR1~8:对应的质粒浓度1.0×106, 1.0×105, 1.0×104,1.0×103, 1.0×102, 1.0×101, 1.0×100,1.0×10-1拷贝/μL; 9:阴性对照1~8: Plasmid concentration 1.0×106,1.0×105,1.0×104, 1.0×103, 1.0×102, 1.0×101,1.0×100, 1.0×10-1copies/μL, respectively; 9:Negative control

图3 FMDV-O FQ-PCR 的扩增曲线Fig.3 The kinetic curve for FMDV-O FQ-PCR1~8:对应的质粒浓度1.0×106, 1.0×105, 1.0×104,1.0×103, 1.0×102, 1.0×101, 1.0×100, 1.0×10-1拷贝/μL; 9:阴性对照1~8: Plasmid concentration 1.0×106, 1.0×105, 1.0×104,1.0×103, 1.0×102, 1.0×101,1.0×100, 1.0×10-1copies/μL,respectively; 9:Negative control
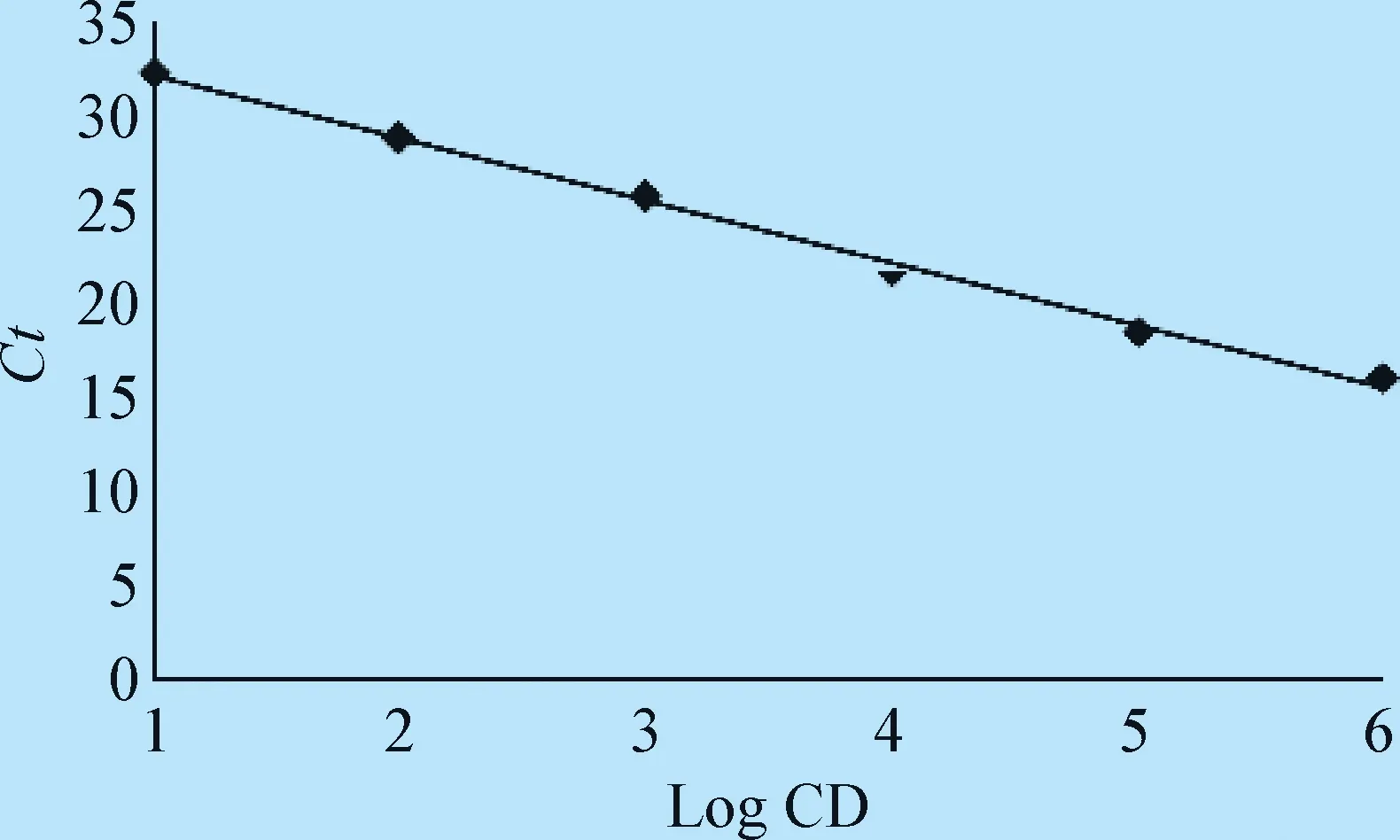
图4 FMDV-T FQ-PCR标准曲线Fig.4 The standard curve for FMDV-T FQ-PCR

图5 FMDV-O FQ-PCR标准曲线Fig.5 The standard curve for FMDV-O FQ-PCR
2.4 特异性 采用建立的FMDV-T/FMDV-O二重FQ-PCR方法对PEDV、TGEV、经灭活的口蹄疫病毒O型、A型与Asia Ⅰ型标准株细胞培养物混合物,正常BHK-21细胞培养物进行检测,结果显示,经灭活的口蹄疫病毒O型、A型与Asia Ⅰ型标准株细胞培养物混合物呈双阳性曲线扩增,Ct值分别为18.4和16.8,但正常BHK-21细胞培养物、PEDV、TGEV、SVV等均未出现特定的扩增曲线(图6)。

图6 FMDV-T/FMDV-O二重FQ-PCR方法的特异性试验Fig.6 Specificity test for FMDV-T/FMDV-O FQ-PCR1:FMDV-T质粒; 2:FMDV-O质粒; 3~7:正常BHK-21细胞培养物、PEDV、TGEV、SVV及阴性对照1:FMDV-T plasmid; 2:FMDV-O plasmid; 3~7:BHK-21,PEDV,TGEV,SVV and negative control
2.5 稳定性和重复性 采用建立的FMDV-T/FMDV-O二重FQ-PCR方法对4个浓度(1.0×105~1.0×102拷贝/μL)的10倍系列稀释的pGEM-T/FMDV-T和pGEM-T/FMDV-O重组等量质粒混合物进行检测,并且每个系列设定3个重复。结果表明,浓度为1.0×105、1.0×104、1.0×103拷贝/μL和1.0×102拷贝/μL的4个浓度的FMDV-T/FMDV-O重组质粒等量混合物3次试验结果均为阳性并且重复性良好,批内试验和批间试验变异系数均<0.04,说明建立的FMDV-T/FMDV-O二重FQ-PCR方法具有很好的稳定性和重复性(图7,表2,表3)。
2.6 临床样品检测 依据建立的FMDV-T/FMDV-O二重FQ-PCR和口蹄疫病毒O型、A型与Asia Ⅰ型三重RT-PCR普通检测方法,配制检测试剂,以口蹄疫病毒O型、A型和Asia Ⅰ型细胞灭活病毒标准株单一培养物的等量混合物为阳性对照,正常BHK-21细胞培养物为阴性对照,对15份临床疑似FMDV感染样品(样品编号:1~15)进行了应用检测,对这2种方法的检测结果进行比较分析,并与FMDV测序结果比较。

图7 FMDV-T/FMDV-O二重FQ-PCR方法的重复性试验Fig.7 Reproducibility test for FMDV-T/FMDV-O FQ-PCRT1-3:1.0×105拷贝/μL FMDV-T质粒; T4-6: 1.0×104拷贝/μL FMDV-T质粒; T7-9: 1.0×103拷贝/μL FMDV-T质粒; T10-12: 1.0×102拷贝/μL FMDV-T质粒; O1-3: 1.0×105拷贝/μL FMDV-O质粒; O4-6: 1.0×104拷贝/μL FMDV-O质粒; O7-9: 1.0×103拷贝/μL FMDV-O质粒; O10-12: 1.0×102拷贝/μL FMDV-O质粒;NC: 阴性对照T1-3: 1.0×105 copies/μL FMDV-T plasmid; T4-6: 1.0×104 copies/μL FMDV-T plasmid; T7-9: 1.0×103 copies/μL FMDV-T plasmid; T10-12: 1.0×102 copies/μL FMDV-T plasmid; O1-3: 1.0×105 copies/μL FMDV-O plasmid; O4-6: 1.0×104 copies /μL FMDV-O plasmid; O7-9: 1.0×103 copies/μL FMDV-O plasmid; O10-12: 1.0×102 copies/μL FMDV-O plasmid; NC: Negative control
测定结果如图8所示。结果表明,采用RT-PCR检测5份为FMDV-T阳性,4份为FMDV-O阳性,采用本试验建立的FMDV-T/FMDV-O二重FQ-PCR检测,9份为FMDV-T阳性,7份为FMDV-O阳性,该FQ-PCR方法检测结果与FMDV 共有基因、O型 FMDVVP1基因测序结果符合率为100%。将本试验部分疑似FMDV感染样品送国家口蹄疫参考实验室进行复核,结果确认为FMDV-O阳性[14]。表明本试验建立的FMDV-T / FMDV-O二重FQ-PCR方法比普通PCR方法的灵敏性高。
3 讨论
FMD是世界范围内严重影响畜牧业健康发展的恶性动物传染病,一旦暴发会对畜牧产业造成毁灭性的灾难[15]。《国家中长期动物疫病防治规划(2010-2020年)》也制定了FMD的控制和净化目标,这就要求我们必须加大监测力度,特别是加大病原学监测的范围和数量,因此,FMDV检测方法的快速、简便和高通量将越来越受到重视[16]。FQ-PCR技术具有敏感性高、特异性好、操作简单快捷,给检测工作带来很大便利。FQ-PCR技术分为染料法和探针法2种,Jamnikar等[17]对染料法和探针法进行了比较,认为探针法用于定量比SYBR Green I 染料法更为准确,且特异性更高。本试验建立的通用型和O型口蹄疫病毒二重FQ-PCR检测方法采用了TaqMan MGB探针,与传统的TaqMan探针相比,TaqMan MGB探针缩短了探针的长度,大大提高了探针的Tm值,也降低了探针的合成成本,TaqMan MGB探针的淬灭基团采用非荧光淬灭基团,其本身不产生荧光信号,可大大降低本底信号的强度,使扩增结果更加特异、敏感[18]。

表2 FMDV-T的二重FQ-PCR方法重复性Table 2 The results of FMDV-T reproducibility

表3 FMDV-O的二重FQ-PCR方法重复性Table 3 The results of FMDV-O reproducibility
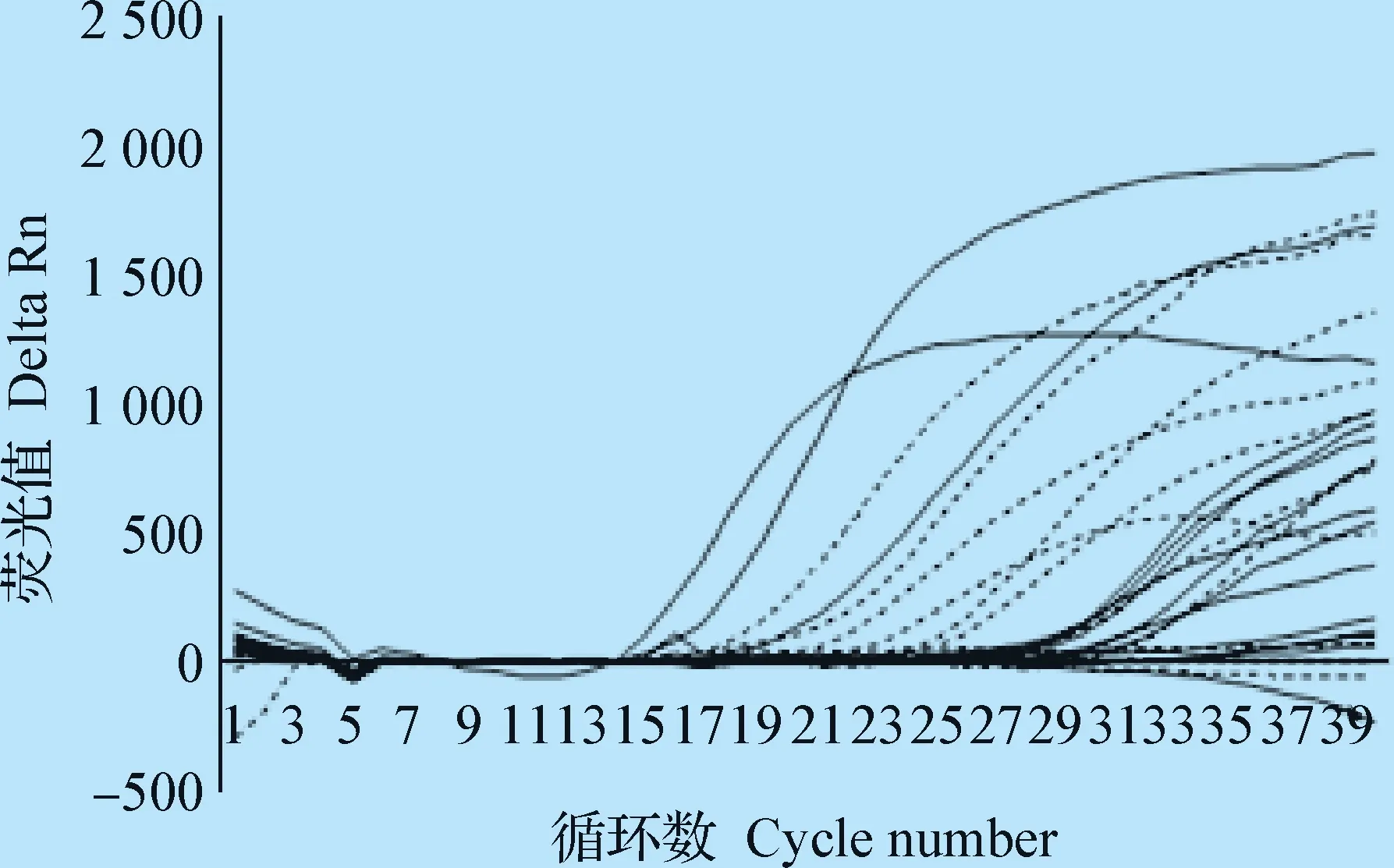
图8 临床样品检测Fig.8 Detection of clinical samples
本试验在一个PCR反应体系中进行FMDV通用型和O型的二重检测反应,同时收集代表FMDV通用型和O型的荧光信号,对扩增产物进行实时在线检测,从而建立了能够同时检测 FMDV 通用型及O型二重FQ-PCR 方法。实验室及临床样品检测试验结果表明,该方法具有操作简便快速、特异性强、敏感性高等优点,为通用型和O型FMDV的快速检测提供了一种新方法。
目前,我国主要流行 O 型和 A 型 FMD,而 AsiaⅠ型自 2009 年之后未见临床病例报道[19],并且国家已退出 AsiaⅠ型 FMD 的强制免疫,主要针对 FMDV 的 O 型和 A 型进行病原鉴别诊断。因此仍需在本试验的基础上,进一步开发针对FMDV通用型、O型和A型的荧光定量PCR检测方法。

