基于UPLC-QTOF-MS 技术的压榨和浸出油茶籽油甘油酯组成比较分析
胡 谦,张九凯*,韩建勋,邢冉冉,刘 晗,陈 颖
(1.中国检验检疫科学研究院,北京 100176;2.北京工商大学食品与健康学院,北京 100048)
油茶籽油,又名山茶油、茶树油、茶油,是山茶属(CamelliaL.)油茶树种子经加工制得,与橄榄油、椰子油、棕榈油并列为世界四大木本植物油,在我国已有2 000多年的历史。油茶籽油中脂肪酸的组成和比例,以及物理化学性质,与橄榄油接近,被誉为“东方橄榄油”[1]。油茶籽油富含单不饱和脂肪酸、茶多酚、角鲨烯和维生素,具有预防心脑血管疾病、抗肿瘤和抗氧化等功效[2-4]。随着我国经济的发展,人们对生活质量要求的提高,油茶籽油作为我国能与进口橄榄油相媲美的木本食用油,其产量与销量逐步上升。
油茶籽油的生产工艺主要有压榨法和浸出法。压榨法是利用物理压力从山茶籽中将油脂榨取出来,出油率相比于浸出法要低。浸出法是采用食品级溶剂从压榨后的山茶籽中浸出残留的油脂,以提高出油率。市场上压榨油茶籽油的价格和品质都比浸出油茶籽油高[5-6]。由于国内油茶籽油市场的消费量日渐递增以及原料产量的限制等原因,导致了将浸出油茶籽油冒充压榨油茶籽油出售以赚取巨额利润的违法现象时有发生。GB 11765—2018《油茶籽油》中规定在外包装上应标识油茶籽油的加工工艺,但目前还没有有效的手段鉴别压榨油茶籽油和浸出油茶籽油。因此为了防止浸出油茶籽油冒充压榨油茶籽油,保证消费者利益,为行政执法提供依据,维护油茶籽油产业健康发展,开展研究浸出油茶籽油和压榨油茶籽油的鉴别方法具有重要意义。
近年来,已经有使用红外光谱[7]、可见-近红外光谱[8-9]、可见-紫外光谱[10]、核磁共振[11]等技术用于鉴别压榨和浸出植物油。这些方法具有快速简便的特点,但是难以从分子水平分析代谢物组成。植物油的主要成分是甘油三酯,占比达95%~98%[12-13]。脂质组学是代谢组学最主要的分支之一,已经广泛应用于食品脂质成分分析[14-15]、品质判别[16-17]、真伪鉴别[18-19]和产地溯源[20-21]等方面。Jergović等[22]采用基质辅助激光解吸电离质谱技术分析甘油三酯,可快速鉴别初榨橄榄油、精制橄榄油和葵花籽油掺假特级初榨橄榄油。Da Silveira等[13]基于质谱技术筛选大豆油的特征脂质,可鉴别低至1%的大豆油掺假的特级初榨橄榄油,此外Fasciotti等[23]使用液相色谱-质谱技术结合主成分分析(principal component analysis,PCA)建模可鉴别大豆油掺假特级初榨橄榄油。但目前还没有基于液相色谱-质谱技术的脂质组学方法用于比较压榨油茶籽油和浸出油茶籽油的甘油酯组成。因此,本研究基于超高效液相色谱-四极杆飞行时间-质谱(ultra-high performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry,UPLC-QTOF-MS)技术的脂质组学,比较浸出油茶籽油和压榨油茶籽油的甘油酯组成。结合化学计量学分析,以甘油酯分子组成为变量参数,建立判别模型以区分压榨和浸出油茶籽油。
1 材料与方法
1.1 材料与试剂
8 种浸出油茶籽油和9 种压榨油茶籽油均由江西省赣州市产品质量监督检验所提供,避光贮藏于室温。异丙醇、乙腈、甲醇(均为质谱级) 美国Honeywell公司;乙酸铵(质谱级) 美国Sigma公司。
1.2 仪器与设备
Kinetex C18柱(2.1 mm×100 mm,2.6 µm,100 Å)美国Phenomenex公司;TripleTOF 6600质谱仪(配备有2 个ExionLC AD泵、ExionLC AD自动进样器和ExionLC AC柱温箱的ExionLC AD系统) 美国AB Sciex公司。
1.3 方法
1.3.1 样品处理
每个样品精确称取0.1 g(±0.1 mg)溶解于10 mL甲醇-异丙醇(1∶1,V/V,5 mmol/L乙酸铵),稀释10 倍,实验样品制备完成后,每个样品取等量混匀作为质控样品,以监测仪器的稳定性和重复性,并优化UPLCQTOF-MS条件。
1.3.2 脂质分离与检测
脂质分离采用ExionLC AD系统,色谱柱为Kinetex C18柱(2.1 mm×100 mm,2.6 µm,100 Å)。二元梯度洗脱,流动相A为甲醇-乙腈-水(1∶1∶3,V/V,5 mmol/L乙酸铵),流动相B为异丙醇(5 mmol/L乙酸铵)。梯度洗脱程序为:0.0~1.0 min,80% A,20% B;1.0~3.0 min,80%~30% A,20%~70% B;3.0 ~1 3.0 m i n,3 0%~2% A,7 0%~9 8% B;13.0~15.0 min,2% A,98% B;15.0~15.1 min,2%~80% A,98%~20% B;15.1~18.0 min,80% A,20% B。流速0.3 mL/min,柱温40 ℃,1 μL进样,每个样品重复进样3 次。
使用串联QTOF质谱进行质谱检测,配备有DuoSpray离子源,采用正离子模式。数据采集使用Analyst TF 1.7.1软件,并在full-scan TOF MS和MS/MS模式下操作,在单针注射中采用信息依赖采集(information dependent acquisition,IDA)模式、动态背景扣除和实时多重质量亏损。最佳离子源参数如下:离子源温度550 ℃;喷雾电压5 500 V;气帘气30 psi;雾化气50 psi;辅助加热气55 psi;去簇电压80 V。在全扫描TOF MS中,滞留时间为250 ms,质量扫描范围m/z200~1 200。在MS/MS模式下,碰撞能量35 eV;扩展碰撞能量15 eV;滞留时间50 ms;质量扫描范围m/z150~1 200。此外,为了维持TripleTOF 6600在数据采集中保持高质量准确度,每隔6 个实验样品,使用自动校准装置系统对仪器进行校正。
1.3.3 脂质的鉴定
采取full-scan TOF MS和MS/MS模式扫描获得精确的MS和MS/MS信息,使用PeakView 2.2软件(美国AB Sciex)结合LIPIDMAPS[24]数据库,对甘油三酯和甘油二酯定性分析。采用PeakView软件鉴定脂质,将各脂质的分子式、离子加合方式输入到MasterView插件中,软件会算出一级精确质量数,根据精确质量数和同位素类型的误差情况计算出样品中该化合物的质谱信息,并能匹配出液相色谱的出峰时间及丰度。质量误差范围设置为0.02 Da,保留时间窗口设置为0.4 min。
1.4 数据统计与分析
每种脂质的峰面积除以样品中所有脂质峰面积的总和,归一化脂质丰度数据。使用SIMCA 15.0(瑞典Umetrics)软件进行化学计量学分析,采用佩尔托标度(Pareto scaling)的PCA和正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,
OPLS-DA)建立模型。通过使用SIMCA软件的默认选项对数据进行七轮内部交叉验证。
2 结果与分析
2.1 甘油酯的定性分析
采用UPLC-QTOF-MS技术,对油茶籽油中脂质进行分析。以full-scan TOF MS扫描以尽可能多检测脂质,并且采用MS/MS模式得到脂质的二级质谱信息。甘油酯在反相液相色谱上的洗脱依据等效碳数(等效碳数=脂肪酰基总碳数-2双键数)的大小,等效碳数越大,保留时间也就越长[25]。植物油中脂质主要为甘油三酯和甘油二酯,其主要的离子加合方式有3 种:[M+NH4]+、[M+Na]+和[M+H]+。为增强质谱信号,在流动相和溶解试剂中添加改性剂乙酸铵。在电喷雾离子源模式下甘油酯以[M+NH4]+加合的质谱响应最强,因此以[M+NH4]+对UPLC-QTOF-MS数据提取甘油酯。二级谱图可以确定甘油酯的脂肪酰基链组成,在碰撞池内,前体离子[M+NH4]+离子会产生碎片离子[M-FA+H]+,即中性丢失FA+NH3[26]。因此可以基于中性丢失的质量数,推测甘油酯的脂肪酰基链组成,结果见表1。在浸出和压榨油茶籽油中均鉴定到43 种甘油三酯和12 种甘油二酯,UPLC-QTOF-MS分析油茶籽油的甘油酯组成见表2。
表1 甘油酯离子[MNH4]的脂肪酰基链中性丢失质量数Table 1 Neutral loss masses of fatty acyl chains of glyceride ion[MNH4]+
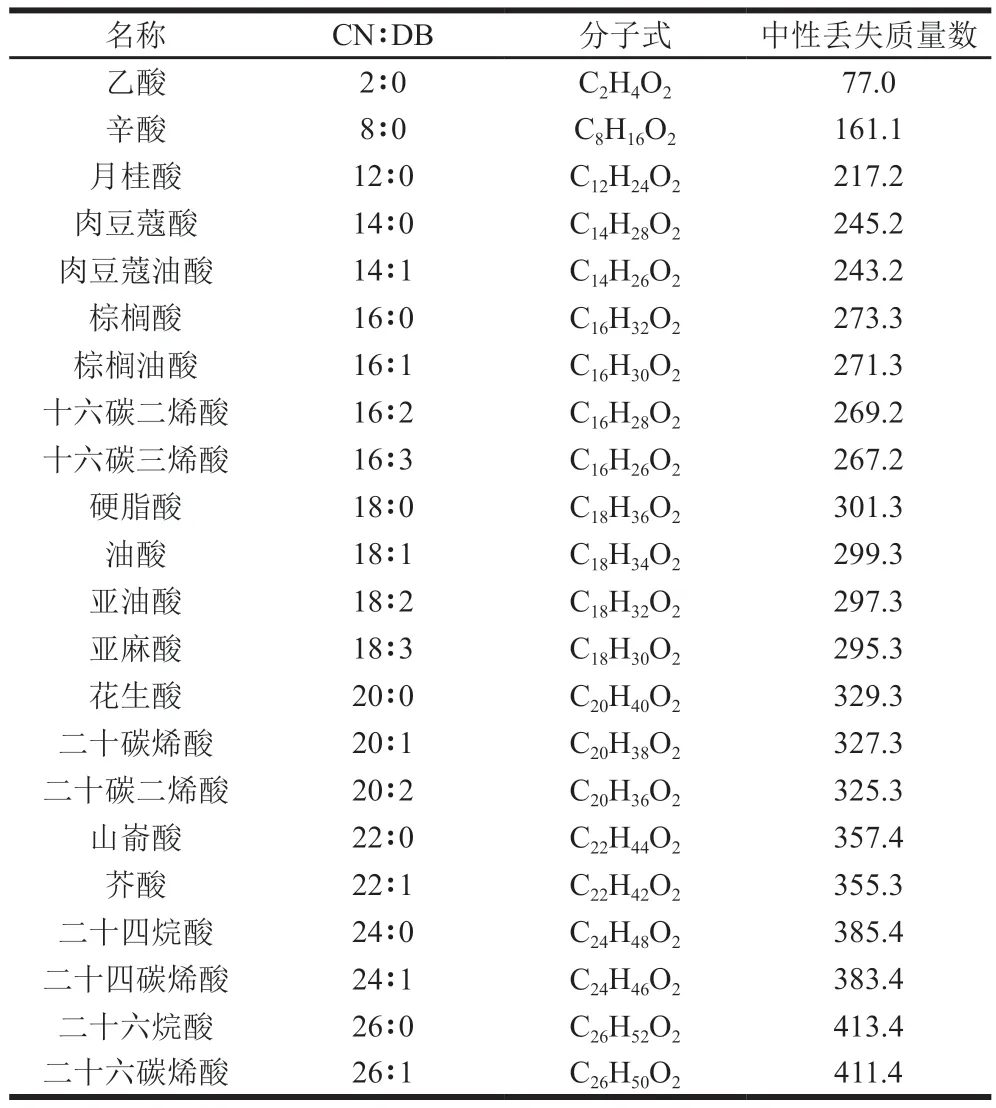
表1 甘油酯离子[MNH4]的脂肪酰基链中性丢失质量数Table 1 Neutral loss masses of fatty acyl chains of glyceride ion[MNH4]+
注:CN∶DB为酰基碳数∶双键数。表2同。
名称 CN∶DB 分子式 中性丢失质量数乙酸 2∶0 C2H4O2 77.0辛酸 8∶0 C8H16O2 161.1月桂酸 12∶0 C12H24O2 217.2肉豆蔻酸 14∶0 C14H28O2 245.2肉豆蔻油酸 14∶1 C14H26O2 243.2棕榈酸 16∶0 C16H32O2 273.3棕榈油酸 16∶1 C16H30O2 271.3十六碳二烯酸 16∶2 C16H28O2 269.2十六碳三烯酸 16∶3 C16H26O2 267.2硬脂酸 18∶0 C18H36O2 301.3油酸 18∶1 C18H34O2 299.3亚油酸 18∶2 C18H32O2 297.3亚麻酸 18∶3 C18H30O2 295.3花生酸 20∶0 C20H40O2 329.3二十碳烯酸 20∶1 C20H38O2 327.3二十碳二烯酸 20∶2 C20H36O2 325.3山嵛酸 22∶0 C22H44O2 357.4芥酸 22∶1 C22H42O2 355.3二十四烷酸 24∶0 C24H48O2 385.4二十四碳烯酸 24∶1 C24H46O2 383.4二十六烷酸 26∶0 C26H52O2 413.4二十六碳烯酸 26∶1 C26H50O2 411.4
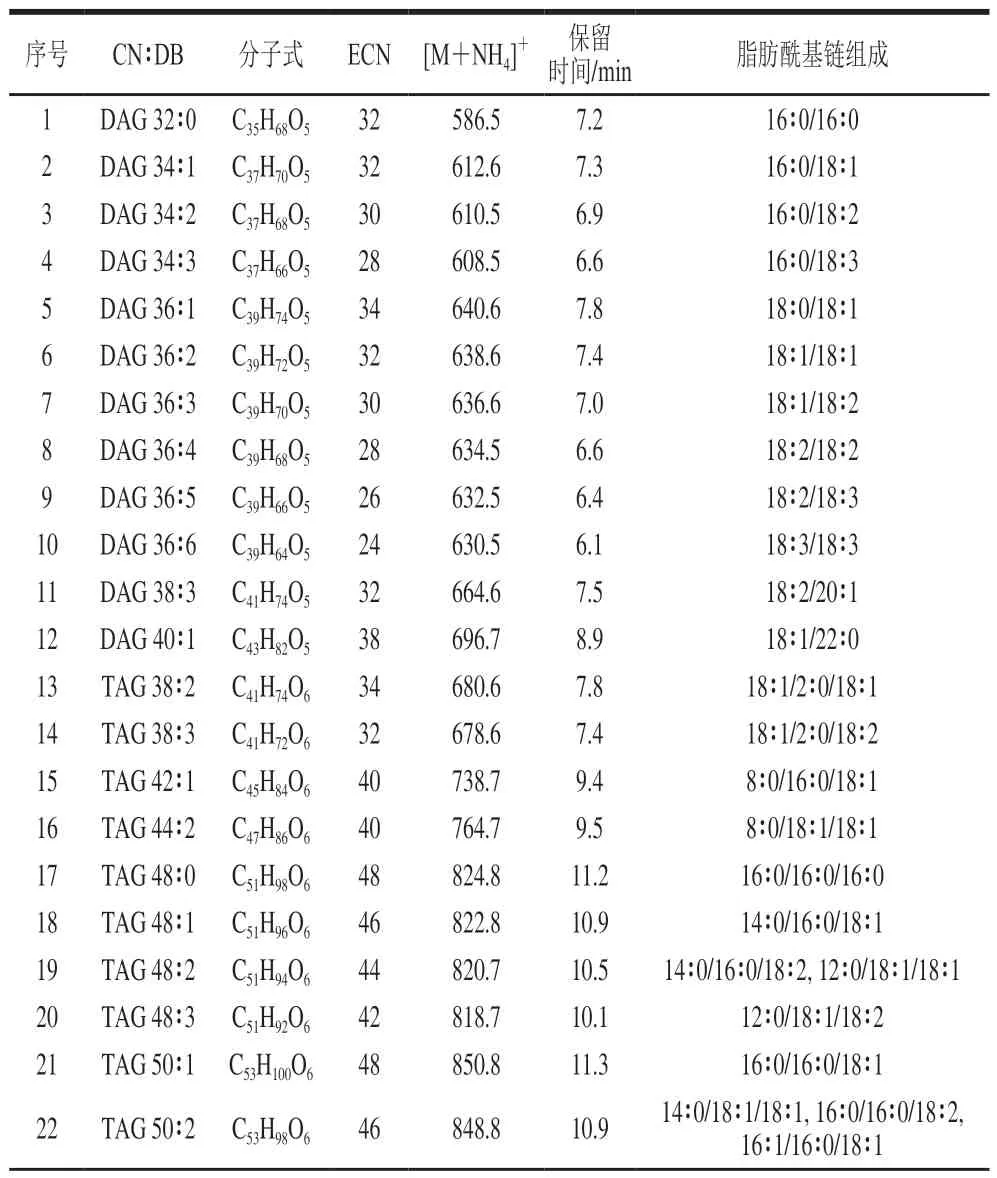
表2 UPLC-QTOF-MS分析油茶籽油的甘油酯组成Table 2 Glyceride composition of camellia oil analyzed by UPLC-QTOF-MS
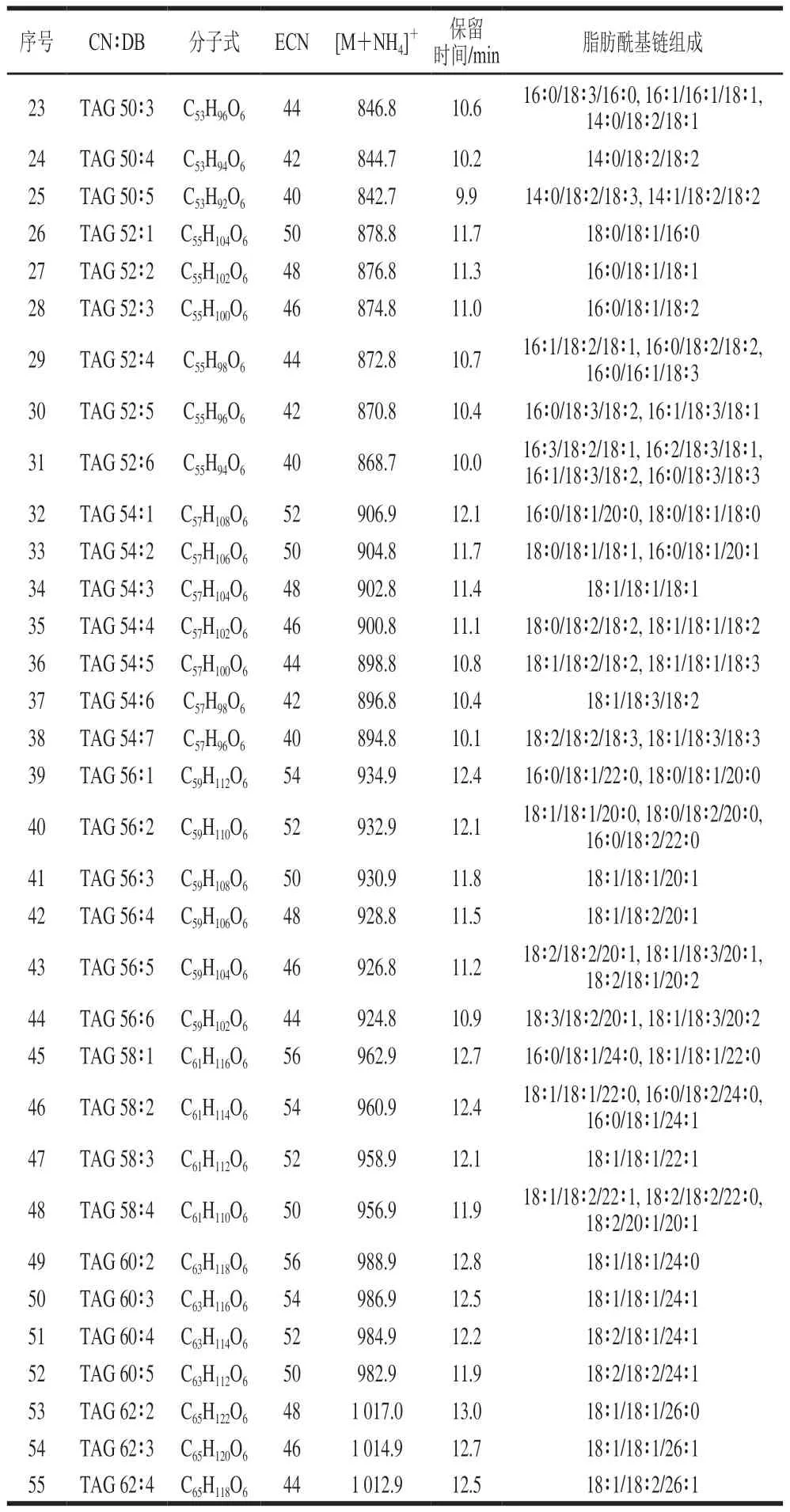
续表2
2.2 甘油酯的相对含量
在压榨和浸出油茶籽油中均检测到55 种甘油酯分子,未观察到压榨和浸出油茶籽油中甘油酯分子组成的明显差异。同一类脂质之间的质谱离子化和质谱响应具有相似性和可比性,因此甘油酯分子的峰面积可代表其在食用油的含量。通过PeakView 2.2软件的MasterView插件提取每个甘油酯分子的峰面积,并计算甘油酯的相对含量,进一步比较压榨和浸出油茶籽油中甘油酯分子相对含量的差异。
在本实验中观察到无论是压榨油茶籽油还是浸出油茶籽油,甘油三酯都是主要成分,相对含量远高于甘油二脂。相比于浸出油茶籽油,压榨油茶籽油中甘油三酯的相对含量更高,而甘油二酯的相对含量较低。压榨和浸出油茶籽油中甘油三酯的相对含量存在极显著差异(P<0.01),分别为(98.58±0.45)%和(97.94±0.45)%,甘油二酯的相对含量存在极显著差异(P<0.01),分别为(1.42±0.45)%和(2.06±0.45)%。压榨和浸出油茶籽油中最主要的5 种甘油酯相同,依次为TAG 54∶3、TAG 52∶2、TAG 54∶4、TAG 52∶3和TAG 54∶2,这些甘油酯的脂肪酰基链都有1~3 条是油酸(C18∶1)。而且脂肪酰基链均为油酸的TAG 54∶3是压榨和浸出油茶籽油中最主要的甘油酯,相对含量均超过了30%,压榨和浸出的相对含量差异不显著(P>0.05)。据报道油茶籽油中的油酸占总脂肪酸含量的74%~87%[27],本实验从甘油酯的脂肪酰基链组成出发,解析了油茶籽油中油酸在甘油酯上的分布。
2.3 甘油酯的化学计量学分析
使用UPLC-QTOF-MS技术鉴定到55 种甘油酯,需要对多维的数据矩阵进行降维分析,建立判别模型对压榨油茶籽油和浸出油茶籽油进行鉴别。不同变量之间往往具有非常大的差异,因此为调整相关变量的权重,使用Pareto scaling对数据进行缩放。佩尔托标度是先将数据中心化处理后,以数据的方差平方根为缩放权重进行缩放。R2X和R2Y分别代表矩阵X和矩阵Y的方差分数。模型解释度(R2)和预测度(Q2)的值越大(接近1),表明模型的解释能力和预测能力越好[28]。一般要求,Q2大于0.9说明模型优秀,Q2大于0.5说明模型比较好,R2和Q2值的差值不超过0.2~0.3[29]。
PCA模型是将原始的多维变量按一定权重组合产生新的主成分,PCA得分图体现样本之间的离散和聚集趋势。首先将压榨油茶籽油和浸出油茶籽油的55 种甘油酯用于无监督的PCA建模。依据甘油酯的组成,压榨油茶籽油和浸出油茶籽油在PCA模型的PC1和PC2上聚集成不同的2 类(图1A),所有样本都在95%的置信区间内,R2X和Q2分别为0.964和0.861。所有质控样本在PCA得分图上紧密聚集在一起,而且同一个样本的3 个重复也紧密聚集在一起,说明数据稳定可靠。Hotelling'sT2和DMod未观察到异常样本。这些结果表明压榨油茶籽油和浸出油茶籽油的55 种甘油酯的组成差异,可以区分压榨和浸出油茶籽油。
采用有监督的OPLS-DA进行判别分析,以最大程度地提高组间差异,突出关键变量和潜在标志物。浸出油茶籽油和压榨油茶籽油在OPLS-DA得分图上聚集成2 类(图1B)。OPLS-DA模型的R2X=0.643,R2Y=0.942,Q2=0.926,R2Y和Q2差值为0.016,表明模型的解释能力和预测能力非常优秀。由于本研究数据具有高维度和小样本的特性,有监督的判别模型容易出现过拟合的现象。因此为验证模型的可靠性进行置换检验(图2),将X矩阵固定不变,随机改变Y矩阵,重新建立OPLS-DA模型并计算R2和Q2。R2和Q2回归线的斜率越大,与y轴的截距越小,最右端的OPLS-DA判别模型的R2和Q2值大于随机改变Y矩阵计算的R2和Q2值(原始模型的解释能力和预测能力大于随机改变Y矩阵的模型),说明判别模型没有过拟合[29]。OPLS-DA模型经200 次置换检验,R2截距为0.132,Q2截距为-0.402,表明该模型拟合优秀未出现过拟合,可以准确预测压榨和浸出油茶籽油。
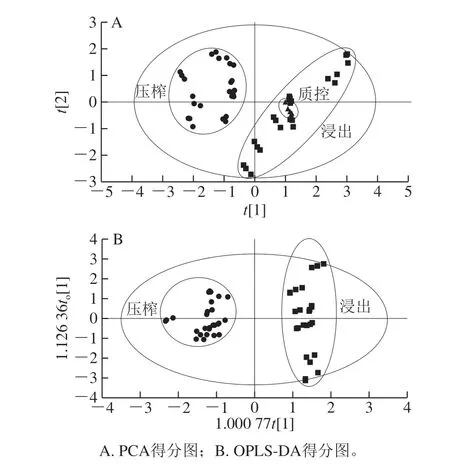
图1 压榨油茶籽油和浸出油茶籽油中55 种甘油酯的化学计量学分析Fig. 1 Chemometric analysis of 55 glycerides in pressed camellia oil and extracted camellia oil
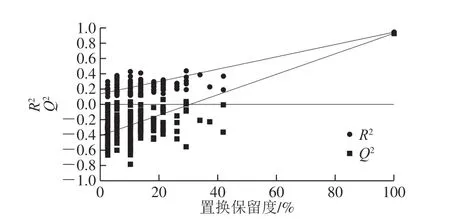
图2 压榨油茶籽油和浸出油茶籽油OPLS-DA判别模型的200 次置换检验结果Fig. 2 Results of 200 permutation tests of pressed camellia oil and extracted camellia oil with OPLS-DA
3 讨论与结论
本研究采用UPLC-QTOF-MS技术分离和检测油茶籽油中的甘油酯,分析了压榨油茶籽油和浸出油茶籽油中脂质的分子种类、脂肪酰基链组成、相对含量的差异,并结合化学计量学分析建立区分压榨和浸出油茶籽油的判别模型。共鉴定到55 种甘油酯分子,包括43 种甘油三酯和12 种甘油二酯。田潇潇等[30]采用高效液相色谱-四极杆/线性离子阱质谱技术在15 个不同物种/品种油茶果实中检测到24 种甘油三酯,此外Zeb等[31]在油茶籽油中检测到15 种甘油三酯。而本研究发现了许多之前没有在油茶籽油中报道过的甘油酯分子,说明UPLC-QTOF-MS技术结合IDA扫描具有更高的质量精确度、灵敏度和宽的动态范围,根据精确质量数(m/z)和二级谱图(MS/MS)有助于分析和鉴定更多的甘油酯分子,对区分浸出和压榨油茶籽油提供大量甘油酯分子组成信息。通过分析甘油酯的脂肪酰基链组成,发现单个甘油酯分子(m/z相同的甘油酯)的脂肪酰基链存在多种可能的组成,以本研究的技术难以实现脂肪酰基链异构的完全分离。例如依据二级质谱图的碎片离子峰推测甘油酯分子的脂肪酰基链组成,发现TAG 54∶4分子可能同时存在2 种脂肪酰基链组成:18∶0/18∶2/18∶2和18∶1/18∶1/18∶2。大白菜叶片的甘油酯分子也存在这一现象,郑姝宁等[32]采用UPLC-QTOF-MS技术在大白菜叶片中鉴定到甘油酯多达65 种,而且发现许多甘油酯分子的脂肪酰基链存在多种组成。甘油酯分子的脂肪酰基链位置、长度和不饱和度差异,以及双键的顺反异构和脂肪酰基链位置异构,使得甘油三酯的物理化学性质多样、结构复杂,而且不同甘油酯分子的含量差异巨大,跨越几个数量级。但这对开发具有更强分离能力的技术,以解析油茶籽油甘油酯异构体的营养品质和生物功能提供了理论依据。压榨油茶籽油和浸出油茶籽油中最主要甘油酯的相对含量并没有显著差异,但结合化学计量学分析可以有效区分压榨和浸出油茶籽油。
结果表明采用UPLC-QTOF-MS技术的脂质组学分析方法,可快速和准确地分析食用油甘油酯分子组成,结合化学计量学分析建立多元统计学分析模型,为分析不同加工工艺油茶籽油的脂质组成提供了强大的分析平台,对维护油茶籽油产业健康发展、保障消费者权益提供了强大的技术支撑。

