传统发酵泡菜中乳酸菌种群组成及优良菌株产酸耐酸特性分析
罗 强,李幸洋,陈炼红,张 明,刘 巧,张大伟,罗 璠,*
(1.西南民族大学生命科学与技术学院,青藏高原动物遗传资源保护与利用国家教育部重点实验室,四川 成都 610041;2.西南民族大学青藏高原研究院,四川 成都 610041)
发酵蔬菜是以乳酸菌主导厌氧发酵而生产加工的传统食品[1],在我国有悠久的历史。常见的发酵蔬菜制品包括咸菜、泡菜、酱菜等。蔬菜经过发酵处理后,不仅能延长新鲜蔬菜的贮藏期[2],还能改善风味,增进食欲,提升蔬菜的营养价值[3],同时也具有降低血清胆固醇、调节肠道菌群、抗氧化等[4-6]保健作用。在我国北方地区,以新鲜白菜为主要材料,用盐水长时间腌渍而成的发酵泡菜,是当地居民主要的手工自制发酵食品之一。
自制发酵蔬菜多数采用天然接种,由乳酸菌、酵母菌、醋酸菌等多菌种混合发酵而成,其中乳酸菌起到重要作用。前期研究表明,成品北方泡菜中含有丰富的乳酸菌资源,涉及十多个属一百多个种,其中以乳杆菌属最为丰富[7]。蔬菜在发酵过程中也表现出明显的菌群更替现象,多数研究表明发酵前期以肠膜明串珠菌为优势菌群,后期以短乳杆菌和植物乳杆菌为优势菌[8-9],乳杆菌属作为终止发酵的主要菌群使得发酵蔬菜快速成熟,其中蕴含大量的产酸耐酸优质菌种。金成武等[10]从市售泡菜中筛选到1 株植物乳杆菌Q2,其24 h发酵液pH值达到3.79;王惋等[11]从黑龙江农户家中所发酵的自然泡菜中,以pH 3.0为筛选条件筛选了一批酸耐受性良好的乳酸菌株。这些产酸和耐酸性能优良的菌株在各个领域均能得到广泛应用:在食品行业中,菌株较强的发酵产酸能力能够显著缩短工业化发酵进程,提升生产效率,含有强耐酸性乳酸菌的发酵食品经食用后能够耐受酸性的肠胃环境,更利于发挥乳酸菌的益生性质;在饲料行业中,产酸和耐酸性能优异的乳酸菌株能够制作益生菌饲料,经动物食用并定值后,产生的代谢物能更好抑制肠道内病原菌,调节肠道菌群,提升动物免疫力[12],对于动物生长性能也有较大提升[13]。因此,筛选具有优质产酸耐酸性能的乳酸菌株具有较明显的应用价值。
本研究通过对来自辽宁、河南、吉林及内蒙古自治区等不同地区采集的20 份泡菜样品进行乳酸菌的分离与鉴定,研究不同地区泡菜中微生物菌群的多样性,通过产酸、耐酸实验,筛选一批产酸和耐酸能力优异的菌株,以期为食品及饲料添加剂中优质乳酸菌资源的开发提供后备菌种。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
样品分别来自辽宁、河南、吉林和内蒙古自治区4 个地区使用当地传统工艺制作而成的自然发酵农家泡菜,每个地区采集5 份样品,共计20 份样品。
1.1.2 培养基与试剂
MRS肉汤培养基和BCP产酸菌计数培养基购自青岛海博生物技术有限公司,向MRS肉汤培养基中加入1.5%琼脂制成培养平板用于菌株分离纯化。
2×Taq Master Mix 即用型聚合酶链式反应(polymerase chain reaction,PCR)预混液 康润生物科技有限公司;1×TE缓冲液(10 mmol/L Tris-HCl、1 mmol/L乙二胺四乙酸,pH 8.0);引物Eu27F、1495R、rpoA-21-F和rpoA-23-R由生工生物工程(上海)股份有限公司合成;SuperRed/GelRed核酸染料 北京白鲨易科技有限公司;胃蛋白酶(酶活力10 000 U/g)美国Sigma公司。所有试剂均为分析纯。
1.2 仪器与设备
ST16R高速冷冻离心机、NanoDrop2000微量核酸测定仪 赛默飞世尔科技有限公司;GH6000电热恒温培养箱天津泰斯特设备有限公司;ETC811 PCR仪 北京东胜创新生物科技有限公司;Tanon2500凝胶成像系统中国天能公司;Vortex-BE1旋涡混合器 江苏其林贝尔仪器制造有限公司;UV1900紫外-可见分光光度计 上海佑科仪器仪表有限公司;R40-IIB2超净工作台 中国青岛海尔有限公司;雷磁PHSJ-3F精密pH计 上海精密科学仪器有限公司;GI54DW高压蒸汽灭菌锅 厦门致微仪器有限公司;AE-30生物显微镜 麦克奥迪有限公司。
1.3 方法
1.3.1 泡菜样品采集
选取发酵后期且风味良好的农家天然发酵泡菜,将罐中蔬菜与汁液充分摇晃混匀后,用无菌移液器吸取适量泡菜汁液转移至灭菌采样瓶中,置于冰上低温存放并转运至实验室。
1.3.2 泡菜样品中产酸菌的计数和分离
充分振荡采样瓶,吸取10 mL泡菜汁加入含有90 mL 0.85%(V/V)无菌生理盐水的三角瓶中充分混匀,采用10 倍梯度稀释法对样品进行稀释,吸取10-4~10-7稀释度的稀释液100 μL涂布于BCP固体培养基中,每个稀释度重复3 次,37 ℃培养24~48 h。选取菌落数适宜的稀释度平板,对产生黄色圈的菌落进行计数。
1.3.3 乳酸菌的纯化
挑取产生黄色圈的菌落于MRS固体平板上进行多次平板划线培养直至得到单菌落,挑取单个菌落进行过氧化氢酶实验和革兰氏染色。凡革兰氏染色阳性、过氧化氢酶阴性的菌株作为疑似乳酸菌,增菌培养后于-20 ℃冻存于含有体积分数25%甘油的MRS培养基中[14]。
1.3.4 16S rDNA基因同源性分析
疑似乳酸菌株经活化后使用微波提取法[15]抽提总DNA 并扩增其16SrDNA 基因序列。16SrDNA 扩增引物:正向引物EU 27 F:5’-AGAGTTTGATCCTGGCTCAG-3’;反向引物1495R:5’-CTACGGCTACCTTGTTACGA-3’[16]。PCR扩增体系(25 μL):上下游引物各2 μL(10 pmol/μL),模板DNA(100 ng/μL)1 μL,无菌双蒸水7.5 μL,2×TaqPCR MasterMix预混酶12.5 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸2 min,循环30 次;72 ℃延伸10 min,4 ℃保温备用[17]。PCR产物经1%琼脂糖凝胶电泳检测合格后,由生工生物工程(上海)股份有限公司完成序列测定。将所得序列在NCBI数据库中利用BLAST工具与GenBank数据库中已知菌株的16S rDNA基因序列进行比对鉴定。当序列相似度达到97%时,判定为同一个属,而序列相似度达到99%时,则判定为同一个种[18]。其中对于基因序列高度相似的肠球菌属只鉴定至属水平,后续待筛选得到优良菌株后对其种属做进一步鉴定。
1.3.5 产酸能力初步筛选
将已鉴定种属的乳酸菌株37 ℃活化培养18 h后,以2%接种量接种到MRS液体培养基(pH 6.50)中,37 ℃静置培养24 h,测定发酵液pH值。
1.3.6 产酸特性分析[19]
选取1.3.5节筛选得到的发酵液pH值低于4.0的乳酸菌株,37 ℃活化18 h,6 000 r/min离心10 min得到菌体,使用0.9%无菌生理盐水重悬并调节菌液浓度为1.0×108CFU/mL,以2%接种量接种于100 mL MRS液体培养基(pH 6.50)中于37 ℃培养,在第2、4、6、8、10、12、18、24小时测定发酵液pH值并绘制变化曲线。
1.3.7 乳酸菌株的耐酸能力测定
参照中国药典配制人工胃液[20],菌株耐酸能力测定参照文献[21]并加以修改,挑取产酸性能较好的乳酸菌株活化18 h,吸取菌液10 mL于离心管中,6 000 r/min离心10 min后弃上清液,用无菌生理盐水洗涤2 次,在菌体中加入10 mL人工胃液,旋涡混匀后于37 ℃、200 r/min摇床温浴,在0 h和3 h测定人工胃液处理前后的活菌数量,根据下式计算菌株存活率:

式中:N1为经过人工胃液处理后乳酸菌数量;N0为人工胃液处理前的乳酸菌数量。
1.3.8 肠球菌属菌株rpoA管家基因的序列同源性分析
通过16S rDNA序列测定不能准确区分肠球菌的种类,因此使用管家基因rpoA(RNA polymeraseα-chain)对耐酸性能优异的肠球菌属乳酸菌进一步分类鉴定,引物序列、退火温度及扩增位点见表1。

表1 管家基因rpoA的引物序列和退火温度Table 1 Primer sequences and annealing temperatures for rpoA used in this study
PCR扩增体系:基因组DNA 1 μL,2×TaqMaster Mix预混酶12.5 μL,正反引物各1 μL,无菌双蒸水7.5 μL。PCR扩增程序:95 ℃预变性5 min,3 次循环(95 ℃变性60 s,46 ℃退火75 s,72 ℃延伸75 s),30 次循环(95 ℃变性35 s,48 ℃退火75 s,72 ℃延伸75 s),72 ℃延伸7 min,4 ℃保存备用[23]。取5 μL扩增产物在1.5%琼脂糖凝胶上电泳检测扩增产物大小。序列测定、同源性分析以及系统发育树构建参照步骤1.3.4节进行。
1.4 数据处理与分析
2 结果与分析
2.1 不同地区泡菜汁中产酸菌的分离与计数
通过BCP平板对4 个不同地区来源的样品中产酸菌数量进行计数,结果如表2所示。不同来源的样品中产酸菌数量具有一定差别,其中来源于吉林省的5 份样品平均产酸活菌数明显高于其他地区,前期测定结果也显示吉林样品的pH值最低。

表2 不同地区来源的发酵泡菜中产酸菌数量Table 2 Number of lactic acid bacteria in traditional pickles from different regions
2.2 16S rDNA序列鉴定与菌群组成
采用微波法提取菌株基因组DNA后经微量核酸检测仪检测,得到DNA的OD260nm/OD280nm在1.8~2.1之间,符合扩增模板要求。将DNA质量浓度调节至100 mg/L作为扩增模板,对16S rDNA基因序列进行PCR扩增。扩增产物使用1%琼脂糖凝胶电泳对扩增产物检测。如图1所示,各泳道在1 500 bp左右位置出现明显可见的亮带,无明显非特异性扩增现象,符合测序要求。
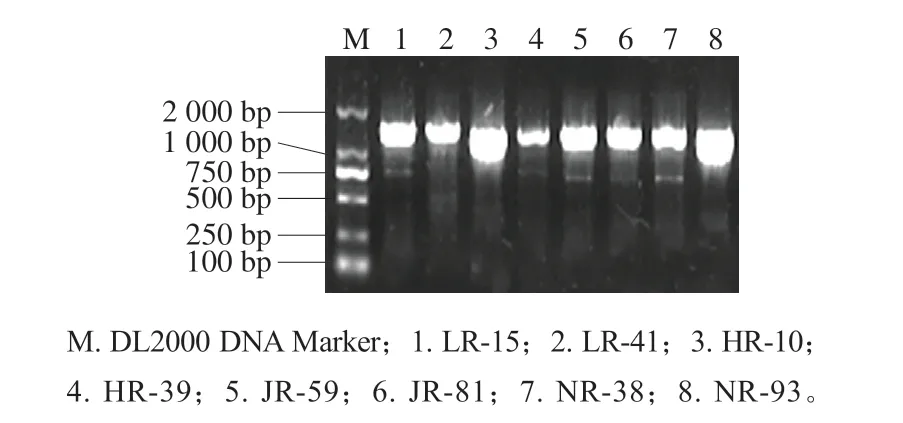
图1 部分乳酸菌株的16S rDNA PCR扩增产物凝胶电泳图Fig. 1 Electrophoresis of PCR amplification products of 16S rDNA of selected strains of lactic acid bacteria
经过16S rDNA序列分析和BLAST同源性比对,20 份样品中共分离出4 个乳酸菌属共计435 株菌。在所有分离株中,乳杆菌属(Lactobacillus)6 个种共394 株(占总菌数的90.57%),占据了分离株的绝对比例,肠球菌属(Enterococcus)共计38 株(占总菌数的8.74%),另外还从辽宁和河南地区样品中各分离得到2 株肠膜明串珠菌(Leuconostoc mesenteroides)和1 株暹罗片球菌(Pediococcus siamensis)。

图2 不同地区泡菜源分离出的乳酸菌多样性Fig. 2 Diversity of lactic acid bacteria isolated from pickles from different areas
根据各地区泡菜发酵后期的乳酸菌菌群组成情况建立了乳酸菌多样性柱状堆积图。如图2所示,辽宁和河南地区的泡菜样品中菌群组成最为丰富,共分离出6 种乳酸菌,吉林次之(4 种),而内蒙古地区只分离出3 种乳酸菌,其乳酸菌群丰富度明显少于其他地区。4 个地区样品中均分离得到短乳杆菌(L. brevis)、植物乳杆菌(L. plantarum)和肠球菌属。其中短乳杆菌在4 个地区的样品中均占据最大比例,在各地区所占比例在58.59%~82.61%之间,是发酵后期泡菜中的优势菌群,与前期研究一致[24-25]。另外肠球菌属在4 个地区的样品中均有检出,与相关报道相似[26-27],但不同的是本研究筛选到的肠球菌属除在吉林来源的样品中含量较高,占据其总分离株的22.22%外,在其他3 个地区的样品中含量均较低,不属于优势菌群,且它们均是在成熟泡菜中筛选得到,说明耐酸能力较强。有研究表明[28],泡菜中的肠球菌属具有较为出色的亚硝酸盐降解能力和抗氧化能力,能够控制发酵泡菜中的亚硝酸盐含量,对提高发酵泡菜的益生性都有明显的作用。
本研究显示4 个不同地区的泡菜中优势菌群比较一致,但菌群组成上有较为明显的差别,该结果与李欣[29]、孙慧君[30]等的研究结果相似。这可能与泡菜加工时的外界因素,如温度、盐度、工艺、品种等有关[31]。
2.3 高产酸菌株筛选结果
产酸能力是乳酸菌活力良好的重要特征之一,测定435 株已鉴定乳酸菌株发酵24 h的发酵液pH值,结果如图3所示。435 株乳酸菌中,24 h发酵液pH值集中在3.50~5.00之间,其中pH值在4.00~4.50之间的菌株最多,pH值在3.50~4.00之间有87 株,另外只有11 株菌的24 h发酵液pH值低于3.5。在24 h发酵液pH值低于4.0的98 株菌中,乳杆菌属约占94.9%。

图3 全部乳酸菌株24 h发酵液pH值分布情况Fig. 3 Grouping of 435 strains of lactic acid bacteria by pH after 24 h culture
2.4 产酸曲线
根据产酸初筛结果,选取所有发酵液pH值低于4.0的乳酸菌株于37 ℃培养24 h,测定产酸曲线。结果显示,多数菌株在培养前期pH值均快速下降,在12 h左右pH值变化减缓,24 h的终pH值在3.3~4.0之间。通过测定所有98 株菌产酸曲线发现,肠膜明串珠菌LR-90和短乳酸杆菌NR-20的产酸能力最强。最终挑选出29 株产酸快、终pH值低于3.6的菌株用于后续耐酸实验。其中有17 株来源于吉林地区,图4为部分菌株的产酸曲线。

图4 菌株24 h的产酸曲线Fig. 4 Acid production curves of six selected strains over 24 h
2.5 耐酸菌株的筛选结果
将29 株高产酸乳酸菌在pH 2.0模拟人工胃液环境下孵育3 h进行耐酸实验,结果显示,菌株的存活率范围为0%~93%,呈现了较大的差异。存活率在70%以上的乳酸菌共9 株,如表3所示,占高产酸总菌数的22.5%,其中植物乳杆菌NR-11和LR-13、棒状乳杆菌LR-43的存活率在90%以上,表现出对模拟胃酸较强的耐受性。
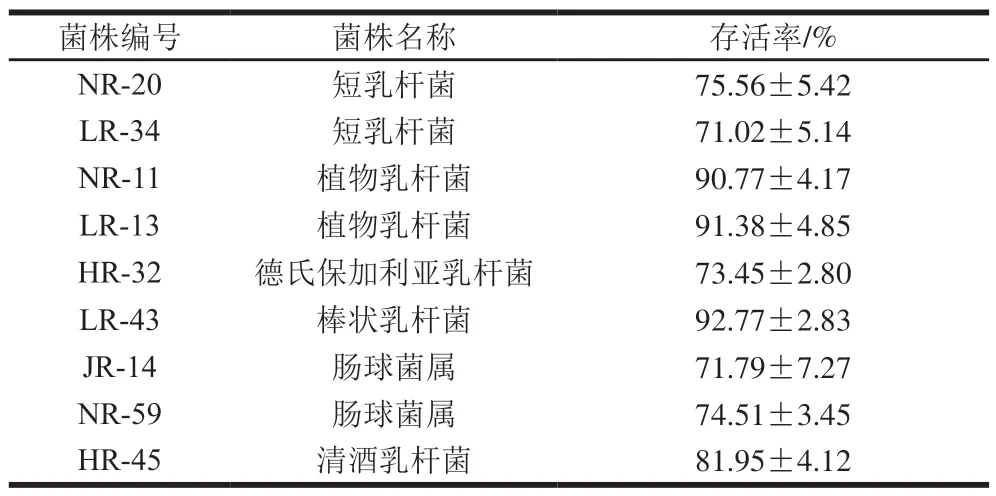
表3 pH 2.0模拟胃液环境下菌株的存活率Table 3 Effect of simulated gastric fluid at pH 2.0 on survival rate of 29 acid-producing strains of lactic acid bacteria
结合产酸实验发现,产酸能力较强的LR-90,耐酸能力不表现明显增强,在人工胃液处理3 h后,存活率不到70%,而耐酸能力较强的NR-11、LR-13、LR-43产酸能力并不具有明显优势,这与林龙镇等[32]的研究一致。因此,菌株产酸能力与耐酸能力之间有否相关性还有待深入探讨。
2.6 rpoA基因同源性分析
由于在耐酸性实验中,2 株肠球菌属菌株JR-14和NR-59的存活率较高,也体现出较强的研究价值,因此通过rpoA管家基因测序将其鉴定至种水平。根据rpoA基因序列测序结果,菌株NR-59和JR-14菌株E. faeciumSRCM103470的rpoA基因序列同源性分别为100%和99.83%,图5展示了通过rpoA管家基因序列所构建的系统发育树。结合16S rDNA序列和2 株肠球菌属乳酸菌在rpoA管家基因系统发育树中的位置,确定了2 株菌为屎肠球菌(E. faecium)。
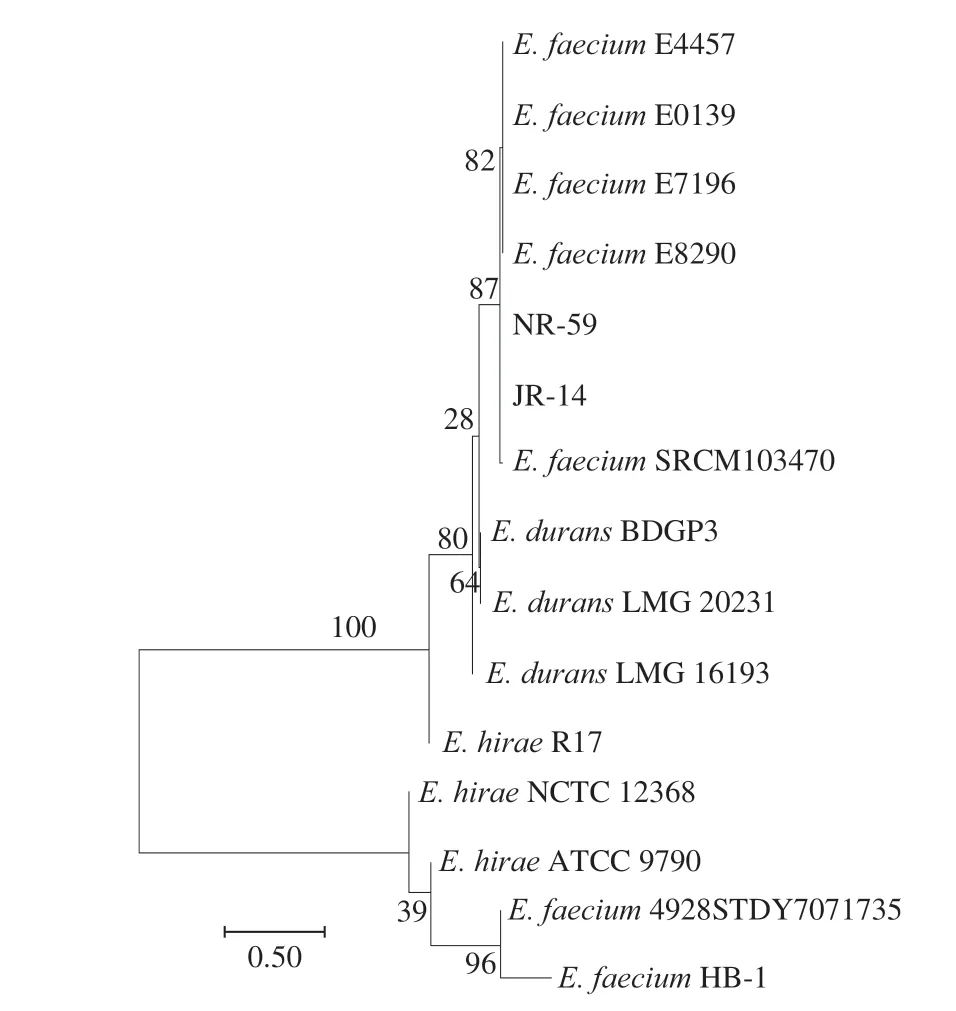
图5 2 株肠球菌属乳酸菌rpoA序列的系统发育树Fig. 5 Phylogenetic tree based on rpoA sequences of two strains of Enterococcus
3 结 论
采用BCP产酸培养基对北方4 个不同地区来源的20 份泡菜样品进行菌种筛选和计数,初步分离得到435 株疑似乳酸菌,经过16S rDNA序列同源性分析,共得到乳杆菌属6 个种共394 株,肠球菌属共38 株,2 株肠膜明串珠菌和1 株暹罗片球菌。
4 个地区泡菜样品中乳酸菌群在种水平上表现出地区差异性,来源于辽宁和河南地区的泡菜样品乳酸菌多样性较高,来源于吉林的样品中产酸菌最多,以乳杆菌属为代表的乳酸菌群主导了各地区发酵蔬菜的成熟,其中以短乳杆菌所占比例最高,是各地区泡菜中的最优势菌种。
进一步对435 株乳酸菌产酸初筛和产酸曲线测定,以及在pH 2.0人工胃液下进行耐酸性实验,最终筛选得到9 株产酸和耐酸性质优良的乳酸菌株,其中包括7 株乳杆菌和2 株肠球菌,通过rpoA管家基因序列对肠球菌进一步鉴定,发现2 株肠球菌均为屎肠球菌。本实验筛选得到的9 株乳酸菌产酸耐酸能力强,是进一步深入研究与应用的备选菌株。

