重组大肠杆菌全细胞催化D,L-扁桃酸对映选择性制备L-苯甘氨酸
贾园园,李 祥,张振华,张 闪,杨露露,唐存多,2,*
(1.南阳师范学院 昆虫生物反应器河南省工程实验室,河南省南水北调中线水源区生态安全重点实验室,河南 南阳 473061;
2.车用生物燃料技术国家重点实验室,河南 南阳 473061)
L-苯甘氨酸是一种高值的非天然芳香族α-氨基酸,是合成食品添加剂和药物中间体重要的手性砌块[1-2]。L-苯甘氨酸及其衍生物是合成紫杉醇[3]、β-内酰胺类抗生素[4]及重磅炸弹药物——氯吡格雷的重要中间体[5]。随着化工技术的不断发展,L-苯甘氨酸的化学合成工艺已非常成熟。但其传统的合成过程所使用的氰化物或强碱,对工人的安全威胁较大,且对环境极不友好[5]。此外,化学合成L-苯甘氨酸的对映选择性较差,增大了后续纯化精制的成本。与传统的化学合成相比,新型的生物合成具有手性选择性强、反应条件温和、环境友好及对设备要求低等优势[6],随着环境问题日益突出,绿色、环保的生物合成更受关注和青睐[7-10]。近年来,关于苯甘氨酸生物合成研究较多的主要有苯海因酶转化法[11]、D-苯甘氨酸氨基转移酶法[12]和氨基酸脱氢酶法[13]等。然而,它们仍存在一定的缺陷,例如需要硫酸辅助[11]、催化活性低[12]或需要额外的辅酶循环系统[13]等。因此,开发转化率高、对映选择性好、成本低廉且环境友好的L-苯甘氨酸生物合成工艺具有重要的学术意义和应用前景[14]。
扁桃酸消旋酶(mandelate racemase,MR)能够催化扁桃酸消旋反应[15-17],D-扁桃酸脱氢酶(D-mandelate dehydrogenase,DMDH)能选择性地催化D-扁桃酸脱氢氧化[18-19],而L-亮氨酸脱氢酶(L-leucine dehydrogenase,L-LeuDH)能催化苯乙酮酸的胺化还原[20-21],它们在L-苯甘氨酸生物合成中有巨大的应用潜力。在前期研究中,本团队成功以DMDH和L-LeuDH为核心催化剂,构建了能够实现辅酶内循环的级联反应体系,基于辅酶内循环,在不引入辅底物及额外催化剂的前提下,实现了L-苯甘氨酸的高效生物合成。200 mmol/L的D-扁桃酸在合适条件下反应12 h,L-苯甘氨酸的得率可达98%,且对映体过量值(enantiomeric excess,e.e.)大于98%[7]。目前,生物催化常用的催化剂主要有酶、细胞器和微生物细胞[6],这3 种催化剂各有优势。其中,全细胞催化具有独特的优势,尤其是在有氧化还原反应参与的生物催化过程中,以微生物细胞作为催化剂进行催化反应可以利用细胞体内的辅酶循环系统,不需要额外添加辅酶;同时,以全细胞作为生物催化剂能够提高催化剂的稳定性,减少催化剂的用量[22-24],且便于催化剂使用后的回收利用以及后续与产物的分离,能降低催化剂的使用成本及后续的分离成本[25]。迄今为止,全细胞催化技术用于工业化生产的案例也越来越多[26-28]。
本研究拟参照图1 的合成路线, 考察携带Agrobacterium radiobacter来源MR(ArMR)、Lactobacillus harbinensi来源DMDH(LhDMDH)和Exiguobacterium sibiricumDSM 17290来源LeuDH(EsLeuDH)编码基因的重组大肠杆菌全细胞,对D,L-扁桃酸的转化情况,并对产物进行分离和鉴定,为实现L-苯甘氨酸规模化的生物合成奠定坚实的基础。
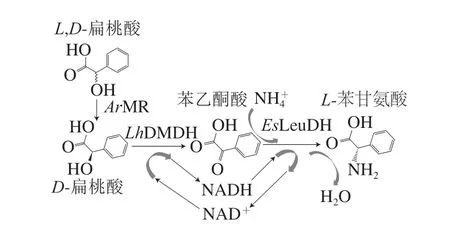
图1 全细胞催化生成L-苯甘氨酸的流程图Fig. 1 Flow chart showing whole-cell catalytic production of L-phenylglycine
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
底物D,L-扁桃酸、L-苯甘氨酸标准品 上海阿拉丁生化科技股份有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG) 生工生物工程(上海)股份有限公司;甲醇(色谱纯) 天津市科密欧化学试剂有限公司;氘代二甲亚砜 上海麦克林生化科技有限公司;NAD+深圳邦泰生物工程有限公司;其他试剂均为分析纯。
1.1.2 菌株、质粒和培养基
Escherichia coliBL21(DE3)、携带LhDMDH基因的重组大肠杆菌E. coliBL21(DE3)/pET28a-LhDMDH[7]和ArMR基因的重组大肠杆菌E. coliBL21(DE3)/pET28a-ArMR菌株[1]由本课题组构建和保藏;携带EsLeuDH基因的重组大肠杆菌E. coliBL21(DE3)/pETDuet-1-EsLeuDH[21]由许建和教授馈赠。共表达质粒pACYCDuet-1购自美国Invitrogen公司。LB培养基:10 g/L蛋白胨、10 g/L氯化钠和5 g/L酵母提取物,自然pH值,121 ℃灭菌20 min,用于大肠杆菌的培养。
1.2 仪器与设备
核酸电泳仪 北京市六一仪器厂;蛋白电泳仪美国Bio-Rad公司;EC 2006型高效液相色谱(high performance liquid chromatography,HPLC)系统 大连依利特分析仪器有限公司;Hypersil C18柱、LTQ Orbitrap XL高分辨质谱系统 美国Thermo Scientific公司;Chirobiotic T手性柱 美国Merck公司。
1.3 方法
1.3.1 重组大肠杆菌的构建
分别将质粒pETDuet-1-EsLeuDH和pACYCDuet-1用限制性内切酶EcoR I和Hind III双酶切,酶切产物经琼脂糖凝胶电泳分离后,用割胶回收试剂盒回收酶切后的EsLeuDH和pACYCDuet-1,用DNA连接试剂盒连接后转化E. coliBL21感受态细胞,经氯霉素抗性筛选、菌落聚合酶链式反应(polymerase chain reaction,PCR)检测、双酶切鉴定及测序鉴定后获得E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH重组菌。再分别将pET28a-LhDMDH和pACYCDuet-1-EsLeuDH用NdeI和XhoI进行双酶切,酶切产物经琼脂糖凝胶电泳分离后,用割胶回收试剂盒回收酶切后的LhDMDH和pACYCDuet-1-EsLeuDH,用DNA连接试剂盒连接后转化E. coliBL21(DE3)感受态细胞,经氯霉素抗性筛选、菌落PCR检测、双酶切鉴定及测序鉴定后获得E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH重组菌。最后,将pET28a-ArMR质粒转化至E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH感受态细胞,经卡拉霉素和氯霉素双抗性筛选,获得E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH:pET28a-ArMR重组菌。
将上述重组菌连续在无抗LB培养基上传代10 次,然后接种至含卡拉霉素和氯霉素的LB培养基上培养,观察的生长情况,通过双重抗性筛选考察重组菌携带质粒的遗传稳定性[1]。
1.3.2 重组大肠杆菌的诱导表达
授课教师要根据评价结果进行充分的分析、讨论,如果课程达成度高于要求值,说明该课程可以实现对指标点的支撑,如果课程达成度低于要求值,教师需要改进教学方法和教学水平。专业负责人要根据毕业要求达成度进行研究,如果个别指标点达成度低于要求值,需要与相关教师尤其是勉强支撑课程的教师沟通,帮助教师提高教学水平,如果总的毕业要求达成度低于要求值,需要对课程体系进行修订。
重组大肠杆菌的诱导表达采用低温、低诱导剂浓度的诱导策略进行。分别将E. coliBL21(DE3)/pACYCDuet-1和E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH:pET28a-ArMR单菌落接种至4 mL LB液体培养基中,37 ℃、200 r/min培养14 h,2%接种量转接至100 mL新鲜LB液体培养基中,37 ℃、200 r/min培养2.5 h,加入1 mol/L IPTG至终浓度为0.1 mmol/L,16 ℃、200 r/min诱导培养20 h;取10 mL菌液于8 000 r/min、4 ℃离心5 min,收集菌体,重悬后进行超声破碎,并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析[29]。
1.3.3 酶活性分析
DMDH氧化活性:以D-扁桃酸为底物,以NADH生成量为标准计算。MR活性:以L-扁桃酸为底物,根据文献[7]用HPLC法测定D-扁桃酸的生成量,以此计算酶的消旋活性。L-LeuDH还原活性:以苯乙酮酸为底物、NADH为辅酶,加上合适的HN4+,30 ℃条件下用紫外分光光度计检测340 nm波长处吸光度的变化量[21]。
1.3.4 重组大肠杆菌全细胞转化D,L-扁桃酸合成L-苯甘氨酸
取50 mL上述诱导后的重组大肠杆菌E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH:pET28a-
ArMR,4 ℃、8 000 r/min离心5 min,收集菌体,重悬于10 mL 500 mmol/L NH4Cl-NH3·H2O缓冲液中(pH 9.5),50 mmol/LD,L-扁桃酸,温度30 ℃,反应48 h后取1 mL转化液于8 800×g离心1 min,取上清液,稀释100 倍后用0.22 μm的滤膜进行过滤,最后用HPLC法检测L-苯甘氨酸含量。
1.3.5L-苯甘氨酸的定性分析
先对产物进行普通C18柱的HPLC分析,HPLC色谱柱为Thermo Hypersil C18柱,检测波长215 nm,柱温30 ℃,流动相为甲醇-水(20∶80,V/V),流速1 mL/min。然后,利用Chirobiotic T手性柱对产物及L-苯甘氨酸标准品进行HPLC分析,流动相为甲醇-水-三氟乙酸(20∶80∶0.1,V/V),流速0.5 mL/min,检测波长254 nm,柱温30 ℃,以此计算产物中L-苯甘氨酸的e.e.值。根据在相同分析条件下,产物在普通Thermo Hypersil C18柱以及Chirobiotic T手性柱中的保留时间,与L-苯甘氨酸标准品的保留时间对比,对产物进行初步的定性分析。最后,将底物和产物委托基云(上海)生物技术有限公司,利用Thermo Scientific LTQ Orbitrap XL高分辨质谱系统进行分析,进一步基于质荷比对其进行定性分析。
1.3.6L-苯甘氨酸的定量分析
将L-苯甘氨酸标准品用超纯水分别配成0.2、0.4、0.6、0.8、1.0 mmol/L的溶液,然后分别取20 μL进行HPLC分析,获得各浓度L-苯甘氨酸的峰面积后,进行线性拟合获得回归方程及相关系数。HPLC色谱柱为Thermo Hypersil C18柱,检测波长215 nm,柱温30 ℃,流动相为甲醇-水(20∶80,V/V),流速1 mL/min。待检样品产物按照同样的条件进行HPLC分析,根据测得的峰面积可以由回归方程计算出相应的样品浓度。
1.4 数据统计及图表绘制
图片均用Adobe Photoshop CS 8.0软件进行色阶、对比度调节及标注等处理,图片中所用的化学式采用ChemDraw Ultra 8.0进行绘制。简单的数据处理及分析均借助Origin 9进行。
2 结果与分析
2.1 重组大肠杆菌的构建
按照1.3.1节方法将质粒pETDuet-1-EsLeuDH和pACYCDuet-1进行双酶切,酶切后的EsLeuDH和pACYCDuet-1经电泳分离和割胶回收,再用DNA连接试剂盒连接后转化E. coliBL21感受态细胞,经氯霉素抗性LB平板筛选获得阳性重组子。挑取阳性重组子用通用引物进行PCR检测,结果如图2A所示,片段长度约1 400 bp,大小与预期相符。进一步提取质粒进行双酶切验证,结果如图2B所示,能够释放出与EsLeuDH长度一致的目的片段(约1 200 bp)。将经PCR检测和酶切验证的重组子送生工生物工程(上海)股份有限公司进行测序,结果表明EsLeuDH的序列及在载体上的插入位置与预期的完全一致,表明成功获得E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH重组菌。
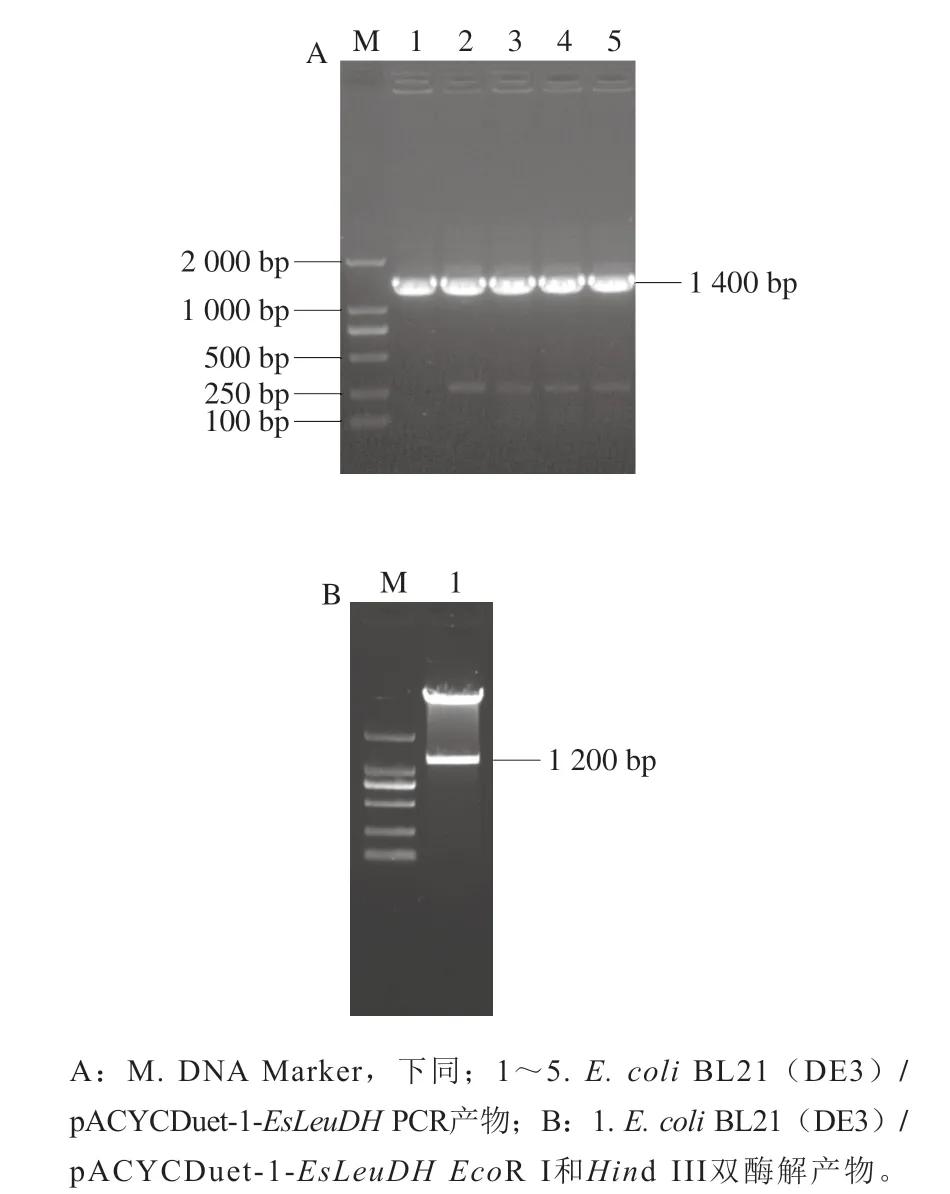
图2 E. coli BL21(DE3)/pACYCDuet-1-EsLeuDH重组子的菌液PCR检测(A)及双酶切验证(B)Fig. 2 PCR detection and double digestion detection of recombinant E. coli BL21(DE3)/pACYCDuet-1-EsLeuDH
同样按照1.3.1节方法将质粒pET28a-LhDMDH和pACYCDuet-1-EsLeuDH进行双酶切,酶切后的LhDMDH和pACYCDuet-1-EsLeuDH经电泳分离和割胶回收,再用DNA连接试剂盒连接后转化E. coliBL21感受态细胞,经氯霉素抗性LB平板筛选获得阳性重组子。挑取阳性重组子用通用引物进行PCR检测,结果如图3A所示,片段长度约1 300 bp,大小与预期相符。进一步提取质粒进行双酶切验证,结果如图3B所示,能够释放出与LhDMDH长度一致的目的片段(约1 100 bp)。将经PCR检测和酶切验证的重组子送生工生物工程(上海)股份有限公司进行测序,结果显示LhDMDH的序列及在载体上的插入位置与预期完全一致,表明成功获得E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH重组菌。最后,将pET28a-ArMR质粒转化至E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH感受态细胞,经卡拉霉素和氯霉素双抗性筛选,获得E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH:pET28a-ArMR重组菌。重组菌连续在无抗LB培养基上传代10 次,接种至含卡拉霉素和氯霉素的LB培养基上培养,生长状况良好,表明该重组菌具有良好的遗传稳定性,携带的双质粒在传代过程不会发生质粒不相容的现象。

图3 E. coli BL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH重组子的菌液PCR检测(A)及双酶切验证(B)Fig. 3 PCR detection and double digestion verification of recombinant E. coli BL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH
2.2 重组大肠杆菌的诱导表达及鉴定
分别将E. coliBL21(DE3)/pACYCDuet-1、E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH和E. coliBL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH:pET28a-ArMR菌株按照1.3.2节方法进行诱导表达,将诱导后的菌液取10 mL离心收集,经重悬和超声破碎后进行SDSPAGE及酶活性分析。如图4所示,E. coli BL21(DE3)/pACYCDuet-1-EsLeuDH-LhDMDH:pET28a-ArMR的裂解上清液在38 kDa和40~43 kDa处有明显的特异性条带,分别与LhDMDH、EsLeuDH[20]和ArMR的理论分子质量一致,表明3 个目标酶均成功实现可溶性表达。结果显示,经换算后,发酵液中的LhDMDH、EsLeuDH和ArMR活性分别为195.8、56.2 U/mL和174.5 U/mL。酶活性测定结果进一步表明,借助双质粒共表达系统,实现了3 个目标酶有活性形式的共表达。
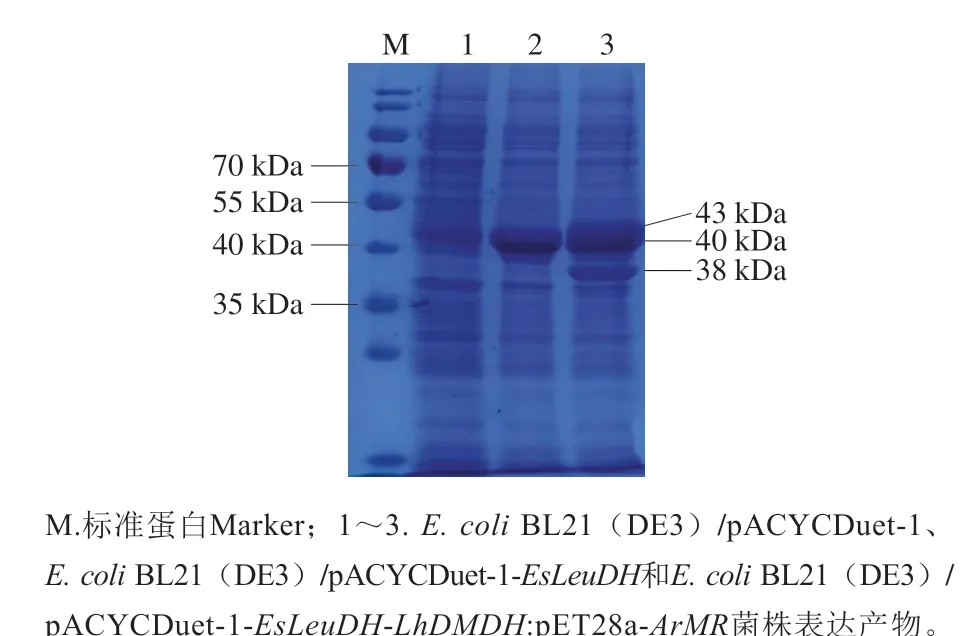
图4 重组大肠菌表达产物的SDS-PAGE分析Fig. 4 SDS-PAGE profile of the expression products of recombinant E. coli
2.3 L-苯甘氨酸标准品及底物的HPLC分析
按照1.3.6节方法,将分析纯的L-苯甘氨酸在Thermo Hypersil C18柱上进行HPLC分析,在该分析条件下,L-苯甘氨酸的保留时间约为3.43 min(图5A),将L-苯甘氨酸不同浓度值对相应的峰面积进行线性拟合,获得的L-苯甘氨酸的标准曲线,得出L-苯甘氨酸浓度对应的回归方程为y=0.000 2x-0.011,相关系数为0.999 0,结果表明在该HPLC分析条件及浓度范围下,L-苯甘氨酸浓度与峰面积呈良好线性相关,因此,利用此法可以对L-苯甘氨酸进行精确定量分析。同样条件下对底物D,L-扁桃酸进行HPLC分析,底物的保留时间约为2.33 min(图5B),这也说明D,L-扁桃酸的极性明显大于L-苯甘氨酸。同时,由于受D,L-扁桃酸极性的影响,且它的pH值比L-苯甘氨酸高,在与L-苯甘氨酸同样的分析条件下不利于其有效分离,因此D,L-扁桃酸的色谱峰始终不能对称(呈三角形)。而这一现象对产物鉴定的影响不大,且在与产物共存时,D,L-扁桃酸的色谱峰反而能呈现较好的对称性。
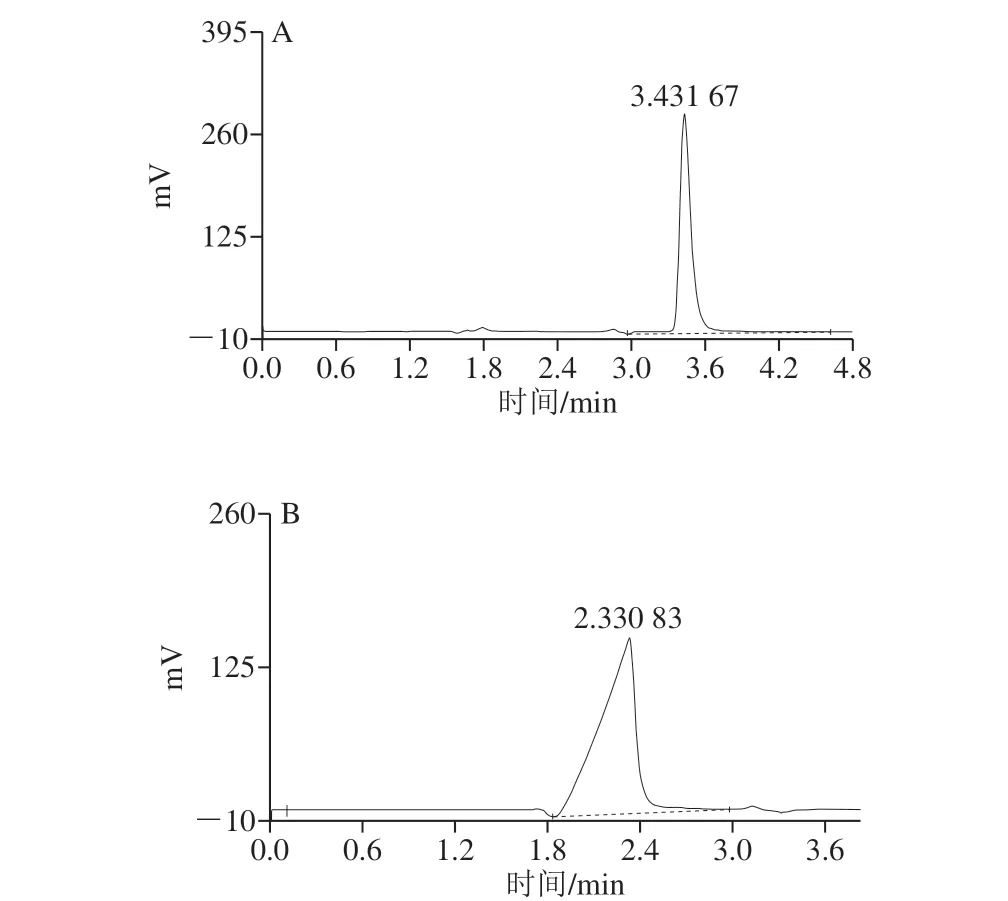
图5 L-苯甘氨酸(A)及D,L-扁桃酸(B)在Thermo Hypersil C18柱上的HPLC分析Fig. 5 HPLC profiles of L-phenylglycine (A) and D,L-mandelic acid (B) on Thermo Hypersil C18 column
2.4 重组大肠杆菌全细胞催化D,L-扁桃酸合成L-苯甘氨酸
按照1.3.4节方法对D,L-扁桃酸进行全细胞催化的生物转化。在D,L-扁桃酸的初始浓度为50、500 mmol/L NH4Cl-NH3·H2O缓冲液(pH 9.5)的条件下,180 r/min、30 ℃反应48 h后,反应产物经过离心取样稀释100 倍后,按照1.3.4节方法进行HPLC分析,结果如图6所示。在保留时间约为3.43 min的位置有明显特征峰,它与相同分析条件下L-苯甘氨酸的保留时间一致(图5A),表明在该反应条件下有L-苯甘氨酸的生成,经过计算其得率约为77.48%,较低的得率及底物浓度有待下一步对反应条件进行优化。
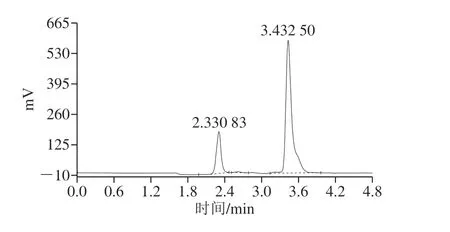
图6 催化产物在Thermo Hypersil C18柱上的HPLC分析Fig. 6 HPLC profile of catalytic products on Thermo Hypersil C18 column
将底物及纯化产物送至基云(上海)生物技术有限公司进行高分辨质谱分析,结果如图7、8所示。在图7中,由质荷比可以推出物质的分子式可能为C8H8O3Na+[M+Na]+,表明该物质是C8H8O3(扁桃酸)结合了1 个Na+;在图8中,由质荷比可以推出物质的分子式可能为C8H10NO2+[M+H]+,表明该物质是C8H9NO2(苯甘氨酸)结合了一个H+。
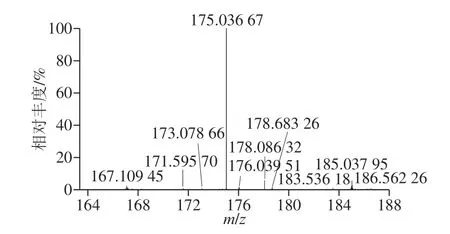
图7 底物的高分辨质谱分析Fig. 7 High-resolution mass spectrum of the substrate
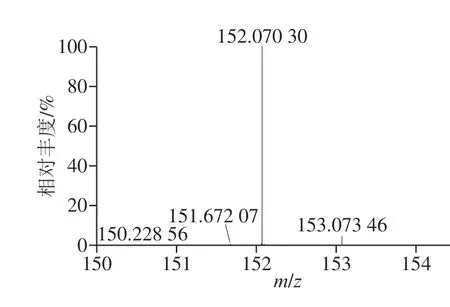
图8 产物的高分辨质谱分析Fig. 8 High-resolution mass spectrum of the product
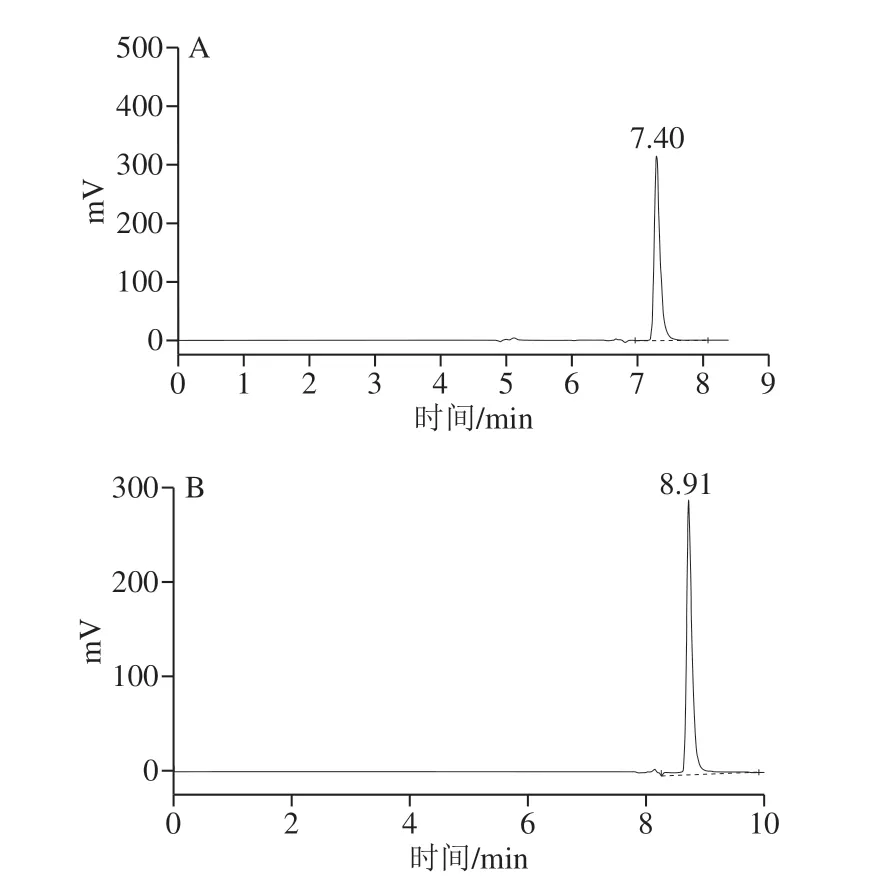
图9 L-苯甘氨酸(A)及D-苯甘氨酸(B)在Chirobiotic T手性C18柱上的HPLC分析Fig. 9 HPLC profiles of L-phenylglycine (A) and D-phenylglycine (B)on Chirobiotic T chiral C18 column
用Chirobiotic T手性柱参照1.3.5节方法对L-苯甘氨酸、D-苯甘氨酸及纯化产物进行手性柱的HPLC分析,L-苯甘氨酸和D-苯甘氨酸的保留时间分别约为7.40 min和8.91 min(图9),大部分产物的保留时间在7.40 min左右(图10),在8.91 min左右的峰面积较小。结合普通C18柱HPLC分析及高分辨质谱的分析结果,进一步表明该级联反应的终产物主要为L-苯甘氨酸,且其e.e.值大于99%,该级联反应具有较高的对映体选择性。本研究与Liu Qiaoli等[14]设计的亮氨酸脱氢酶与甲酸脱氢酶共表达体系相比较,不需要额外添加甲酸钠之类的辅底物,另外,外消旋扁桃酸相对苯乙酮酸来说也更廉价、更易得,具有更大的产业化应用前景。
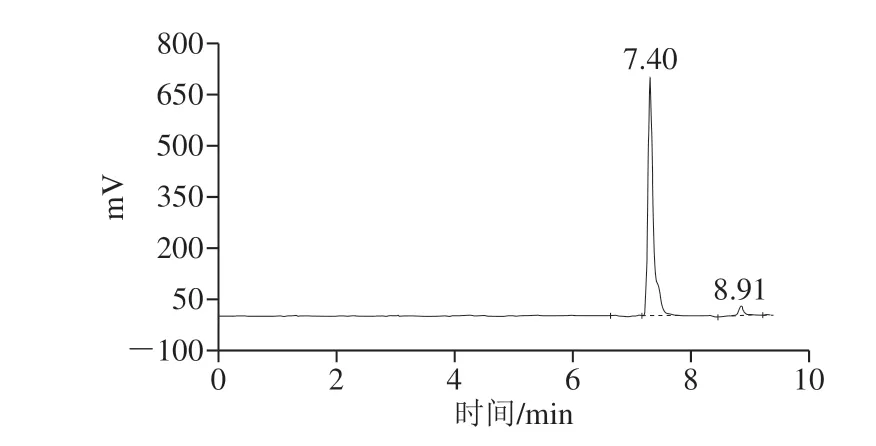
图10 纯化产物在Chirobiotic T手性C18柱上的HPLC分析Fig. 10 HPLC profile of purified product on Chirobiotic T chiral C18 column
3 讨 论
随着酶工程技术的发展,利用2 个或更多酶进行多酶级联反应在手性纯的化学品的合成中更受青睐[30]。通常这些级联反应可以用全细胞、细胞裂解液或游离酶作催化剂。与其他2 个相比,全细胞催化具有更多的优点,包括催化剂更稳定、更易回收利用,在一些氧化还原反应中无需添加辅酶等。因此,共表达多个酶的全细胞催化已被广泛用于众多化学品的生物合成。
本研究成功构建了携带LhDMDH、EsLeuDH和ArMR编码基因的重组大肠杆菌,重组菌的遗传稳定性良好。经诱导表达后,发酵液中LhDMDH、EsLeuDH和ArMR活性分别为195.8、56.2 U/mL和174.5 U/mL。共表达时,3 个酶各自的表达水平与单独表达时差别不大,进一步表明大肠杆菌具有强大的表达外源蛋白能力。此外,以诱导后的全细胞为催化剂、D,L-扁桃酸为底物,实现了L-苯甘氨酸高对映选择性的生物合成,在测定条件下L-苯甘氨酸的得率可达77.48%,e.e.值大于99%。与Liu Qiaoli等[14]设计的亮氨酸脱氢酶与甲酸脱氢酶共表达体系相比,不需要额外的添加甲酸钠之类的辅底物,另外,D,L-扁桃酸相对苯乙酮酸也更廉价、更易得,具有更大的产业化应用前景。本研究具有较大的产业化潜力,为实现L-苯甘氨酸规模化的生物合成奠定了坚实的基础。

