自然发酵分离乳酸菌发酵红甜菜过程中品质及抗氧化能力变化
李垚,郭瑞,闫明哲,王萍,2
(1.东北林业大学林学院,黑龙江哈尔滨 150040)
(2.黑龙江省森林食品资源利用重点实验室,黑龙江哈尔滨 150040)
红甜菜(Beta vulgarisL. subsp.vulgais),又名食用甜菜、紫菜头、火焰菜,为藜科(Chenopodiaceae),甜菜属(Beta),二年生草本植物,能够形成肥大的肉质根[1]。主要产于英国、北美、以及中美洲地区,多用于菜肴烹饪[2,3]。我国也有少量种植,多数用于园林观赏植物和色素提取原料[4]。红甜菜色泽鲜艳、肉质脆嫩,且营养丰富。除富含矿物质和糖类物质外,还含有种类丰富的维生素和锰、铜、钼、碘等微量元素以及皂角苷、甜菜苷等生物活性物质[5]。同时,由于红甜菜中富含酚类物质和甜菜苷,因此,不仅有良好的抗氧化能力[6],还具有保肝、抗衰老[7]、降血压[8]、降血脂[9]、抗炎[10]、抗疲劳[11]等作用。具有良好的开发利用价值。另外,经过发酵后,食品保质期得到延长,营养价值得以改善,一些发酵原料含有抗营养因子和有毒物质也可以显著去除[12-14]。同时,发酵过程中可以赋予产品特殊的风味[15]。
作为一种传统的食材,红甜菜主要被加工成泡菜[16]、复合果蔬汁[17]等产品。另外,由于其含有丰富的甜菜红素,因此在食品加工过程中作为天然色素。近年来,随着微生物发酵技术的发展和广泛应用,一些以红甜菜作为原辅料的发酵产品也应运而生,如红甜菜果醋[18]、红甜菜酸乳[19]等。这些产品多数使用接种发酵方式,接种发酵使得发酵基质更快的酸化并拥有稳定、安全且已知的微生物群落,不但减少自然发酵过程所用的大量时间,减少不需要的微生物种群出现,降低生物毒性化合物污染发酵产品的风险[20,21]。由于接种发酵所用的发酵菌种或发酵剂来源的多样性,很难满足特定发酵基质的发酵要求。为了保证发酵高效的进行,在接种前需要花费时间对菌种或发酵剂进行驯化培养。将自然发酵与人工接种发酵方法相结合,为解决该问题提供了一种可选方案。
本研究使用分离自红甜菜自然发酵液中的菌种对不同形态的红甜菜基质进行发酵,并对发酵过程中pH与总酸、乳酸菌活菌数、活性物质含量、抗氧化能力变化进行跟踪研究。旨在了解接种自然发酵菌种的红甜菜发酵液在发酵过程中化学和微生物指标、植物活性成分和体外抗氧化能力的变化,为促进红甜菜资源的加工、新产品的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
红甜菜,购自吉林省长春市。
植物乳杆菌(Lactobacillus plantarum)、乳酸肠球菌(Enterococcus lactis),分离纯化自红甜菜自然发酵液,东北林业大学食品微生物实验室保存。
福林酚、DPPH、TPTZ、琼脂购自Sigma公司;ABTS购自Biotopped公司;牛肉膏、蛋白胨、酵母膏购自北京奥博星生物科技有限公司;其他药品试剂均为国产分析纯。
1.2 主要仪器与设备
SW-CJ-2D双人无菌操作台,上海尚道仪器制造有限公司;PHS-3C型精密pH计,上海精密仪器有限公司;303-00A电热恒温培养箱,天津天泰仪器有限公司;PC722s分光光度计,上海佑科仪器仪表有限公司;DK-S12电热恒温水浴锅,上海森信试验仪器有限公司;TDL-5台式离心机,上海科兴仪器有限公司;全波长酶标仪,美国伯腾仪器有限公司;5030-PVL高压灭菌锅,长春百奥生物仪器有限公司。
1.3 试验方法
1.3.1 发酵菌种的活化
将植物乳杆菌、乳酸肠球菌分别接种至MRS培养基中,置于37 ℃下培养24 h,进行菌种活化处理。
1.3.2 接种发酵红甜菜样品的制备
1.3.2.1 红甜菜浆发酵样品制备
将洗净的红甜菜与无菌水,按照料液比 1:4:5(m:m:m)打浆,量取100 mL红甜菜浆置于150 mL具塞三角瓶中,按照10 g/100 mL加入红糖,使用1 M NaHCO3将pH调至4.70±0.1。置于紫外灯下照射20 min。在无菌环境中分别按照6%接种量向红甜菜浆中接入活化后的菌液(乳酸肠球菌和植物乳杆菌菌体量约为分别为6.21 log(cfu/mL)和6.18 log(cfu/mL)),密封后,置于37 ℃进行恒温培养48 h,制备发酵红甜菜浆。
1.3.2.2 红甜菜片发酵样品的制备
红甜菜洗净后去皮,切成将1 cm(H)×2 cm(W)×0.1 cm(TH)的薄片,将红甜菜、红糖、无菌水按照 2:1:7(m:m:m)比例加入150 mL具塞三角瓶中。使用1 M NaHCO3将pH调至4.70±0.1。置于紫外灯下照射20 min。在无菌环境中分别按照6 %接种量向红甜菜浆中接入活化后的菌液(乳酸肠球菌和植物乳杆菌菌体量分别约为6.21 log(cfu/mL)和6.18 log(cfu/mL)),密封后,置于37 ℃进行恒温培养48 h,制备红甜菜片发酵液。
1.3.3 红甜菜接种发酵过程指标测定
发酵过程中每间隔6 h,分别对接种植物乳杆菌和乳酸肠球菌的红甜菜浆、红甜菜片发酵液进行取样,测定pH、总酸含量、乳酸菌活菌数。并对所取样品进行5000 r/min,离心15 min,取上清液,测定总酚含量、黄酮含量、甜菜色素含量、总抗氧化能力、DPPH·清除能力、ABTS+·清除能力。
1.4 测定方法
1.4.1 pH测定
使用pH计对样品进行测定。
1.4.2 总酸的测定
参照《GB/T 12456-2008食品中总酸的测定》测定[22],并参考文献[23],略有改动。使用电位滴定法进行测定。将5 mL红甜菜发酵液稀释至20 mL,通过用0.1 M NaOH溶液滴定至pH 8.2,测定样品总酸,使用公式(1)进行计算,结果以乳酸计,每份样品平行测定3次取平均值。
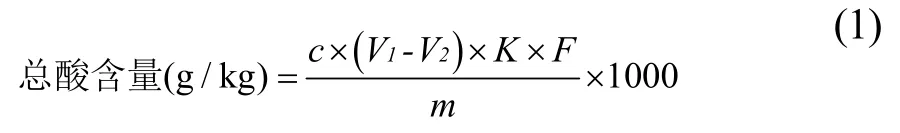
注:c-氢氧化钠标准溶液浓度的准确数值;V1-滴定样品时消耗的氢氧化钠体积;V2-滴定空白组消耗氢氧化钠体积;K-酸的换算系数(乳酸0.090);F-样品的稀释倍数;m-样品的质量。
1.4.3 乳酸菌活菌数测定
发酵过程中,每间隔2 h进行一次取样,并将取出的红甜菜发酵液使用无菌生理盐水梯度稀释后,使用平板计数法在MRS培养基中培养48 h后进行观察并计数[24]。
1.4.4 活性物质含量的测定
1.4.4.1 总酚含量的测定
采用福林酚-肖卡法[25]测定样品中的总酚,略有改动。将100 μL适当稀释后的样品加入到试管中,加水7 mL,混匀,再加入0.5 mL福林酚试剂,充分摇匀,1 min之后,加入20% Na2CO3溶液1.5 mL,混匀,最后加入0.9 mL蒸馏水。于25 ℃水浴条件下避光反应1 h。在765 nm波长测定吸光值,结果用没食子酸当量表示。每份样品测定3次取平均值。
1.4.4.2 黄酮含量的测定
根据Veronica等人的方法[26],略有改动。取0.5 mL待测样品,加入30%乙醇溶液至5 mL,加入0.3 mL 5%的NaNO2溶液,混匀,6 min后,加入10 % Al(NO3)3溶液0.3 mL,静置6 min,加入4 mL 1 M NaOH溶液,反应15 min后于510 nm下测定吸光值,结果用芦丁当量表示。每组样品平行测定3次,取其平均值。
1.4.4.3 甜菜色素含量的测定
根据Kumar等人的方法[27],略有改动,测定样品中的红甜菜色素,将样品以5000 r/min离心15 min,取上清液进行测定。将1 mL样品加入30 mL蒸馏水中稀释,振荡10 s使其混匀。使用UV/VIS分光光度计在476 nm和538 nm读取数值,分别用来分析甜菜黄素和甜菜红素。另外,使用600 nm波长校正可能存在的杂质。使用以公式(2)进行计算:

注:A-在476 nm或538 nm处的吸光度读数与600 nm处读数的差值;FD-稀释因子;I-为比色皿光路长度;MM-色素分子量,甜菜红素550 g/mol,甜菜黄素308 g/mol;ɛ-摩尔吸光系数甜菜红素 60000 L/(mol·cm),甜菜黄素 48000 L/(mol·cm)。
1.4.5 抗氧化能力的测定
1.4.5.1 DPPH·清除能力测定
参考杨玲的方法[28],并稍有改动。移取样品50 μL加入0.1 mM的DPPH·-乙醇溶液4 mL,避光反应30 min,以去离子水为参比,在517 nm波长下测定吸光值;对照组用4 mL无水乙醇代替0.1 mM DPPH·,空白组用50 μL无水乙醇代替样品,测定吸光值,根据公式(3)计算清除率,每组样品平行测定3次取平均值。
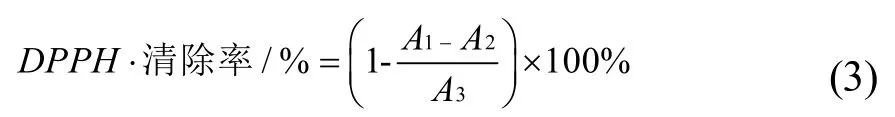
注:A1-样品组吸光值;A2-对照组吸光值;A3-空白组吸光值。
1.4.5.2 总抗氧化能力的测定
采用铁离子还原能力测定法(FRAP)[29]测定样品的总抗氧化能力。FRAP工作液的配制:取2.5 mL TPTZ溶液(用40 mM HCl配置成浓度为10 mM的TPTZ-HCl溶液),25 mL醋酸(100 mM,pH 3.6),2.5 mL FeSO4·6H2O(20 mM),充分混匀。
总抗氧化能力的测定:取 20 μL样品,180 μL FRAP工作液加入96孔板中,以200 μL蒸馏水为空白对照,在37 ℃下水浴5 min,于593 nm波长下测定样品吸光值。每组样品平行测定3次取平均值。根据标准曲线计算出样品的总抗氧化能力。
1.4.5.3 ABTS+·清除能力测定
根据G A Garzón[30]等人的方法,略有改动。向试管中加入0.2 mL样品液,4.0 mL ABTS+·工作液(7.4 mmol/L ABTS+·溶液与 2.6 mmol/L K2S2O8溶液按照1:1(V:V)混合得到,黑暗处反应12 h,使用pH 7.4磷酸缓冲溶液稀释 40~50倍,使 A734=0.7±0.02)。充分摇匀后,静置6 min,在734 nm下测得吸光度A,空白对照为A0,按公式(4)计算:
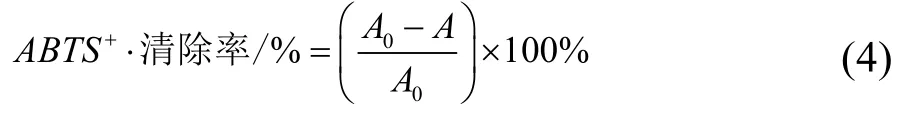
1.5 统计分析
2 结果与讨论
2.1 红甜菜发酵过程中的pH变化
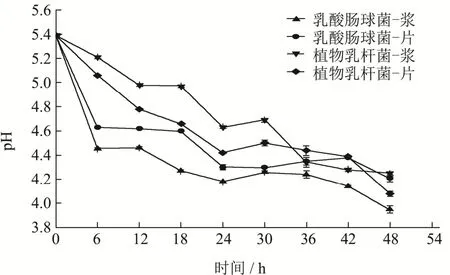
图1 红甜菜发酵过程中pH变化Fig.1 Change of pH in the red beetroot fermentation
由图1可以看出,随着发酵时间的延长,所有发酵物的pH均呈现先快速下降,随后下降速度放缓的趋势。总体来看,乳酸肠球菌和植物乳杆菌pH下降程度相当,但相比之下,乳酸肠球菌pH下降更加迅速,而植物乳杆菌pH下降略显平缓,同样是下降至pH 4.4左右,使用植物乳杆菌发酵需要24 h,而乳酸肠球菌仅需6 h。在0~48 h的发酵过程中,乳酸肠球菌发酵红甜菜浆、乳酸肠球菌红甜菜片发酵液、植物乳杆菌发酵红甜菜浆、植物乳杆菌红甜菜片发酵液pH由5.39分别降至3.95、4.21、4.25和4.08。结合发酵基质的状态进行比较能够看出,乳酸肠球菌发酵浆的pH下降幅度最大、下降速度最快;而植物乳杆菌发酵液则呈现相反的情况。这可能由于不同的微生物对于发酵基质状态的适应程度不同,进而导致了这种情况的发生。
2.2 红甜菜发酵过程中总酸的变化

图2 红甜菜发酵过程中总酸含量的变化Fig.2 Titratacble acidity content of fermented red beetroot
通过图2可以看出,乳酸肠球菌和植物乳杆菌发酵液中的总酸含量均显著增加(p<0.05),乳酸肠球菌发酵的样品中总酸含量快速增加的时间段主要在发酵周期的前6 h,而植物乳杆菌在发酵周期的前18 h。这可能与原料中大量的有机酸溶出以及乳酸菌代谢消耗糖产生了有机酸有关[31,32]。通过图2可以看出,相比植物乳杆菌发酵液,乳酸肠球菌发酵液中总酸含量较高,最高达16.78±0.43 g/kg,这与pH变化的趋势是相符的。对比未发酵时样品中总酸含量,经48 h发酵过后,发酵液中总酸含量分别增加263%、249.33%、123%以及138.16%。由此可见,使用乳酸肠球菌发酵的红甜菜浆总酸增加量最高。所有样品中的总酸含量在发酵周期中均为波动式上升,这与发酵基质中保持动态变化的发酵微生物数量以及代谢途径的变化有着密切的关系。
2.3 红甜菜发酵过程中活菌数的变化
由图3可以看出,乳酸肠球菌和植物乳杆菌发酵的活菌数分别在发酵周期的18 h与24 h达到最高值。所有样品中的活菌数均呈现在发酵周期前半段显著快速增加(p<0.05),发酵后半段活菌数变化较小,趋于稳定甚至有降低的趋势。冯隽野[33]等人在研究野生蓝靛果接种发酵过程中也发现了乳酸菌活菌数类似的变化趋势。这是由于微生物在更换培养环境时,有一个短暂的延滞期,随后在适应生长环境后就会进入对数增长期,但随着活菌数的增加,发酵基质中乳酸菌之间会由于争抢碳源或其他营养物质,导致菌种被抑制生长,微生物之间达到一个动态平衡的状态,称为稳定期,但随后就会发生活菌数下降的情况,便进入了衰亡期[34]。0 h到48 h,乳酸肠球菌红甜菜浆发酵液活菌数由6.21 log(cfu/mL)(0 h)升至7.17 log(cfu/mL)(18 h),发酵结束时降至6.76 log(cfu/mL)(48 h);乳酸肠球菌甜菜片发酵液活菌数6.21 log(cfu/mL)(0 h)升至6.95 log(cfu/mL)(18 h),发酵结束波动降至6.69 log(cfu/mL)(48 h)。植物乳杆菌红甜菜浆发酵液活菌数由6.18 log(cfu/mL)(0 h)上升至6.79 log(cfu/mL)(24 h)随后波动降至6.67 log(cfu/mL)(48 h);植物乳杆菌红甜菜片发酵液4(48 h),通过对比可以发现,两种发酵菌所发酵的红甜菜浆分别获得了最高的活菌数,这可能是由于发酵基质的状态而决定的,相比红甜菜片,红甜菜浆由于被破碎得更加完全,使得大量营养物质释放,以供给微生物生长繁殖。
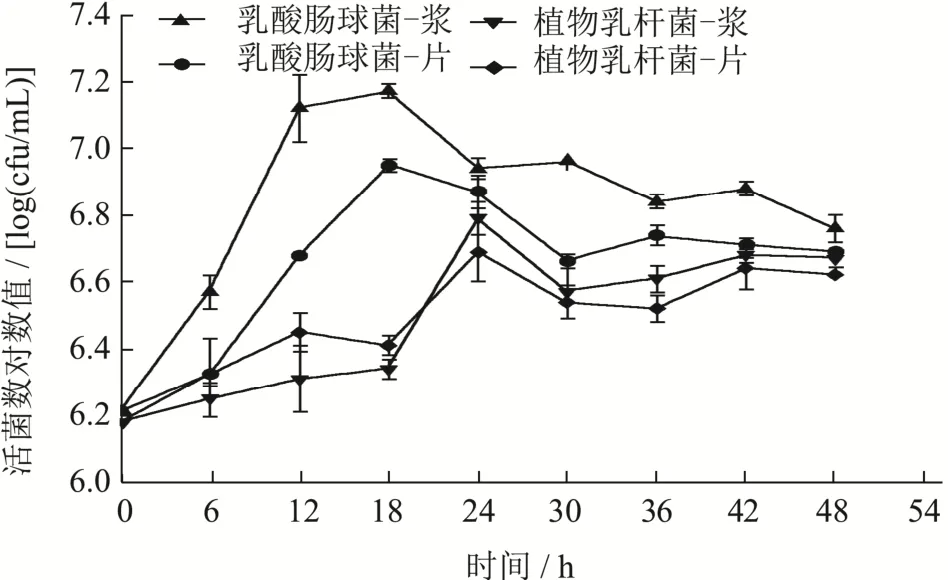
图3 红甜菜发酵过程中活菌数的变化Fig.3 Viable counts of bacteria of fermented red beetroot
2.4 红甜菜发酵过程中活性物质含量的变化
2.4.1 红甜菜发酵过程中总酚含量的变化
由图4可知,随着发酵的进行,乳酸肠球菌和植物乳杆菌发酵的红甜菜样品中总酚的含量均显著增加(p<0.05),并呈现先增加后下降的整体趋势。且总酚含量的最大值均出现在30 h。采用乳酸肠球菌和植物乳杆菌发酵的样品中,红甜菜浆发酵液中总酚含量最大,分别为755.30 mg/L和670.56 mg/L,相对未发酵样品分别提高了 72.55%和51.42%,由此可见,乳酸肠球菌发酵的红甜菜浆总酚含量增加量最大,且在30 h含量最高。发酵过程中,微生物将大分子酚类转化成小分子物质可能使酚类含量增加,并且乳酸菌所产生的酶类与有机酸可以使发酵基质中酚类物质大量的溶出,并呈现游离态,也会对酚类物质的含量产生影响[35,36]。另外,通过对比发酵过程的后半段可以发现,乳酸肠球菌和植物乳杆菌发酵的红甜菜片发酵液的总酚含量下降速度相比红甜菜浆发酵液较为缓慢,可能由于是发酵基质的形态阻止了一部分酚类物质与其他物质相结合,进而使得总酚含量下降速度放缓。
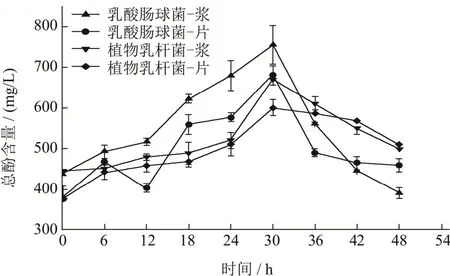
图4 红甜菜发酵过程中总酚含量的变化Fig.4 Total phenols content contents of fermented red beetroot
2.4.2 红甜菜发酵过程中黄酮含量的变化
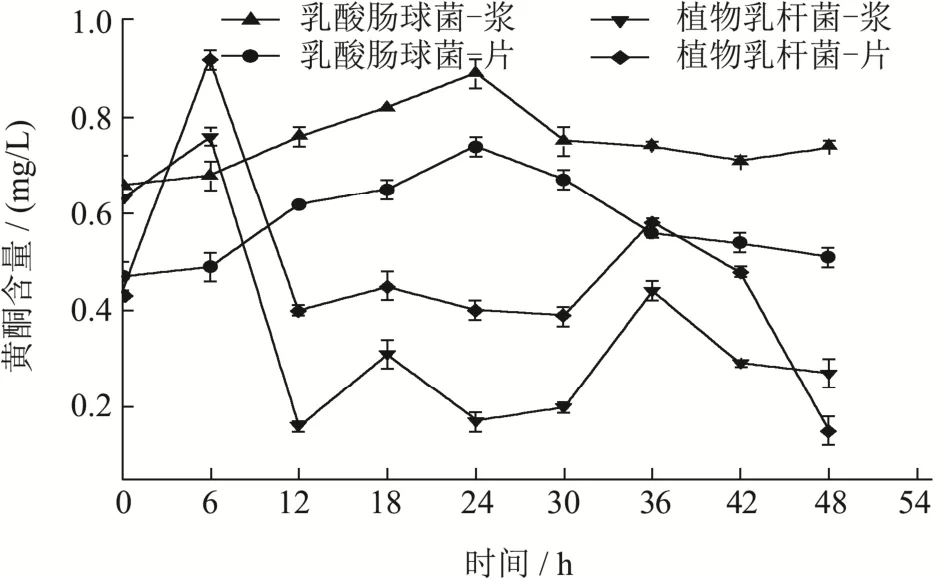
图5 红甜菜发酵过程中黄酮含量的变化Fig.5 Flavonoid contents of fermented red beetroot
如图5所示,红甜菜发酵液中的黄酮含量随着发酵时间的增加,呈现先增加随后波动下降的趋势。乳酸肠球菌发酵的红甜菜浆和片样品在24 h时黄酮含量达到最大值,分别为0.89 mg/L和0.67 mg/L,增加34.84%和42.55%;植物乳杆菌发酵的红甜菜浆和片样品中黄酮含量在6 h后达到最大值,分别为0.76mg/L和0.92 mg/L,增加20.63%和113.95%。由此可见,使用植物乳杆菌发酵的红甜菜片发酵液的黄酮含量最高。冉玉兵[37]等人在研究乳酸菌发酵龙眼浆时,也发现了黄酮含量随发酵进行增加的情况。
2.4.3 红甜菜发酵过程中甜菜色素的变化
2.4.3.1 甜菜红素含量变化
如图6所示,由不同菌种发酵的相同发酵基质形态的样品中甜菜红素含量,在发酵周期中的变化趋势基本一致:红甜菜浆发酵液中红素含量均呈先下降随后动态稳定的趋势;红甜菜片发酵液甜菜红素含量呈现先快速上升,随后下降的趋势。乳酸肠球菌和植物乳杆菌发酵的红甜菜浆样品,在48 h内甜菜红素含量由9.37 mg/100 mL分别下降至6.01 mg/100 mL和6.33 mg/100 mL,下降38.10%和36.07%,这可能是由于在将红甜菜制作成浆液时,其组织被机械破坏,在加速甜菜色素以及其他活性物质的溶出时,同时破碎的红甜菜组织增大了与发酵液的接触面积,更容易受到微生代谢产物等外界影响,甜菜红素更容易被分解或转化。Swaicki[38]等人在研究红甜菜自然发酵过程甜菜红素含量变化时也观察到发酵过程中其含量有30%~50%左右的下降。
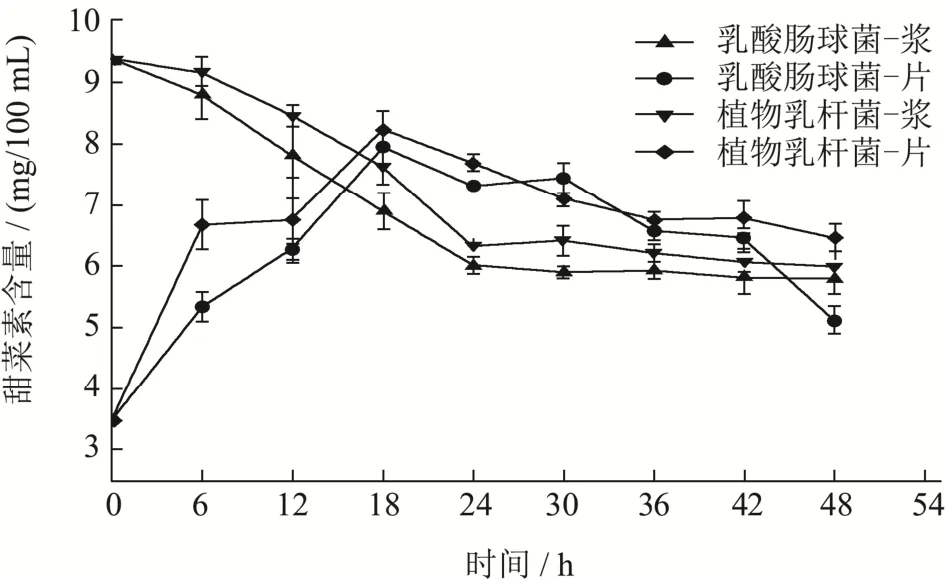
图6 红甜菜发酵过程中甜菜红素含量Fig.6 Betacyanincontent of fermentation red beetroot broth
另外,发酵后期的红素含量出现的平稳趋势,可能受到了 pH的影响,叶丽君[39]等人的研究,发现当甜菜红素所处环境pH为2.0~9.0间属于一级降解动力学反应,而pH为4左右时甜菜红素具有更长的半衰期,因此更加稳定。红甜菜片发酵液中甜菜红素分别由3.47 mg/100 mL增加至7.94 mg/100 mL和8.23±0.3 mg/100 mL,增加128.81%和137.17%,是由于甜菜色素为水溶性色素,在液体中浸泡和微生物代谢作用均能够促进其溶出,但发酵周期的后半段由于色素溶出量低于降解与转换量,因此甜菜红素含量发生下降,但含量仍高于未发酵样品。
2.4.3.2 甜菜黄素含量变化
如图7所示,使用两种菌种发酵的发酵液中甜菜黄素含量的变化趋势基本一致,均呈现先增加,随后降低并保持动态平衡趋势。乳酸肠球菌和植物乳杆菌发酵的各种发酵基质类型的样品中甜菜黄素含量均在发酵前半段显著提高(p<0.05),分别提高87.64%(乳酸肠球菌-浆)、78.88%(乳酸肠球菌-片)、58.05%(植物乳杆菌-浆)和 12.42%(植物乳杆菌-片)。这与Swaicki[38]等人发现的甜菜黄素含量在发酵过程前期发生增长,随后波动下降的变化趋势相符。研究表明甜菜黄素的增加主要有两种来源:首先,甜菜色素为水溶性色素,随着发酵的进行,发酵基质由于微生物的分解代谢其中的甜菜黄素发生溶出,会导致样品中甜菜黄素含量增加;其次,红甜菜中所含的甜菜醛氨酸与胺和氨基酸分子可以缩合成甜菜黄素[40],而植物中胺与氨基酸含量丰富,为甜菜黄素的生成提供了条件。通过对比发酵液中甜菜红素与黄素含量的差别发现发酵液中红素的含量高于黄素含量。红甜菜中含有的多巴胺成分通过酶催化成环多巴,相比氨基酸,环多巴更容易与甜菜醛氨酸生成甜菜苷配基,进而被糖基化为甜菜苷,甜菜苷为甜菜红素的主要成分[41]。

图7 红甜菜发酵过程中甜菜黄素含量Fig.7 Betaxanthincontent of fermentation red beetroot broth
2.5 红甜菜发酵过程中抗氧化能力的变化
2.5.1 红甜菜发酵国过程中DPPH·清除能力的变化

图8 发酵红甜菜液DPPH⋅清除能力Fig.8 DPPH radical scanveging of fermented beetroot
通过图8可以看出,乳酸肠球菌和植物乳杆菌所发酵的红甜菜浆样品的 DPPH·清除能力在发酵周期中的部分时间段内升高不显著(p>0.05),红甜菜片样品显著升高(p<0.05)。发酵红甜菜浆样品和红甜菜片样品分别在30 h(46.63%和47.01%)以及24 h(55.32%和48.12%)达到最大值,与未发酵样品相比,DPPH·清除能力分别提高了7.81%(乳酸肠球菌-浆)、13.9%(植物乳杆菌-浆)、47.80%(乳酸肠球菌-片)和 28.11%(植物乳杆菌-片)。由此可见,红甜菜片发酵液的DPPH·清除能力高于甜菜浆发酵样品,其中乳酸肠球菌清除能力最强。通过对比甜菜红素含量的变化趋势和相关性分析可以看出清除能力的变化与其相关(R2=0.701)。研究表明,甜菜红素中主要成分甜菜苷具有良好的抗氧化能力[42],发酵液中甜菜红素含量的变化与其他活性物质一同影响 DPPH·清除能力的变化。黄梅华[43]等人研究发现乳酸菌火龙果皮发酵液的DPPH·清除能力在经过发酵后显著提高,达到97.52%。
2.5.2 红甜菜发酵过程中总抗氧化能力的变化
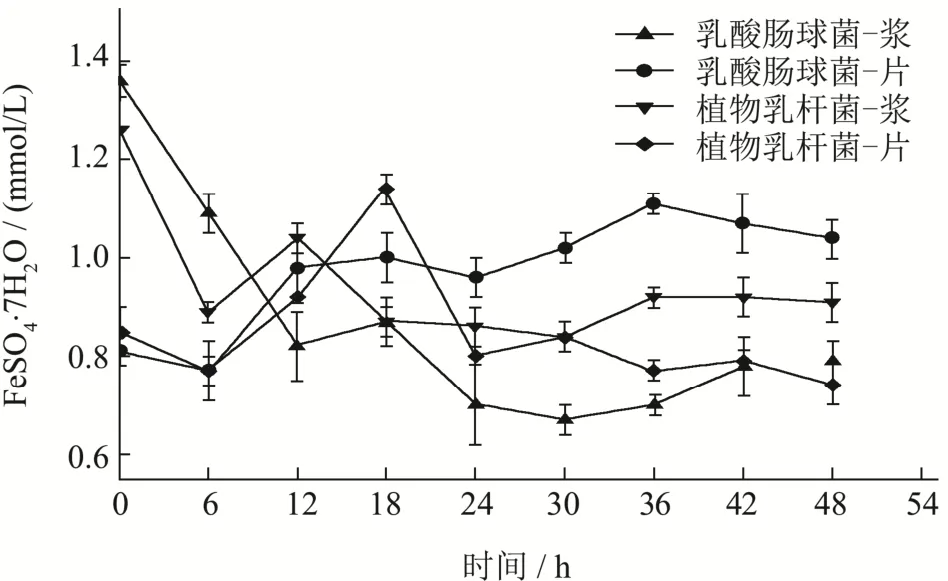
图9 发酵红甜菜液总抗氧化能力Fig.9 Total antioxidant activity of fermented beetroot
如图9所示,相同发酵菌种使用不同发酵基质类型的样品表现出不同的总抗氧化能力变化趋势:红甜菜浆发酵液呈现波动下降的趋势,红甜菜片发酵液呈先增加,随后下降并保持动态平衡的趋势。在48 h中,使用乳酸肠球菌和植物乳杆菌发酵的红甜菜浆样品的总抗氧化能力显著下降(p<0.05),分别下降 41.91%和27.78%;红甜菜片发酵样品中总抗氧化能力均经历显著上升阶段(p<0.05),最高值为1.11 mmol/L和1.14 mmol/L,分别上升37.03%和34.12%。由此可见植物乳杆菌发酵的红甜菜片样品的总抗氧化能力优于其它样品。樊秋元[44]在研究植物乳杆菌发酵黑加仑酵素时,也发现其总抗氧化能力在发酵周期24 h左右达到最大值后,发生下降的趋势。
2.5.3 红甜菜发酵过程中ABTS+·
通过图10可以看出,使用乳酸肠球菌和植物乳杆菌发酵的样品的ABTS+·清除能力变化趋势基本相同,均为先显著增加(p<0.05),随后保持动态平衡的趋势。通过对比数据可以得出,两种菌种发酵的红甜菜片发酵样品,相比 0 h均得到提升,分别达到 69.62%和69.69%,各自提升了132.29%和144.52%。相比之下,发酵红甜菜浆的样品仅在各自发酵周期的6 h,分别有62.00%和37.25%的增幅。在其他抗氧化指标出现下降时,由于甜菜发酵液中可能通过发酵释放出的甜菜醛氨酸,这是一种就清除ABTS+·而言,相比Trolox有更好清除率的物质[45],并且即使甜菜苷发生了氧化,其衍生物,例如2-脱羧甜菜苷、新甜菜苷等,依然具有良好的清除能力,随着发酵基质成分的平稳,这也使得ABTS·+清除能力变化趋势相对稳定。
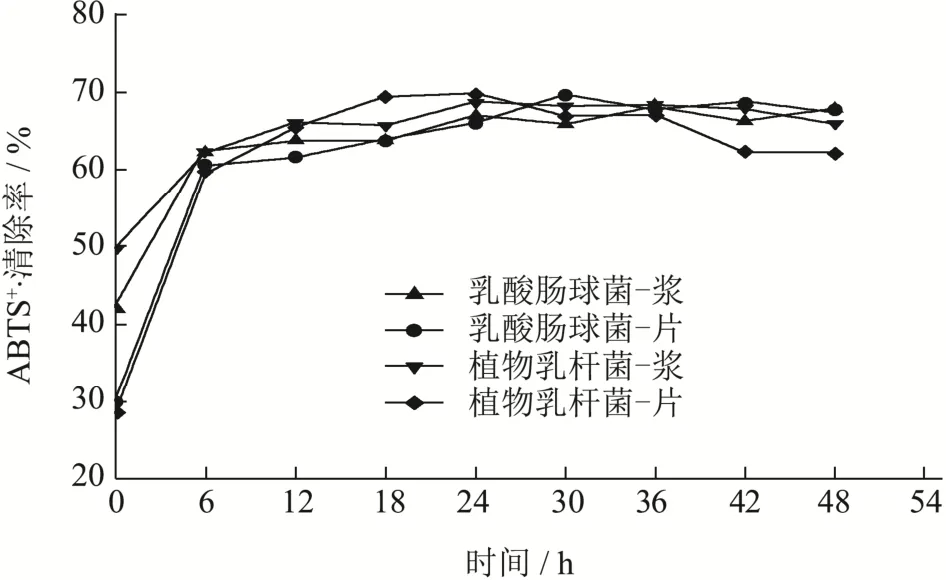
图10 发酵红甜菜液ABTS+·清除能力Fig.10 ABTS+· radical scanveging of fermented beetroot
3 结论
使用自然发酵分离、纯化出的植物乳杆菌(Lactobacillus plantarum)、乳酸肠球菌(Enterococcus lactis)分别对红甜菜浆和红甜菜片进行发酵,各样品总酸含量随pH下降而增加;乳酸菌活菌数呈现先显著上升(p<0.05),后降低的趋势;活性物质中,总酚和黄酮的含量均呈现先增加后减少趋势;发酵红甜菜浆样品中甜菜红素含量随发酵进行而下降,红甜菜片发酵样品先显著增加(p<0.05)再下降趋于稳定,乳酸肠球菌红甜菜发酵液中甜菜红素含量最高,为7.94 mg/100 mL,另外所有样品中甜菜黄素含量均在发酵前半段发生了增加,后半段下降并趋于平缓;乳肠球菌和植物乳杆菌发酵的红甜菜片样品,具有更高的体外抗氧化能力。综上,使用植物乳杆菌和乳酸肠球菌发酵可以提高红甜菜片和红甜菜浆的品质,为后续研究、开发红甜菜乳酸发酵制品提供了基础数据与理论依据。

