不同加工方式下芸豆子叶细胞内淀粉结构及体外消化特性的对比分析
王苗苗,丁丽,张新,邓慧君,陶醉,张斌,3,黄强,3,王桂丹
(1.华南理工大学食品科学与工程学院,广东广州 510640)
(2.湖南汇富康达健康管理有限公司,湖南长沙 410000)(3.中新国际联合研究院,广东广州 511363)
杂豆属于豆类科,其中芸豆、蚕豆、豌豆和鹰嘴豆是最常见的品种。许多流行病学研究表明,杂豆的血糖生成指数(Glycemic index,GI)较低,长期摄入杂豆食品对预防和控制糖尿病、肥胖症等有一定功效[1,2]。与其他食品相比,杂豆由于其细胞壁较厚且富有弹性,在经烹饪(热加工)之后其细胞会较容易分离而不是破碎[3],这就意味着热处理后的杂豆在经咀嚼之后大部分都能保证完整的细胞结构,在小肠酶解消化时,其中的细胞壁和蛋白质基质可以作为物理屏障限制淀粉与消化酶的接触从而降低其消化速率[4,5]。
杂豆具有抗营养因子,包括植酸、单宁、胰蛋白酶抑制剂和其他多酚类物质等,一般需经过热处理才可以食用。常用的热加工方式包括常压蒸煮、高压蒸煮、油炸、焙烤等。据报道,杂豆的抗营养因子可以抑制消化酶的酶活,从而降低消化速率[6]。这些热加工方式会不同程度破坏杂豆细胞壁的结构和通透性,同时使蛋白质及抗营养因子失活,进而影响淀粉的消化性。Zacharie等[7]发现与未处理的芸豆相比,常压蒸煮使淀粉体外消化率显著提高(12.3%)。高压蒸煮可以极大的破坏杂豆的细胞壁,蛋白质基质及抗营养因子,从而显著提高消化性。Berg等[8]发现高压蒸煮白腰豆子叶细胞后,部分细胞的细胞壁破裂,且细胞质中的蛋白质变性,同时细胞内的淀粉吸水溶胀发生糊化,淀粉的消化速率和程度显著提高。油炸处理会使淀粉结构崩解、糊化,溶解度和膨胀度增加。张令文等[9]报道了淀粉颗粒油炸20~50 s后逐渐膨胀,部分颗粒开始糊化,75 s后完全糊化。随着油炸温度的升高,淀粉的溶解度和膨胀度增加[10]。焙烤使得淀粉发生不同程度的糊化。Varriano-Marston等[11]报道了面包中心淀粉的糊化程度低于外围,主要由于是在焙烤食品中,体系水分含量较低,而淀粉分子的糊化程度主要取决于水分含量,而面包中心部位的水分含量较面包的外周低。
本文选取我国具有代表性的杂豆品种芸豆(Phaseolus vulgaris)为原料,分离出完整芸豆子叶细胞作为芸豆全食品的研究模型,并以芸豆淀粉为对照,研究常压蒸煮、高压蒸煮、高温焙烤、油炸这 4种工业和家庭常用的热加工方式对完整芸豆子叶细胞内含淀粉的表观形态、结晶结构及消化性的影响,以期对低 GI芸豆类食品的设计和生产提供理论依据和科学指导。
1 材料与方法
1.1 原料
芸豆,美国Target公司;猪胰酶(Cat. No. P7545,活力8×USP/mg)、4-羟基苯甲酰肼、异硫氰酸荧光素-葡聚糖,美国Sigma-Aldrich公司;总淀粉含量测定试剂盒(K-TSTA)、葡萄糖氧化酶-过氧化物酶检测试剂盒(GOPOD)(K-GLUC),爱尔兰Megazyme公司;其他化学试剂均为分析纯。
1.2 主要仪器设备
EVO18型扫描式电子显微镜,德国Zeiss公司;TCS SP5型激光共聚焦显微镜,德国 Leica公司;BX-51型热台偏光显微镜,日本Olympus公司;DSC-3型差示扫描量热仪,瑞士 Mettler-Toledo公司;D/Max2200型X-射线衍射分析仪,日本Rigaku公司。
1.3 样品制备
1.3.1 完整芸豆子叶细胞的分离
芸豆子叶细胞的分离方法参考 Edwards[12]报道的方法。配制含0.5% Na2CO3和1.5% NaHCO3的混合水溶液,将200 g芸豆浸泡于上述溶液中,4 ℃贮存过夜。待芸豆充分吸水膨胀后,弃去碱液去皮。接着将去皮芸豆于60 ℃条件下水浴处理1 h。接着用压蒜器将芸豆压碎,过100目及300目标准筛,取中间组分,冷冻干燥后获得完整芸豆子叶细胞。芸豆细胞样品的总淀粉含量为59.7%±0.5%,蛋白质含量为17.4%±0.8%,总膳食纤维含量为22.7%±1.2%。
1.3.2 芸豆淀粉的提取
淀粉提取方法参考Li等[13]报道的方法。将芸豆浸没在150 mL的NaS2O2溶液中(0.45%,m/V)置于4 ℃过夜,经去皮、打浆后,过300目标准筛滤去蛋白和细胞壁残渣,4000 g离心10 min,弃去上层黄色蛋白质。将淀粉悬浮液置于450 mL氯化钠与甲苯混合液中,搅拌1 h后离心除去蛋白质和脂类。重复该操作多遍,直至甲苯层变得清晰,即不含蛋白质,然后于烘箱中 40 ℃干燥过夜,粉碎得芸豆淀粉。采用总淀粉试剂盒测得样品的总淀粉含量为95.3%。
1.3.3 制备经不同热加工方式处理后的芸豆细胞或淀粉
1.3.3.1 常压蒸煮
常压蒸煮参数参考Eyaru等[14]所报道的方法。分别称取5 g芸豆细胞或淀粉,加入45 g水后常压蒸煮20 min,冰水冲淋使其迅速降温,即得常压蒸煮样品,最后将样品冷冻干燥,密封保存。
1.3.3.2 高压蒸煮
高压蒸煮参数参考Eyaru等[14]所报道的方法。分别称取5 g细胞或淀粉,加入45 g水后于高压灭菌锅中在121 ℃蒸煮20 min,然后立即用冰水冲淋使样品迅速降温,防止淀粉回生。最后将蒸煮处理后的样品冷冻干燥,密封保存。
1.3.3.3 高温焙烤处理
高温焙烤处理方式参考Anju等[15]所报道的方法。分别称取5 g芸豆细胞或淀粉,置于烘箱中在200 ℃下焙烤20 min,然后将样品转移至干燥器内降至室温,将所得焙烤样品密封保存。
1.3.3.4 油炸处理
油炸处理参数参考 Goñi等[16]所报道的方法。分别称取5 g芸豆细胞或淀粉,加入100 mL棕榈油,在180 ℃的温度条件下油炸3 min,然后立即弃去热油,再将所得的油炸处理样品冷冻干燥,密封保存。
表1 样品的命名Table 1 The name of samples
1.4 显微结构的观察
1.4.1 光学显微镜观察
将冷冻干燥的样品分散在蒸馏水中,置于载玻片上,分别在正常光和偏振光场下观察细胞和淀粉的形貌,细胞和淀粉的放大倍数分别为200倍和500倍,并拍摄代表性图像。
1.4.2 扫描电子显微镜观察
将样品台置于真空条件下进行喷金处理。在扫描电镜下观察细胞和淀粉的表面形貌,扫描电压为10 kV,细胞和淀粉的放大倍数分别为200倍和500倍。
1.5 结晶结构
用 X-射线衍射观察细胞或淀粉的结晶度,在 40 kV和40 mA下操作,步进间隔为0.02°,扫描速率为0.5 °/min。从 4°扫描至 30°。依据 Hayakawa等[17]报道的方法计算相对结晶度。
1.6 热力学性质
采用差示扫描量热仪分析细胞和淀粉的热性质。准确称取样品3 mg(淀粉干基),加入去离子水配成30%(m/V)的淀粉乳,密封条件下在室温平衡2 h。以空皿为参比,然后以10 ℃/min的速率升温从30至150 ℃扫描。使用STARe软件计算起始糊化温度(To)、峰值糊化温度(Tp)、终止糊化温度(Tc)和焓值(ΔH)。
1.7 淀粉体外消化动力学
消化性动力学的测定参考Zhang等[18]所报道的方法。准确称量不同热处理后的芸豆细胞或淀粉50 mg(以淀粉干基计),分散在含有猪胰α-淀粉酶(200 USP)的磷酸盐缓冲液(PBS,10 mL)溶液中,于37 ℃水浴。在 5、10、20、30、40、60、90、120、180、240、300、360 min时,分别取50 μL消化液,并加入250 μL碳酸钠溶液(0.5 M)以终止反应。麦芽糖当量用对羟基苯甲酸酰肼法测定,于410 nm波长下测得吸光值。芸豆细胞或淀粉经不同时间消化后释放出的麦芽糖当量用以下公式计算得到:

淀粉的消化速率曲线拟合一级动力学方程(式2)以得到表观消化速率常数。公式如下:

式中:t,反应时间(min);Ct,在反应时间t内淀粉的消化量;C∞,在终点时刻的反应物的浓度;k,表观速率常数。
1.8 细胞壁通透性观察
细胞壁通透性的观察参考Li等[19]的方法,略有改动。将1 mg芸豆子叶细胞分散在1 mL FITC-葡聚糖溶液(2 mg/mL)中,于37 ℃混合3 h,然后将混合物涂布在载玻片上,并使用共聚焦显微镜观察细胞形貌。激光扫描显微镜放大倍数为 40×1.25。氩离子激光器的激发波长设定为488 nm,以30%的容量功率操作,发射光从510 nm至600 nm检测。用LASAF软件记录完整芸豆子叶细胞的光学切片图像。
1.9 数据分析处理
每组实验数据至少3个平行,采用SPSS 18.0进行统计分析,采用Origin 9.0进行作图。
2 结果与讨论
2.1 不同热加工方式对芸豆淀粉和细胞显微结构的影响
不同热加工方式处理后的芸豆淀粉和子叶细胞的扫描电镜和偏光显微图如图1所示。
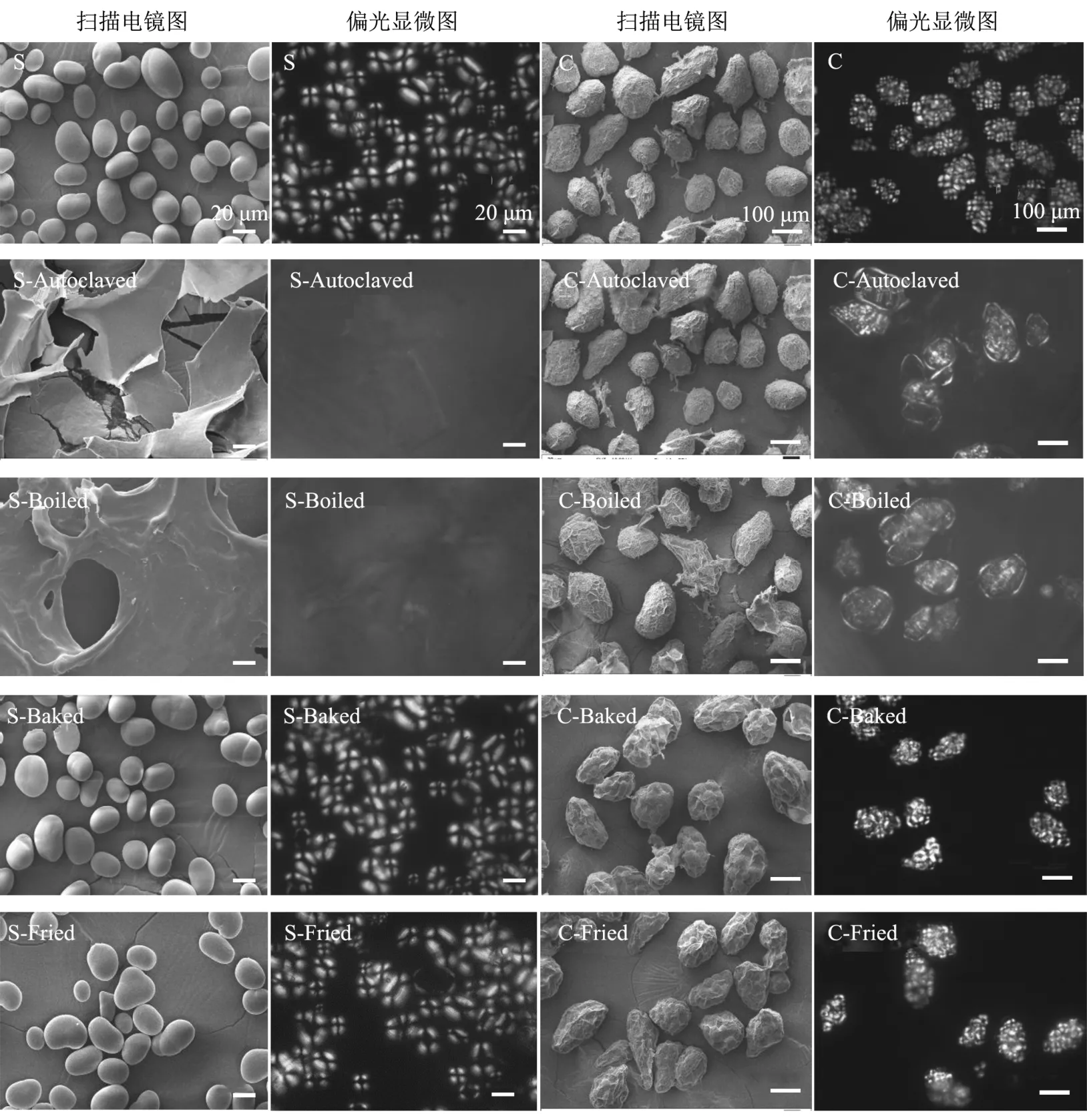
图1 不同热加工方式处理后的芸豆淀粉和子叶细胞的扫描电镜图和偏光显微图Fig.1 Light micrographs pictures and scanning electron micrographs of pinto bean starch and cell treated by different heating process
芸豆淀粉(图1,S)呈球形或椭球形,粒径约在15~40 μm 之间,其偏光十字清晰但不规则,有“X”型和“十”字型2种,交叉位于淀粉颗粒中央,与杜双奎等[20]的报道相一致。芸豆子叶细胞(图1,C)呈椭球形或球形,粒径约为50~150 μm,在偏正光下显示为偏光十字簇,且细胞表面充满褶皱,这可能是由于在冷冻干燥的过程中细胞壁脱水皱缩形成的[7]。经高压和常压蒸煮后,芸豆淀粉的颗粒结构被完全破坏而呈碎片状,偏光十字消失,说明经高温蒸煮后,淀粉颗粒充分吸水膨胀并已完全糊化。与淀粉相比,经高压和常压蒸煮的芸豆细胞在偏正光下仍具有较强的双折射现象(图1,C-Autoclaved和C-Boiled偏光显微图),这表明在细胞壁包裹下,蒸煮后的淀粉没有完全糊化,仍保留一定程度的结晶结构。Xiong等[21]也发现芸豆子叶细胞经95 ℃蒸煮后,细胞壁和蛋白质基质可以通过限制水的渗透及淀粉的膨胀来抑制包裹淀粉的糊化。经油炸和焙烤后,芸豆淀粉表观形态与原淀粉相比无显著变化,且偏光十字仅略微减弱,这说明低水分条件下的油炸和焙烤对淀粉的结构破坏较小。芸豆子叶细胞经油炸和焙烤后,其显微结构与原细胞相比无显著变化,但细胞体积有所减小,细胞壁褶皱增多。Aguileraa等[22]采用高温油炸马铃薯细胞时发现水以蒸汽的形式从细胞间隙释放出来时,外层细胞就会脱水收缩,它们的壁会在脱水的凝胶淀粉周围变得皱褶和卷曲。
2.2 不同热加工方式对芸豆淀粉及细胞结晶结构的影响
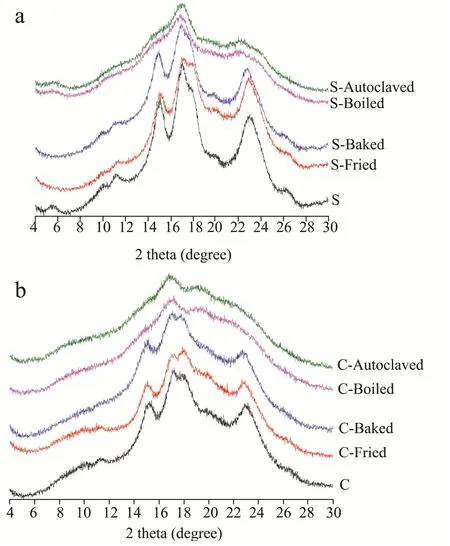
图2 不同热加工方式处理后芸豆淀粉(a)和细胞(b)的X-射线衍射图Fig.2 X-ray diffractograms of pinto bean starches (a) and cells (b)treated by different heating process
X-射线衍射(XRD)可以用来表征淀粉结晶结构的类型和结晶程度,不同热加工方式处理后芸豆淀粉和子叶细胞的 X-射线衍射图和相对结晶度分别如图 2和表 1 所示。芸豆淀粉在 2θ为 5.6°、15.0°、17.1°、18.0°、22.7°处具有强衍射峰,属于C型结晶结构,其相对结晶度为36%,与Li等报导的一致[23]。芸豆子叶细胞在在2θ为7.1°、17.1°,18.0°、22.7°处出现强衍射峰,然而其在5.6°处的衍射峰经冷冻干燥后消失了,这是由于低温冷冻干燥过程中,B型微晶中具有较少折叠的双螺旋的长程晶体会被破坏。Li等[6]也发现鹰嘴豆和芸豆细胞的5.6°处的B-型衍射峰在冷冻干燥过程中被削弱了。与淀粉相比,芸豆细胞的峰强度较弱,相对结晶度(19%)较低,这是由于细胞壁及其蛋白质组分阻碍了X-射线的衍射,导致衍射峰强度显著降低,与之前的报道一致[24]。
淀粉经油炸后,在5.6°处的衍射峰消失,相对结晶度与原淀粉相比下降了9%,说明淀粉的结晶结构在高温油炸过程中受到一定程度的破坏,与其偏光十字变弱结果一致(图1)。史苗苗等[25]也发现油炸破坏了马铃薯淀粉的结晶结构,导致马铃薯的衍射峰变弱。经焙烤后,淀粉的相对结晶度无显著变化(35%)。Varriano-Marston等[10]曾指出,在低水分的焙烤食品中,即使淀粉的糊化率达到11%,也不能改变其结晶结构。然而经高压和常压蒸煮后,淀粉在5.6°,17°,22°和24°处有弱衍射峰,说明其结晶结构由C型变成了B型,这可能是由于芸豆淀粉在蒸煮后冷却及冷冻干燥过程中发成了分子重排和老化现象[26]。芸豆细胞经油炸和焙烤后,峰型无显著变化,但峰强度变弱(相对结晶度分别降低了5%和6%)。经高压和常压蒸煮后,芸豆细胞的结晶度大幅度下降,仅分别为6%和7%,说明内含淀粉颗粒的结构已遭到严重破坏,这与图 1中微弱的偏光十字一致。Li等[27]发现经酸碱浸泡提取的鹰嘴豆细胞经100 ℃常压蒸煮后结晶度仅为5.5%,而经高压蒸煮后结晶度高达11.2%,这是因为高压蒸煮后细胞内的淀粉在糊化后发生了老化现象。
2.3 不同热加工方式对芸豆淀粉及细胞热力学性质的影响
不同热加工方式处理后芸豆淀粉和细胞的糊化温度和焓值如表2所示。糊化温度(To,Tp,Tc)反映淀粉结晶的热稳定性,而糊化焓值(ΔH)与淀粉熔融的双螺旋数目有关[28]。芸豆淀粉的起始糊化温度为61.8 ℃,糊化焓为12.7 J/g,均略低于Li等[12]报道的结果,即芸豆淀粉的起始糊化温度为66.1 ℃,焓值为13.1 J/g。这可能与芸豆的品种,产地等有关。芸豆细胞的起始、峰值、终止糊化温度均高淀粉3~5 ℃,而糊化焓值比淀粉低约3 J/g。这是由于在DSC升温测试过程中芸豆细胞的细胞壁和蛋白质基质限制了内含淀粉颗粒的吸水膨胀和糊化[4,21],因此与淀粉相比,细胞内淀粉需在更高的温度下糊化且糊化的程度较小,与细胞的相对结晶度低于淀粉结果一致。
芸豆淀粉经油炸后糊化温度无显著变化,但焓值显著降低了3.7 J/g(p<0.5),表明油炸对淀粉的有序结构造成一定破坏,这与其偏光十字变弱和结晶度下降(~8%)是一致的。经焙烤后,芸豆淀粉的糊化温度和焓值均显著降低这可能是由于高温焙烤破坏了淀粉颗粒的结晶结构,因此DSC测试过程中较低的温度和较少的能量就能将其双螺旋熔融解旋,与其结晶度降低一致(表2,C-Baked)。Ji等[29]也发现焙烤处理后玉米淀粉的糊化焓值比未处理样品低。淀粉经高压和常压蒸煮后糊化峰消失,说明高温蒸煮已经使得淀粉颗粒充分吸水溶胀糊化,结晶区支链淀粉分子的双螺旋完全解旋,这与其偏光十字消失结果一致。芸豆细胞经油炸和焙烤后,峰值和终止糊化温度升高,但起始糊化温度和焓值差异不显著。这说明在细胞壁及蛋白质基质存在的条件下,高温低水分的热处理对淀粉破坏程度较小,与之前的报道一致[24]。然而子叶细胞经常压和高压蒸煮后,已检测不到糊化焓,这与其结晶度显著降低相符。Ding等[28]也报道过马铃薯细胞在95 ℃常压蒸煮后经DSC检测不到糊化峰,这是因为淀粉产生的膨胀压和细胞壁中果胶的溶解对细胞壁造成很大破坏,导致细胞壁对淀粉糊化的抑制作用消失。

表2 不同热加工方式处理后的芸豆淀粉和淀粉的热力学性质和相对结晶度Table 2 Thermal properties and relative crystallinity of pinto bean starches and cells treated by different heating process
2.4 不同热加工方式对芸豆淀粉及细胞体外消化动力学影响
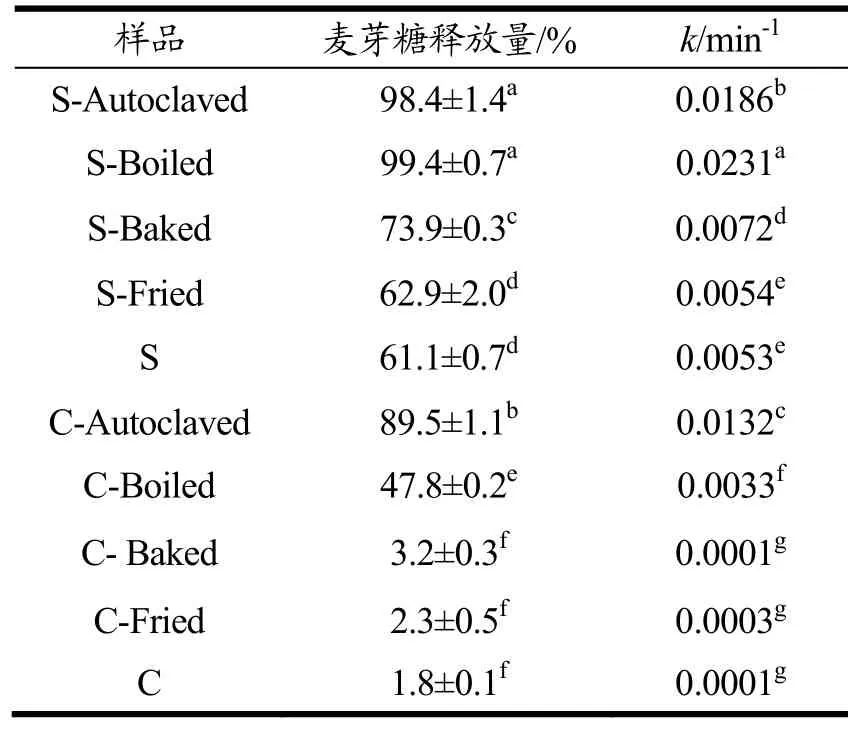
表3不同热加工方式处理后的芸豆淀粉/细胞内含淀粉的表观消化速率常数以及180 min后麦芽糖释放量Table 3 Apparent digestion rate coefficient (k, min-1) and reducing sugar released (%) after 180 min digestion of pinto bean starches and cells treated by different heating process
淀粉的消化速率和程度是决定富含淀粉食物的血糖反应的关键因素,研究淀粉体外水解动力学可以预测淀粉餐后血糖应答,为糖尿病和肥胖症患者提供膳食指南,图 3为不同热处理处理后芸豆子叶细胞和淀粉的消化率随时间变化的消化曲线图。用 Goñi等[30]提出的一级动力学模型可拟合淀粉消化过程曲线,定量分析淀粉的表观消化速率。芸豆细胞和淀粉经一级动力学拟合出的表观消化速率(R2>0.9)和程度如表3。
结合图表可知,淀粉经油炸后表观消化速率和消化程度无显著变化(p>0.05),表明高温(180 ℃)短时(3 min)低水分(~4%)的油炸对淀粉的消化性影响较小。焙烤后淀粉的表观消化速率和消化程度略有增加,说明干热处理后的淀粉颗粒较易于酶解,这是由于高温焙烤使得淀粉颗粒的结晶结构被破坏(偏光减弱,糊化焓值降低),从而导致酶的可及性增大。汝远等[31]发现在150 ℃处理玉米淀粉4 h后,淀粉溶解指数显著升高,可能是干热使淀粉颗粒结构松散,直链淀粉被浸出。高压和常压蒸煮后的淀粉经猪胰α-淀粉酶消化180 min后,几乎完全水解(消化程度约99%)。高温蒸煮使得淀粉颗粒的双螺旋结构完全解旋,α-淀粉酶的结合位点充分暴露出来,导致淀粉酶易于酶解淀粉。Xiong等[32]也报道过蒸煮后的芸豆淀粉酶解180 min后的消化程度为97.1%。未经任何处理的芸豆细胞的表观消化速率和消化程度(0.0001 min-1,1.8%)远低于芸豆淀粉(0.0186 min-1,61.1%),这表明细胞壁和蛋白质基质对淀粉酶的屏障和吸附作用显著阻碍了淀粉酶对底物淀粉颗粒的可及性[33]。
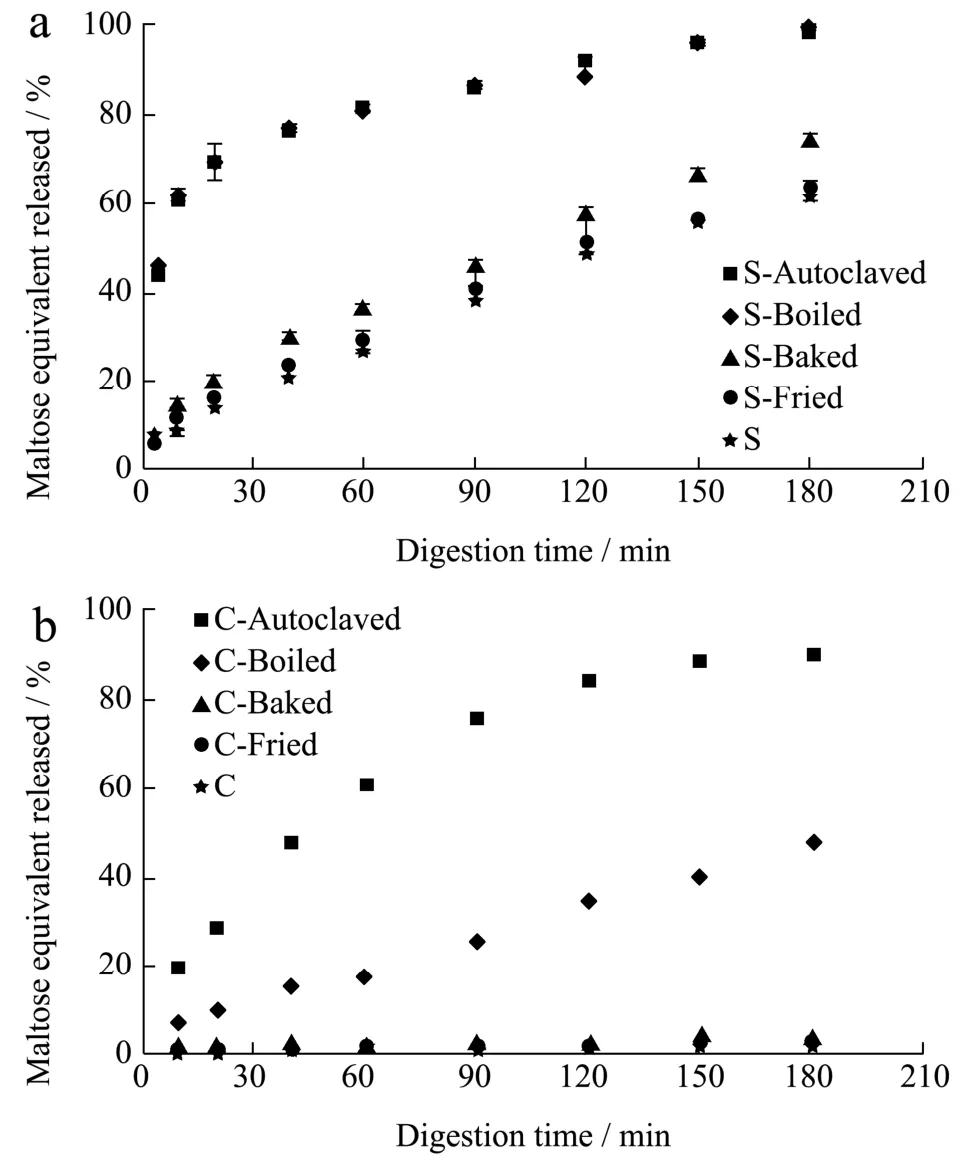
图3 不同热加工方式处理后的芸豆淀粉(a)和细胞(b)中淀粉的消化曲线图Fig.3 Digestograms of pinto bean starches (a) and cells (b)treated by different heating process
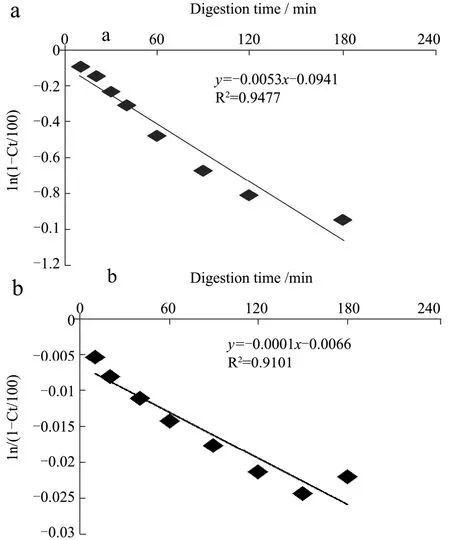


图4 不同热加工方式处理后的芸豆细胞和淀粉消化过程的一级动力学拟合曲线Fig.4 First-order plots of pinto bean cells and starch treated by different heating process
焙烤和油炸处理对芸豆细胞内含淀粉的表观消化速率和消化程度影响较小,这与其结晶结构、热性质变化不大是一致的(表2),这两种热加工方式可制造出低GI的芸豆食品。Tian等[34]研究了不同烹饪方式对马铃薯体的体内体外淀粉消化性,发现油炸马铃薯的血糖指数也比水煮马铃薯低得多。然而经过常压和高压蒸煮处理后,芸豆细胞的表观消化速率和消化程度均大幅度增大,但仍低于相同处理后的淀粉,这是由于高温水热处理导致细胞壁结构被破坏,通透性增大,α-淀粉酶能够穿过细胞壁进入细胞内从而快速酶解糊化的淀粉,而被破坏的细胞壁仍然可以减慢α-淀粉酶向细胞内扩散的速率[27]。值得注意的是高压蒸煮后芸豆细胞的表观消化速率和消化程度分别为常压蒸煮的4倍和2倍,表明高压蒸煮较常压蒸煮对细胞壁的破坏更大,因此导致更大的酶对淀粉的可及性。Li等[27]也发现杂豆细胞内淀粉的消化性取决于加工诱导的细胞壁通透性,与常压蒸煮的鹰嘴豆细胞相比,高压蒸煮的鹰嘴豆细胞显示出更大的细胞壁通透性和更快的体外淀粉消化速率,且无论常压或高压蒸煮,完整细胞内淀粉的消化速率和程度均低于破碎细胞。
2.5 细胞壁通透性观察

图5 浸于FITC-葡聚糖溶液的芸豆子叶细胞的激光共聚焦显微图Fig.5 CLSM micrographs of pinto bean cotyledon cells suspended in FITC-dextran solution
细胞壁结构是限制消化酶与淀粉底物接触/结合的第一道物理屏障。实际上,消化酶穿过植物细胞壁进入细胞和水解产物扩散出细胞的程度取决于细胞壁的孔隙率/通透性。为探究芸豆细胞经不同热加工方式处理后细胞壁通透性的变化,本文选用一种分子尺寸大小与α-淀粉酶(约6.6 nm)相近的FITC-葡聚糖(分子量:20 ku)以模拟淀粉酶进入芸豆细胞的过程,并采用激光共聚焦显微镜进行观察(图 5)。未经处理的芸豆细胞中无FITC-葡聚糖发出的绿色荧光信号,与之前的报道一致[24,32]。这表明α-淀粉酶分子尺寸大于芸豆细胞壁的孔径,因此作为物理屏障阻碍了α-淀粉酶对淀粉的可及性,此结果与芸豆细胞极低的表观消化速率和消化程度一致(表3,C)。芸豆子叶细胞经油炸后,细胞内的荧光最多,这是由于在高温油炸过程中细胞壁中的果胶物质发生β-消除反应而降解,导致细胞壁孔隙率/通透性变大[35]。然而 FITC-葡聚糖虽然能接触到淀粉颗粒,但由于油炸处理过程水分低,淀粉始终未明显糊化,故导致了其低消化性。经焙烤后细胞内的荧光强度微弱,可能是因为经干热处理后细胞内的蛋白质和淀粉可发生交联反应,使得组织较为致密。细胞经常压和高压蒸煮后,细胞壁的孔隙率/通透性增大(细胞内有较多荧光),易于淀粉酶扩散,但纤维素微纤丝形成的细胞壁骨架仍存在,细胞壁的结构较为完整,对淀粉的包裹效应仍存在[4],这一定程度导致了相同热处理条件下,细胞的消化性远低于淀粉。Pallares等[36]也发现刀豆细胞的细胞壁通透性/孔隙率随热处理强度增大而增大,继而调控细胞内淀粉的消化速率。
3 结论
本文研究了高压蒸煮、常压蒸煮、油炸、高温焙烤这 4种热加工方式对芸豆细胞内淀粉结构及消化性的影响规律。高压和常压蒸煮后的芸豆细胞偏光十字强度显著降低,结晶度下降,衍射峰强度变弱。芸豆细胞经油炸和高温焙烤处理后,颗粒形貌无显著性差异,但糊化焓和结晶度略有降低。四种热处理方式均导致细胞壁不同程度的破坏,其中油炸处理对细胞壁通透性增大最明显。焙烤和油炸处理对芸豆细胞内含淀粉的消化程度(~2%)和速率(~0.0001 min-1)影响较小,然而细胞经高压蒸煮和常压蒸煮后,其内含淀粉的消化速率和程度大幅度增加,特别是高压蒸煮,其消化180 min后的麦芽糖释放量达到了89.5%。相同热处理条件下,芸豆细胞的消化速率和程度均远低于芸豆淀粉。这是由于细胞壁和蛋白质等物质的存在,有效抵抗热处理对淀粉结构的破坏,并作为物理屏障阻碍淀粉酶的接触。实验结果可为低GI芸豆类食品的设计和生产提供理论依据和科学指导。

