浓香型白酒窖泥产酸菌协同发酵条件优化
卫春会,张兰兰,罗惠波,刘淼,张宿义,黄治国,邓杰
(1.四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾 644000)
(2.泸州老窖股份有限公司,四川泸州 646000)
中国白酒是一种具有悠久历史的蒸馏酒,很多重要的场合都离不开白酒的身影,白酒已成为我国文化的一部分[1,2]。浓香型白酒由于其与众不同的发酵工艺和独特的风味特征,其生产及销售比例占白酒总量的70%以上,在行业中占有重要地位[3-6]。浓香型白酒窖香浓郁,其香气主要来源于发酵、蒸馏和陈酿过程,其风味物质绝大部分是在发酵阶段产生,是发酵过程中原料在窖池和酒曲微生物及酶作用下的分解产物、微生物的代谢产物、代谢物之间的相互转化[7-11]。窖泥中微生物的种类、数量、种群间的相互作用以及代谢的多样性对白酒品质具有重要影响[12,13]。长期的工艺操作使窖泥富集了种类繁多、功能各异的益于酿酒的微生物菌群[14-17]。产酸菌是最重要的窖泥功能菌之一,如己酸菌和丁酸菌,其数量的多少及功能强弱直接影响着浓香型大曲酒中特征风味物质的形成[18]。但在以往的研究结果中发现,复合功能微生物菌群从香味成分、酒质都明显优于纯功能菌株发酵,如张健等[19]以复合功能菌、纯种己酸菌液、混合培养菌液分别培养人工窖泥,发现在微生物数量及感官评价上,复合功能菌液及混合培养菌液的人工窖泥优于纯种己酸菌培养的人工窖泥。万朕[20]从优质窖泥筛选,2株产酸功能菌,己酸菌BLT-B03产酸量2.50 g/L、丁酸菌BLT-B02产酸量3 g/L,将其与酵母复配得到复合菌液应用于新窖池的强化,经过强化后,新窖池的生产能力已接近 10年窖龄的老窖池水平。任剑波等[21]将优良窖泥功能菌株制成复合功能菌液,并用不同培养配方来培养复合功能菌液,通过对复合功能菌液的外观特征、微生物指标及微量成分分析表明,培养配方对菌液微生物生长、风味物质含量的影响是很明显的。因此,将纯菌种功能菌进行复配,并对其培养配方进行优化研究是很有必要的,有利于改善和提高浓香型白酒的质量。
菌的特性和发酵条件(包括培养基)影响着微生物发酵的生产水平,微生物的发酵产物的形成很大程度上受发酵条件的影响,每一种代谢产物都有其最适培养基配比和生产条件[22,23]。目前对窖泥中功能菌的研究主要集中进行分离筛选及应用于窖泥养护,对功能菌与其它菌种进行复配及培养工艺优化的研究相对较少。本研究在已选育的优良产酸功能菌株的基础上,将其进行协同发酵,采用Box-Behnken Design(BBD)响应面试验确定其产己酸和丁酸协同效果的最优组合,并进行培养条件及培养配方优化。通过不同产酸菌株的协同发酵,以制备产酸复合菌液,强化其发酵代谢产白酒风味物质的含量,从而提高己酸和丁酸产量,为功能菌应用于窖池保养、人工窖泥培养及制作酯化液方面提供理论指导,可有效改善窖泥微生态环境,从而提高浓香型白酒的质量。
1 材料与方法
1.1 菌株与试剂
特基拉芽孢杆菌(Bacillus tequilensis,SJ-1)、空气芽孢杆菌(Bacillus aerius,SJ-3)、丁酸梭菌亚种(Clostridium butyricum subsp,SJ-8),由酿酒生物技术及应用四川省重点实验室从浓香型白酒窖泥中分离筛选并保藏。
试剂:MES和 L-半胱氨酸盐酸盐、琼脂糖(生化试剂),均购自Solarbio;氯化钠、酵母粉、酵母膏、葡萄糖、硫酸钠、碳酸氢钠、磷酸氢二钾、琼脂粉、MgSO4·7H2O、乙酸钠(分析纯),均购自成都艾科达化学试剂有限公司;2-辛醇(色谱纯),成都艾科达化学试剂有限公司;己酸、丁酸(色谱纯),Dr. Ehrenstorfer GmbH公司。
1.2 培养基
1.2.1 RCM培养基(g/L)[24]
蛋白胨10.00、牛肉粉10.00、酵母粉3.00、葡萄糖5.00、可溶性淀粉1.00、氯化钠3.00、乙酸钠3.00、L-半胱胺酸盐0.50、琼脂0.50,pH 6.8,蒸馏水1 L,121 ℃灭菌15 min。
1.2.2 发酵培养基(g/L)
MES 0.50、磷酸二氢钾0.50、硫酸钠0.50、氯化钠 1.00、MgCl2·6H2O 0.40、碳酸氢钠 0.30、CaCl2·2H2O 0.15、酵母浸粉1.00、蛋白胨1.50、葡萄糖0.50、乙酸钠3.00、可溶性淀粉5.00、丁酸钠3.00、L-半胱氨酸盐酸0.25,pH 6.8,蒸馏水1 L,121 ℃灭菌15 min。
1.2.3 富集培养基(g/L)
K2HPO40.40、无水乙醇20.00、酵母膏1.00、乙酸钠5.00、MgSO4·7H2O 0.20、硫酸铵 0.50、黄水0.10,pH 6.8,蒸馏水1 L,121 ℃灭菌15 min。
1.3 仪器与设备
恒温培养箱(LRH-250),上海一恒科技有限公司;全自动高压灭菌锅(HVE),Hirayama;厌氧工作站(AW200SG),金坛市科技分析仪器有限公司;厌氧罐(GM-300),Retsch;氮气吹浓缩仪(BF-2000M),北京八方世纪科技;气相色谱-质谱联用仪 GC-MS(7890A-5975B),安捷伦公司。
1.4 方法
1.4.1 菌株活化
将保藏菌株SJ-1、SJ-3和SJ-8分别接种于RCM液体培养基进行活化,于34 ℃厌氧培养10 d;将窖泥按3%接种于富集培养基中,于34 ℃厌氧条件下培养10 d,制成富集菌液。
1.4.2 菌株复配
将活化后的菌株SJ-1、SJ-3和SJ-8分别制成105个/mL的种子液,于80 ℃水浴处理10 min,分别按5%的接种量接种于发酵培养基中进行协同发酵,于34 ℃厌氧培养10 d,通过GC-MS检测己酸和丁酸的产量;选择产酸能力效果较好SJ-1、SJ-3和SJ-8的作为复配优势菌株,与富集菌液分别按5%接种量接种,制成混菌种子液YY-SJ接种发酵培养基中,于34 ℃厌氧培养10 d,并分析发酵液中己酸和丁酸的含量。
1.4.3 发酵条件优化
在发酵培养基的基础上,分别对接种量、发酵温度、发酵时间进行单因素试验。将活化的混菌种子液YY-SJ于80 ℃水浴处理10 min,选择YY-SJ种子液的接种量分别为 1%、3%、5%、7%、9%、11%;发酵温度分别为24、28、32、36、40、44 ℃;发酵时间分别为4、6、8、10、12、14 d,在厌氧条件下发酵,以己酸和丁酸含量为考察指标并进行验证试验,确定各因素的最佳发酵条件。
1.4.4 优化发酵培养基试验设计[25-27]
1.4.4.1 部分因子试验设计
采用部分因子试验研究影响己酸和丁酸产量的 5个培养营养因子:初始pH(A)、乙醇(B)、蛋白胨(C)、乙酸钠(D)和丁酸钠(E)。每个因素都设高(+l)、中(0)、低(-1)三个水平,以己酸和丁酸的综合值Y作为响应值,试验设计及编码见表1所示。

表1 部分因子试验设计因素水平表Table 1 Factors and levels of fractional factorial design
1.4.4.2 最陡爬坡试验
根据上一步部分因子试验回归方程中各因素的系数确定最陡爬坡试验的步长和爬坡方向,以最陡爬坡试验结果的最大响应值作为Box-Behnken试验分析的中心点[28]。
1.4.4.3 响应面试验设计
由最陡爬坡试验确定了蛋白胨、乙酸钠、丁酸钠3个因素取值的中心点,在优化的发酵条件基础上,运用Design-Expert.V 8.0.6软件和Box-Behnken Design(BBD)设计响应面试验,分别以蛋白胨、乙酸钠和丁酸钠添加量作为变量,并选取适当的水平,以己酸和丁酸的综合值Y为响应值,设计3因素3水平的响应面试验,试验设计的因素水平及编码值见表2。

表2 响应面试验因素及水平Table 2 Factors and levels of central composite design
1.4.5 样品处理方法
取10 mL发酵液,酸化处理调节pH至4,添加15%的无水乙醚作为萃取溶剂,充分震荡15 min,静置分层2 h,再次震荡10 min,使有机相充分溶于萃取试剂中,再静置8 h分层。吸取上层有机相于离心管中,以6000 r/min离心10 min,吸取上清液,氮吹浓缩0.5 mL于进样瓶中,加入一定量的2-辛醇作为内标混匀,进行GC-MS分析。
1.4.6 丁酸和己酸定性和定量分析方法[29]
气相色谱(GC)条件:DB-WAX(60 m×250 μm×0.25 μm)色谱柱;载气为高纯He,流速1 mL/min,进样口温度230 ℃;程序升温:初始温度为60 ℃保持1 min,然后以8 ℃/min的升温速率升至180 ℃保持2 min,再以15 ℃/min到230 ℃,保持5 min。
质谱(MS)条件:电子离子源(EI),70 eV电子能量,采集模式为全扫描,质量范围20 u~550 u,离子源温度230 ℃,四级杆温度150 ℃,接口温度230 ℃。
定性方法:将所得质谱图与NIST05a.L标准谱库比对,选择匹配度大于80(最大值为100)特征离子进行定性分析。
定量方法:内标法。以30 mg/100 mL的2-辛醇为标准物,根据公式1得出丁酸和己酸的含量。

式中,i:相对校正因子,其中i(己酸)=0.98,i(丁酸)=1.12;As:待测物峰面积;Ci:标准物浓度(mg/100 mL);Ai:标准物峰面积;Cs:待测物浓度(mg/100 mL)。
1.4.7 数据处理
采用Design-Expert.V 8.0.6软件进行响应面试验设计,并利用SPSS 16.0统计软件对试验结果进行多重比较与q检验。重复3次。
在响应面分析中,对己酸和丁酸的检测指标采用Hassan方法,将各指标均归一化为0~1之间的值。如公式2:

式中:di:每组试验所测得的真实值;dmax:试验组中的最高值;dmin:试验组中的最低值。
考虑到己酸和丁酸均是浓香型白酒的主要风味物质前体。因此,将己酸和丁酸的权重值分别设为0.5,得到己酸和丁酸的综合值Y,如公式3:

2 结果与分析
2.1 菌株协同发酵风味物质结果分析
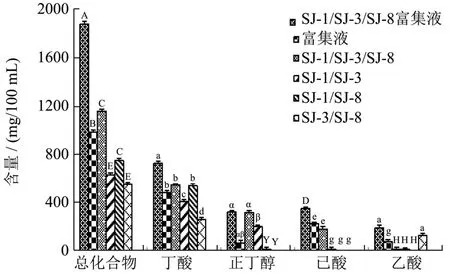
图1 不同菌株协同发酵对产物挥发性化合物含量的影响Fig.1 Effects of different bacterial strains on the volatile compounds content of the products by collaborative fermentation
在前期单菌发酵的风味物质检测的研究结果表明,SJ-1、SJ-3和SJ-8的风味物质较好,且具有产酸功能,其对浓香型白酒的风味有一定的贡献。其中SJ-1、SJ-8产丁酸,且SJ-8丁酸产量为378.63 mg/100 mL,SJ-3产己酸乙酯和丁酸乙酯分别为36.73 mg/100 mL、34.63 mg/100 mL;将菌株SJ-1、SJ-3、SJ-8作为优势菌株与富集菌液协同发酵时,产物挥发性总化合物、己酸和丁酸含量显著高于其他各菌株协同发酵及富集液单独发酵(p<0.05),此结果与杨爱华[30]、陈新杰[31]、曹新志[32]等研究关于多种产酸菌混合培养产酸量优于单一产酸菌培养相似。将两种或两种以上菌种混合培养可形成“互补”作用,不同菌群产生的代谢产物、代谢酶系等物质能互为利用,从而有利于产物的积累[32,33]。不同菌株组合的协同发酵代谢产物试验结果如图1所示。
2.2 菌株协同发酵条件及验证
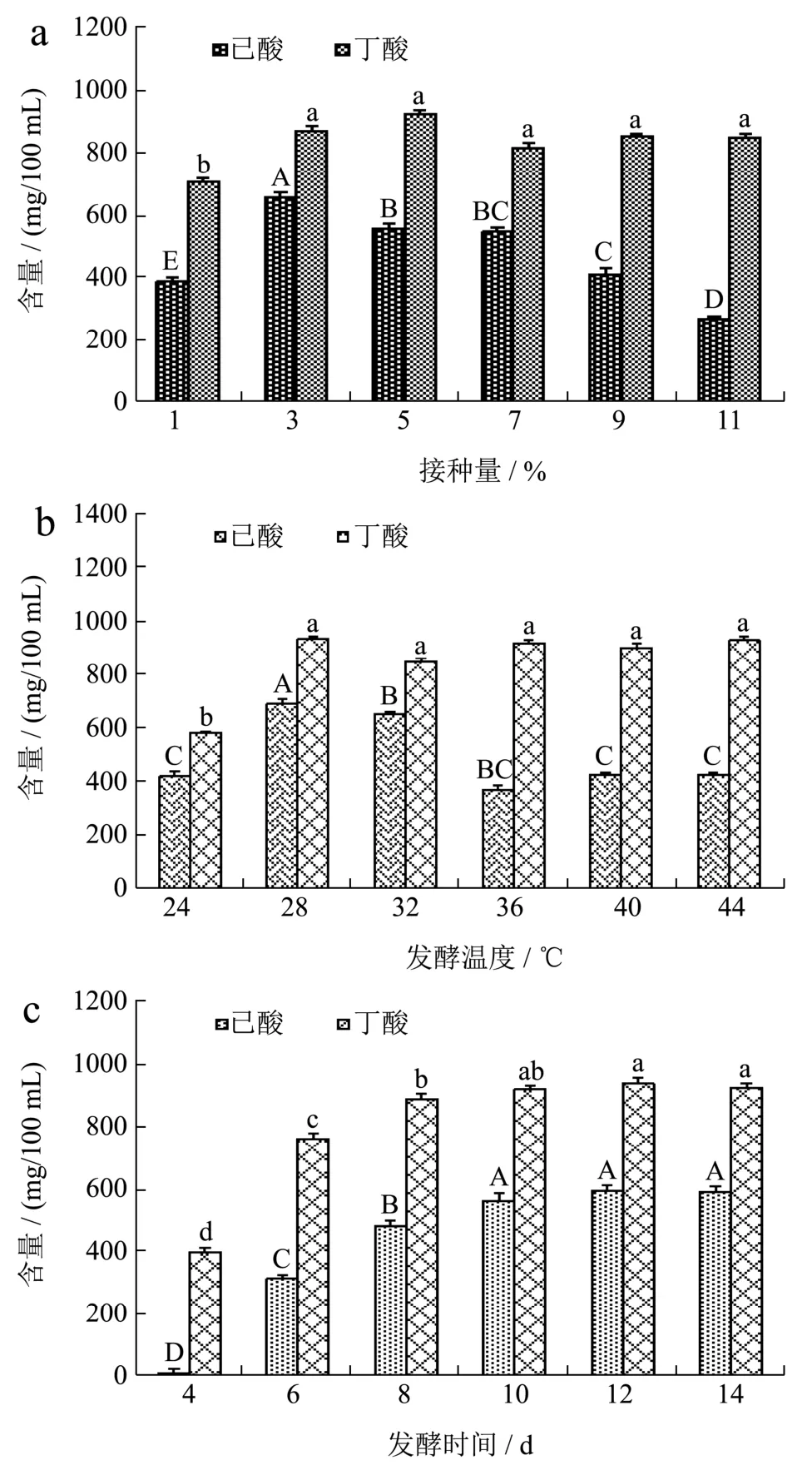
图2 接种量(a)、发酵温度(b)、发酵时间(c)对己酸和丁酸含量的影响Fig.2 Effects of inoculation amount (a), fermentation temperature (b) and fermentation time (c) on the production of hexanoic acid and butyric acid
接种量的多少影响菌种在发酵过程中的生长速度,从而直接影响发酵周期[34]。由图 2a可知,己酸含量随接种量的增加呈上升后下降趋势,且在接种量为3%时,己酸量达到最大值,为658.13 mg/100 mL,产己酸量显著高于其它接种量(p<0.05);丁酸含量随接种量增加呈上升后趋于稳定趋势,在接种量为 3%时,丁酸量为871.96 mg/100 mL,丁酸含量变化稳定无显著差异(p>0.05)。这说明在菌株接种量为3%时,产酸细菌活力强,协同作用达到了最优值,故选择接种量为3%。
由图2b可知,发酵温度对己酸的产量呈先上升后下降的趋势,当发酵温度为28 ℃时,己酸和丁酸产量都达最高,分别为692.09 mg/100 mL、933.34 mg/100 mL,产己酸量显著高于其它发酵温度(p<0.05);丁酸含量随发酵温度的增长呈上升后趋于稳定(p>0.05)。浓香型白酒糟醅发酵温度一般不高于35 ℃左右,适当的温度对发酵过程中产酸和产酯有积极影响,有利于功能菌快速被激活、繁殖及代谢,从而提高白酒质量[35,36],这说明该结果符合实际生产的需求。故选择发酵温度为28 ℃。
由图2c可知,在发酵4~10 d时,己酸和丁酸量随发酵时间的增加呈上升趋势(p<0.05);在12~14 d时,己酸和丁酸含量趋于稳定且显著高于4~10 d的产量(p>0.05),在发酵时间为12 d,己酸和丁酸产量均达到最高,分别为593.68 mg/100 mL、937.35 mg/100 mL。这可能是因为随着发酵时间的增长,培养基中的营养物质减少,且菌株发酵代谢产物过多可能抑制了菌株的协同发酵作用[34]。故选择发酵时间为12 d。通过验证试验结果表明:发酵条件最优因素水平组合的丁酸和己酸都含量显著高于各对照组(p<0.05),如图3所示。
2.3 发酵培养基响应面试验结果
2.3.1 部分因子试验
通过选用N=5、试验组数为16次的部分因子试验,确定培养基的主要影响因子,试验设计及测定结果见表3,方差分析见表4。
由表3和表4可知,蛋白胨(C)对综合值Y的具有极显著影响(p<0.0001),pH(A)、乙醇(B)、乙酸钠(D)和丁酸钠(E)对综合值 Y具有显著影响(p<0.01);模型中的交互项AE和BD对综合值Y具有极显著影响(p<0.0001);对部分因子试验结果进行回归分析,模型的决定系数R2=0.988,表明回归方程模型有效;根据效应系数,乙酸钠、丁酸钠对综合值Y为正影响,pH、乙醇、蛋白胨对综合值Y为负影响。

表3 部分因子试验设计及测定结果Table 3 Results of factor test design and measurement
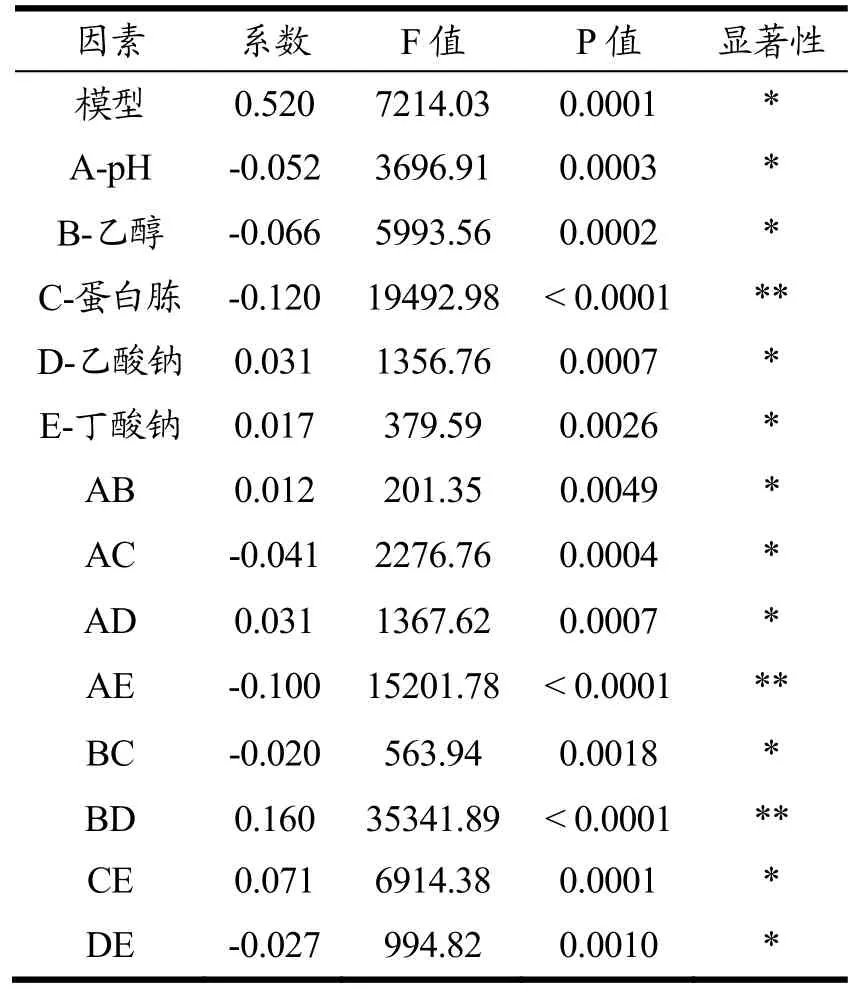
表4 部分因子试验方差分析Table 4 Factor test analysis of variance
2.3.2 最陡爬坡试验
响应面拟合方程只在接近最佳值考察区域才近似真实情况,为了建立有效的响应面拟合方程则需逼近此区域,常用最陡爬坡法快速逼近最佳值区域[37]。因此为了最大限度接近丁酸和己酸产量的真实值,选择pH、乙酸钠、丁酸钠和蛋白胨作为无乙醇条件下的变量,适当降低蛋白胨用量、pH值,增加乙酸钠和丁酸钠的用量。结果见表5。
己酸和丁酸的综合值Y随培养基中各组分含量的变化呈现先上升后下降的趋势。第4组、5组试验中己酸、丁酸的含量分别达到最大值,其中第4组试验中综合值Y为0.960,达到最优试验结果,表明各显著影响因素在培养基中各组分的含量已接近最佳浓度范围。即pH为6.4,蛋白胨为5.4 g/L、乙酸钠为4.8 g/L、丁酸钠为 4.2 g/L,以此浓度为中心点进行下一步Box-Behnken 试验分析。
2.3.3 Box-Behnken试验设计
通过Design-Expert.V 8.0.6软件进行BBD试验设计及数据进行多元二次回归拟合,以Y综合值为响应值,析因部分试验 12次,中心点重复试验次数为 5次。BBD试验设计及结果见表6。全变量编码水平的二次回归方程如下:
Y=0.86-0.044A+0.19B+0.21C-0.056AB-0.12AC-0.056BC- 0.29A2-0.21B2-0.17C2
由表7方差分析可知:该二次回归模型p<0.01,达到极显著水平;模型中失拟项p=0.0654>0.05,表明失拟项不显著,说明该试验模型可以相对客观良好反应各个因素与Y综合值之间的关系;回归方程决定系数R2=0.8992,确定因素R2adj=0.7697,说明该模型可解释90%响应值变化,即Y综合值的变化有90%来自所取自变量因素蛋白胨、乙酸钠、丁酸钠3项条件的变化。该二阶回归方程对实验拟合情况好,说明试验方法的可靠性比较高,可用发酵产己酸和丁酸对试验综合评分值的理论预测。回归方程中C、A2对综合评分值极显著(p<0.01),B、B2对综合评分值影响显著(p<0.05),A、AB、AC、BC、C2不显著(p>0.05)。由此可知,各因素对己酸和丁酸产量综合值Y的影响程度主次顺序为:C>B>A,即丁酸钠>乙酸钠>蛋白胨。

表5 最陡爬坡试验设计及结果Table 5 Experimengal design and results of steepest ascent path

表6 BBD试验设计及结果Table 6 Box-Behnken design and corresponding results
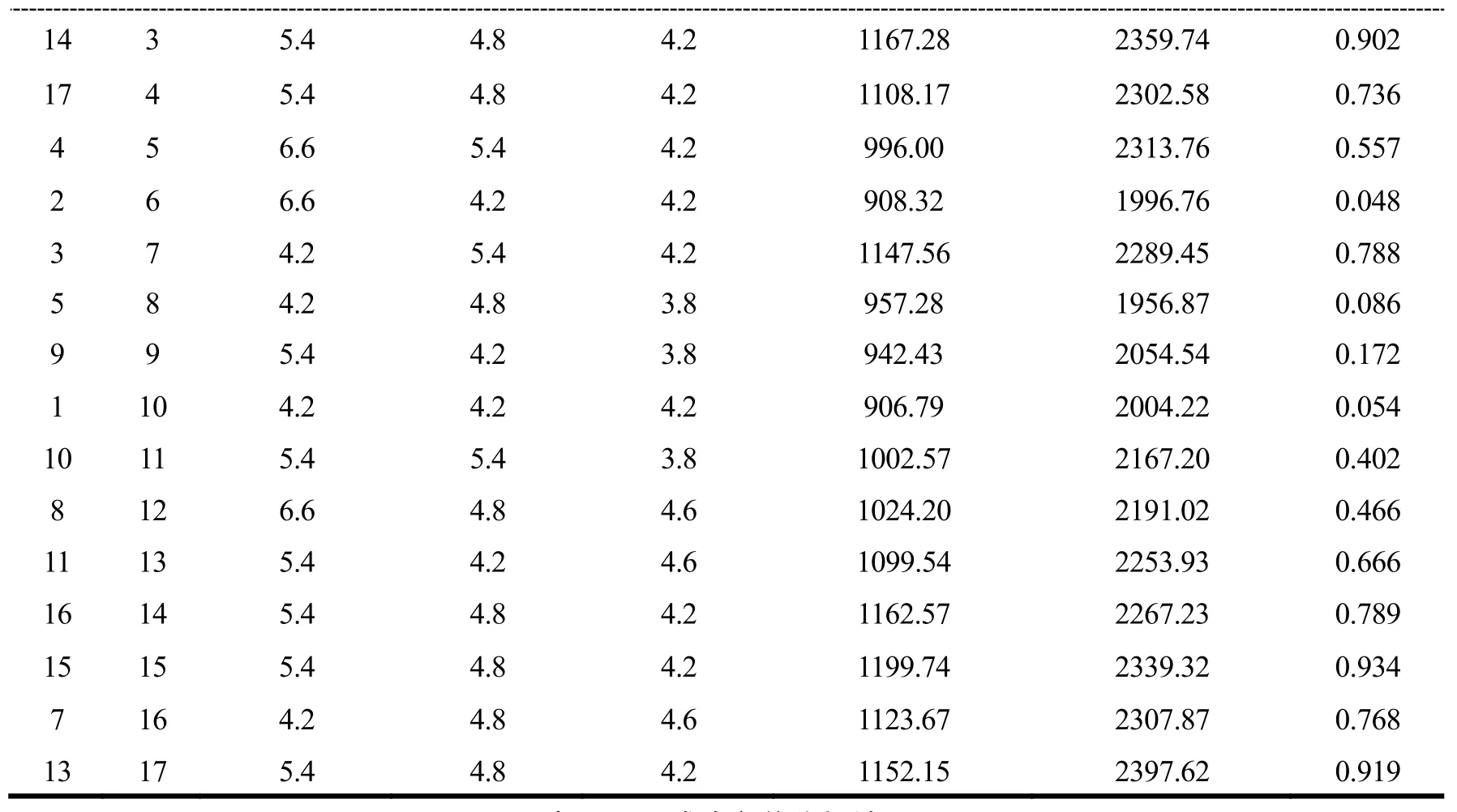
14 3 5.4 4.8 4.2 1167.28 2359.74 0.902 17 4 5.4 4.8 4.2 1108.17 2302.58 0.736 4 5 6.6 5.4 4.2 996.00 2313.76 0.557 2 6 6.6 4.2 4.2 908.32 1996.76 0.048 3 7 4.2 5.4 4.2 1147.56 2289.45 0.788 5 8 4.2 4.8 3.8 957.28 1956.87 0.086 9 9 5.4 4.2 3.8 942.43 2054.54 0.172 1 10 4.2 4.2 4.2 906.79 2004.22 0.054 10 11 5.4 5.4 3.8 1002.57 2167.20 0.402 8 12 6.6 4.8 4.6 1024.20 2191.02 0.466 11 13 5.4 4.2 4.6 1099.54 2253.93 0.666 16 14 5.4 4.8 4.2 1162.57 2267.23 0.789 15 15 5.4 4.8 4.2 1199.74 2339.32 0.934 7 16 4.2 4.8 4.6 1123.67 2307.87 0.768 13 17 5.4 4.8 4.2 1152.15 2397.62 0.919

表7 BBD试验方差分析结果Table 7 The results of anova analysis of Box-Behnken design
2.3.4 显著因素水平的优化
为了更直观反映蛋白胨(A)、乙酸钠(B)和丁酸钠(C)添加量之间的交互作用对综合值 Y的影响,利用Design-Expert软件绘制出各因素与响应值之间三维空间曲线图和等高线图,如图 4。响应面图形的响应值是实验中各试验因子A、B和C两两交互作用,及最佳参数和各参数之间的相互作用所构成的曲面图;曲面越陡峭,各因素对响应值的影响就越显著;同一等高线上的每个点代表的数值相同,而等高线的形状可反映各因素之间交互作用的显著性,等高线为椭圆形,则试验因子两两交互作用差异性显著,若为圆形则差异性不显著[38-40]。
回归模型存在稳定点蛋白胨A、乙酸钠B、丁酸钠C的编码值分别为5.10、5.04、4.45,此时Y综合值为0.962,己酸和丁酸的产量分别为1184.21 mg/100 mL和2387.84 mg/100 mL。即当蛋白胨、乙酸钠和丁酸钠的添加量分别为5.10、5.04和4.45 g/L时,该模型预测的最大Y综合值为0.962,己酸和丁酸的产量最大估计值分别为 1184.21 mg/100 mL和 2387.84 mg/100 mL。


图4 蛋白胨A、乙酸钠B和丁酸钠C添加量三因素交互作用对综合评分值的影响Fig.4 Effect of three factors of peptone sodium A, acetate B and butyrate C amount on the composite score value
2.3.5 验证试验
为表明响应面模型的有效性,对其结果及其验证试验。利用优化后的发酵培养基条件(蛋白胨5.10 g/L、乙酸钠5.04 g/L、丁酸钠4.55 g/L)进行3组平行试验,产己酸含量和丁酸含量分别为 1156.21、2345.84 mg/100 mL;以未优化发酵培养基为对照组进行验证试验,且试验结果与模型预测值进行对比,其结果见图5所示,应用优化后的发酵培养基发酵产物己酸和丁酸含量都显著高于优化前(p<0.05)(图5a);验证试验结果与模型预测值差异不显著(p>0.05)(图5b)。

图5 营养因子优化验证Fig.5 Nutrient factor optimization verification
3 结论
3.1 本研究通过对特基拉芽孢杆菌(Bacillus tequilensis,SJ-1)、空气芽孢杆菌(Bacillus aerius,SJ-3)、丁酸梭菌亚种(Clostridium butyricumsubsp,SJ-8)3株菌株与优质窖泥富集菌液分别按5%的接种量进行复配;通过单因素试验和响应面优化得到最佳发酵条件:接种量 3%、培养温度 28 ℃、发酵时间12 d、pH 6.4、蛋白胨5.10 g/L、乙酸钠5.04 g/L和丁酸钠4.45 g/L;丁酸钠对己酸和丁酸的产量影响极显著(p<0.01),乙酸钠影响显著(p<0.05),而蛋白胨不显著(p>0.05),但蛋白胨的二次项影响极显著(p<0.01)。在优化后的最佳发酵条件下代谢产生的己酸和丁酸产量分别为1156.21、2345.84 mg/100 mL,相较于初始条件,优化后的发酵条件使己酸含量和丁酸含量分别增加了3.32倍和3.22倍。结果表明:将不同产酸菌株进行协同发酵有利于提高己酸和丁酸的产量,其中特基拉芽孢杆菌SJ-1、空气芽孢杆菌SJ-3、丁酸梭菌亚种 SJ-8和富集菌液协同发酵产己酸和丁酸的量最佳;发酵培养基的营养因子影响己酸和丁酸的生成。
3.2 白酒酿造过程中,功能菌液的质量影响着窖泥微生物生态功能,进而影响白酒的质量和风格特征,通过厌氧梭菌和芽孢杆菌的复配工艺研究并优化其产酸培养基,以此来强化其发酵代谢产白酒风味物质的含量,同时为功能菌在浓香型大曲酒的养窖、护窖、培养人工窖泥、制作酯化液等应用方面提供理论参考,以改善和提高浓香型大曲酒的质量。

