短期大剂量糖皮质激素治疗对骨转换指标、骨密度和骨小梁评分的影响
陈康 陈升浩 李克乾 李磊 易剑华
湖北医药学院附属随州医院(湖北省随州市中心医院)骨科, 湖北 随州 441300
糖皮质激素(glucocorticoid,GCs)由于其抗炎症和免疫抑制作用,在临床实践中得到了广泛的应用。据估计[1],有0.5%~0.9%的人使用过GCs,但GCs的使用有许多副作用。长期服用GCs是骨丢失的危险因素,是继发性骨质疏松最常见的原因[2-3]。GCs所致骨质疏松的发病机制是多因素的。在长期GCs使用者中,骨丢失的主要机制是由于成骨细胞介导的成骨受损和骨形成减少,特别是在早期阶段;GCs也刺激破骨细胞的形成和增强其活性,导致骨吸收增强,最终出现骨量丢失[4-5]。骨丢失不是线性的,在治疗早期表现的更为明显,然后随着时间的推移而减缓。总之,长期使用GCs出现骨丢失是一个众所周知的问题,但对短期大剂量使用GCs对骨骼的影响却知之甚少。本研究选择需要进行大剂量GCs(>1.5 g/d)静脉注射治疗的Graves眼病患者(没有伴发的骨骼疾病),并前瞻性地收集了相关资料,检测和分析患者血清骨代谢指标、骨密度(bone mineral density,BMD)和骨小梁指数(trabecular bone scores,TBS)的改变,以评估这种特定GCs治疗方案对骨健康的影响。
1 材料和方法
1.1 研究方案
本研究纳入2017年1月至2018年4月在湖北医药学院附属随州医院进行诊治的依照EUGOGO标准[6]诊断为重度活动期Graves眼病的33例患者(女性19例,男性14例,年龄40~60岁,中位年龄49岁)。中位体质量指数(body mass index, BMI)为24.5 kg/m2(19.1~37 kg/m2)。所有患者在开始静脉GCs治疗后均恢复正常。排除标准如下:患有甲减、维生素D降低、影响骨骼的急慢性疾病;前6个月接受过已知影响骨代谢的药物治疗;吸烟者(超过10支/d)、酗酒者、孕妇、处于更年期(过去5年内);患有骨质疏松性骨折或有此家族病史。
1.2 方法
甲基强的松(辉瑞公司生产,40 mg/支)推荐剂量为0.5 g/周,连续6周,以后每周0.25 g,连续6周(累积剂量4.5 g)。分别于治疗前、治疗后1周、开始GC治疗后第1、3、6、12个月采血进行骨代谢指标分析。所有病例均在07:30~10:00采集样本。采用化学发光酶联免疫法分析血清I型胶原羧端端肽(CTX)、氨基端I型胶原前肽(P1NP)、骨碱性磷酸酶(BALP)、甲状旁腺素(PTH)和25羟维生素D (VD)的水平;参考变异系数(CV):BALP为4%~6%、CTX为2%~7%、P1NP为2%~4%、PTH为3%~6%、VD为4%~7%;检测的试剂盒均由德国罗氏公司提供。使用Hologic QDR2000型骨密度仪在基线、6个月和12个月后进行腰椎(L1~4)和髋部骨密度(BMD)及腰椎骨小梁分数(TBS)检测。数据记录为骨密度(g/cm2)和T值。对于所有受试者,TBS和BMD都是使用快速阵列成像模式获得的,因为程序执行得更快,涉及的辐射剂量更低,同时确保了与阵列模式相同的性能[7]。TBS按照制造商推荐的标准分析程序进行:使用Insight软件(版本1.8.0.0)根据DXA腰椎图像进行计算。所有的测量均由同一个操作员进行。
1.3 统计学分析
所有检测的结果均使用中位数表示;GCs治疗过程中指标的变化使用Friedman或Wilcoxon试验进行评估。在所有试验中,P<0.05表示比较差异有统计学意义。所有均数均使用SPSS 19.0统计软件进行分析。
2 结果
研究人群的基线临床和密度特征见表1。
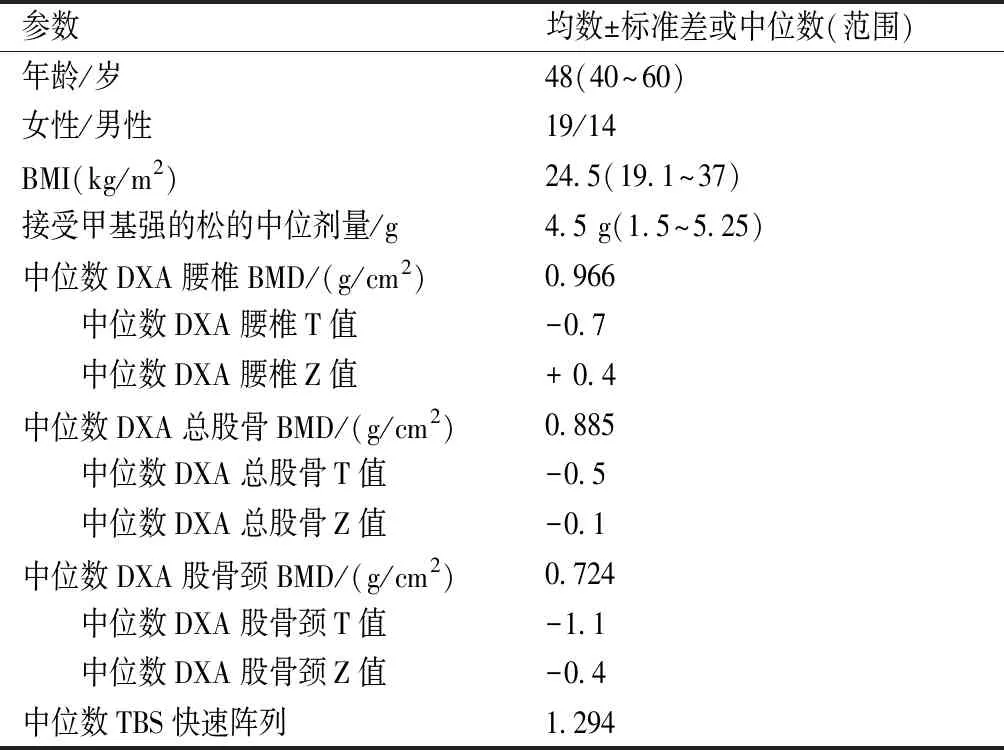
表1 研究人群的人口统计学、临床数据和基线密度测量结果
在6个月和12个月时,腰椎、全髋或股骨颈骨密度及腰椎TBS没有变化(表2)。
治疗期间未发现VD有显著改变(表3)。CTX水平在开始治疗后1个月(第三次剂量为0.5 g甲基强的松后)显著下降,基线和1个月时的中位数分别为197.5 pg/mL和85.9 pg/mL,这意味着CTX比基线降低49.31%(P=0.019 5)。通过后续检测,3个月时CTX恢复到基线水平 (中位数为181.2 pg/mL,比前一次测量上升了95.84%,但没有统计学意义,P=0.160)。然后CTX在12个月时达到峰值,虽然没有达到显著水平,但仍高于基线水平(12个月时的中值为233.7 pg/mL,较基线水平上升了22.15%,P=0.278)。
在整个研究期间,其他骨代谢标志物的变化趋势被绘制出来,但没有出现明显的变化(图1)。P1NP与基线水平(至治疗后12个月)相比略有下降(P<0.05),且在12个月时最为明显(基线时为81.4 μg/L,12个月时为52.9 μg/L),下降22.12%。
在整个研究过程中,PTH基本没有改变,尽管研究结束时其水平高于基线水平(基线为18.6 ng/L,12个月时为26.4 ng/L,上升了33.25%)。BALP也基本保持不变,仅在开始治疗后略有下降,12个月时的终值略高于基线(中位数为13.47%)。
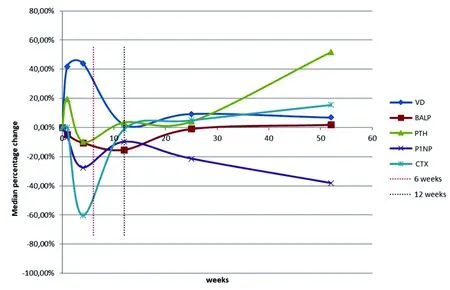
图1 GCs给药对骨代谢生化参数的影响Fig.1 The effect of GCs administration on the biochemical parameters of bone metabolism注:在基线、1周和治疗开始后第1、3、6、12个月,测量VD、BALP、PTH、PINP和CTX水平。红色虚线表示使用甲基强的松剂量第6周,黑色虚线表示停药第12周。

表2 研究人群的基线、6个月和12个月的骨密度测定结果
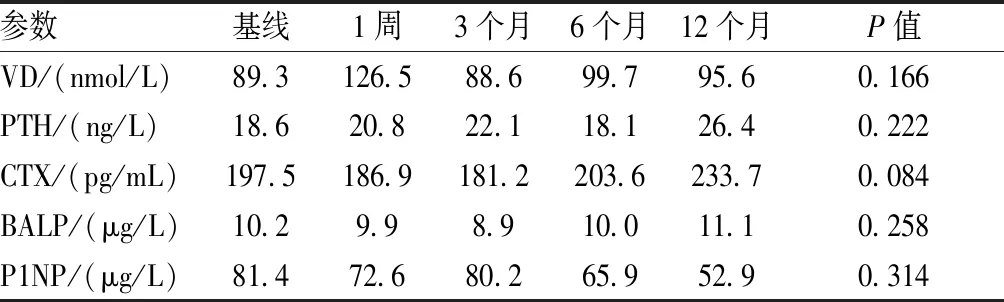
表3 研究人群的生化结果、中位数
3 讨论
骨重建分为两个阶段:骨吸收和骨形成。简单地说,在一个持续4~6周的阶段,破骨细胞去除骨组织,形成骨吸收空洞,骨分解产物释放到血液中。随后就是骨形成阶段,在这个阶段,成骨细胞用新骨填充这些空洞(释放骨形成标志),然后新生骨组织进行矿化。骨形成的整个过程总共需要4~5个月[8]。CTX和P1NP分别被认为是骨吸收和骨形成的参考指标[9]。CTX是Ⅰ型胶原降解的产物,对骨具有特异性。P1NP是Ⅰ型前胶原裂解后产生的衍生物,主要来源于骨[8]。已知糖皮质激素治疗可抑制骨形成,在本研究中,这反映在P1NP水平的快速降低,即使在GCs停药后仍保持低于基础水平。本研究未发现VD改变显著,表明短期大剂量使用GCs对血清VD影响不明显。
GCs对骨吸收的影响尚不明确[10]。在之前的研究中,CTX在每天服用60 mg泼尼松1周后下降,但即使是较低剂量(泼尼松每天10 mg,超过1周)也会使CTX水平降低10%[11]。Ton等[10]在对绝经后妇女进行的一项对照试验中,每天服用5 mg泼尼松,持续6周,在开始治疗4周后发现CTX显著降低。本次研究结果证实了上述研究中关于低剂量GCs对骨骼的短期影响结果[10],在治疗4周后观察到CTX水平显著降低。即使继续治疗,CTX在3个月后也恢复到基线水平。这可以反映出骨骼适应泼尼松剂量的变化(6周后,从0.5~0.25 g/周或从0.25 g/周变为无)。中位值在12个月时(上升22.15%)高于基线,表明转换率略高,这与长期GCs治疗停药后GCs对骨的影响可逆性的证据相一致[12]。
本研究观察到患者BALP水平在整个研究期间保持不变,证实了之前的报告[13]。其原因可能在于GCs对骨骼的作用机制,或者可能是BALP基因不直接受GCs影响[14]。至于GCs对BMD水平的影响,本研究中的受试者在6个月和12个月时的BMD与其基线水平没有差异。同样,此次数据与Dovio等[13]先前报告的一致,他们发现在10 d内给予15 mg/kg甲基强的松治疗多发性硬化患者后6个月内其BMD没有变化。本研究观察了更长时间内药物停用是否会产生任何影响。因此也检查了12个月的BMD,结果显示和基线及6个月时仍然没有显著差异。同时本研究还观察了短期高剂量GCs是否会影响骨微结构,结果显示患者在6个月和12个月时其TBS没有变化,表明用于临床的短期大剂量GCs治疗方案不会对骨矿物质含量或骨微结构产生负面影响。
当然,本研究也存在一定的局限性。首先,尽管短期大剂量使用GCs未发现会对骨骼健康产生显著的影响,但是本研究纳入的样本包括绝经前和绝经后的女性以及男性,且年龄范围较广,因此很难保证本研究结果的推广应用;其次样本量较少且为同一家医院研究所得结果,很难保证适合所有人种和不同年龄段的患者。总之,短期高剂量GCs治疗仅显示出对骨转换标志物的短暂影响,并没有引起BMD或TBS的任何显著降低。由于样本量不足,需要进一步的研究来证实此次研究结果。

