高龄老年患者抗生素相关性腹泻的临床观察及易感因素分析
王悦之,赵 坚,张 玉
1.复旦大学附属华山医院老年医学科,上海 200040; 2.上海市第六人民医院金山分院老年医学科
抗生素相关性腹泻(antibiotic associated diarrhea,AAD)也称抗生素相关性结肠炎,是抗生素使用后的一种常见不良反应。几乎所有的抗生素均可能引起AAD,按照疾病程度不同,可以分为单纯腹泻和伪膜性结肠炎或艰难梭菌相关性腹泻(clostridium difficile-associated diarrhea,CDAD)等两种类型[1]。单纯腹泻病情轻,容易治疗。伪膜性结肠炎病情严重,如不及时认识,给予合理治疗,可导致并发症,死亡率为15%~24%[2]。
AAD的发病率为5%~30%[1,3],老年患者,特别是高龄老年患者,由于存在机体功能衰退、肠道消化能力减退及抵抗力下降等诸多特殊因素,是目前公认的AAD高发人群[4],发病率可高达40%。此外,合并症、药物、医疗和手术干预以及潜在的医疗保健均有可能进一步促进老年患者感染的获得和不良的临床结果[5],从而增加医疗费用和社会负担。由于老年患者宿主的复杂性和AAD感染的不良预后等[5],需要更多的研究来剖析潜在的机制,以便制定适合这一弱势群体的治疗方案。此外,还需要积极寻找AAD的其他病因和更有效的治疗方法。
目前我国高龄老年比重逐年上升,但有关高龄老年患者的AAD报道极少,本文通过回顾性病例对照研究,分析使用抗生素的高龄老年住院患者的临床特点和发生AAD的易感因素,为有效预防AAD的发生提供防治策略。
1 资料与方法
1.1 研究对象回顾性分析2018年1月至2019年6月入住复旦大学附属华山医院老年医学科的应用抗生素治疗的患者资料,根据我国高龄老人标准(老年标准),收集的患者年龄≥80岁,并记录主要诊断、并发症、抗生素使用、其他药物使用、饮食习惯、腹泻发生情况以及实验室检查结果和预后情况。既往有急性和慢性胃肠道疾病患者(如胃肠道肿瘤、肠道手术后、肠易激综合征、缺血性肠炎及炎症性肠病等,食物中毒、急性胃肠炎、服用泻药等)被排除在研究之外。用年龄校正的Charlson共病指数(age-adjusted Charlson comorbidity index,aCCI)[6]和老年营养风险指数(geriatric nutritional risk index,GNRI)[7]分别评价患者的共病和营养状况,其中GNRI<98分提示有营养风险。最终共收集158例患者资料,男126例,女32例,其中AAD患者49例,为AAD组,这些患者均接受抗生素治疗≥3 d,静脉或口服治疗,单用与联合应用不限。其余109例患者为非AAD组。
1.2 诊断标准目前,除了CDAD有实验室和肠镜的诊断依据外,广义的AAD诊断主要是排他性诊断为主,此次AAD组的入选对象参照中华人民共和国卫生部2001年发布的《医院感染诊断标准(试行)》[8]。腹泻被定义为≥3次/d的松散排便,如水样便、黏液脓血便或见斑块条索状伪膜。在2周内有抗生素使用史且无其他可解释的原因。病原学诊断标准为在临床诊断基础上符合下述三项之一即可诊断:(1)大便涂片或培养发现菌群失调或有意义的优势菌;(2)做纤维结肠镜检查见典型伪膜性肠炎表现;(3)细菌毒素测定证实。需排除其他原因引起的腹泻,如胃肠道肿瘤、肠道手术后、肠易激综合征及感染性肠病。AAD组中所有入选对象均符合病原学诊断标准(1),其中8例艰难梭菌毒素检测呈阳性。

2 结果
2.1 一般资料所有患者的年龄为80~95岁。这些老年患者均是多病患者,除各种急性疾病,如肺炎、尿路感染、呼吸功能不全等,多数患者还合并各种慢性基础疾病,其中最常见的疾病有心血管系统疾病(冠心病、高血压、心力衰竭等)110例;呼吸系统疾病(慢性阻塞性肺病、支气管哮喘等)40例;神经系统疾病(脑梗塞、痴呆、帕金森病等)37例;糖尿病21例。用aCCI评价患者的多病情况,以及GNRI评价患者的营养状况,卧床时间>8周考虑长期卧床,考虑到益生菌对于腹泻的作用,专门统计了在抗生素使用前使用过益生菌治疗的患者,单独列为一项,将两组患者的所有资料应用SPSS 22.0统计软件建立数据库并进行统计分析,结果显示,两组患者在共病指数、营养风险指数、长期卧床及抗生素使用种类和使用时间方面相比,差异有统计学意义(P<0.05)。两组患者在年龄、性别、使用PPI、慢性肾功能不全、使用益生菌、联合应用抗生素等因素方面比较,差异无统计学意义(P>0.05)(见表1~2)。
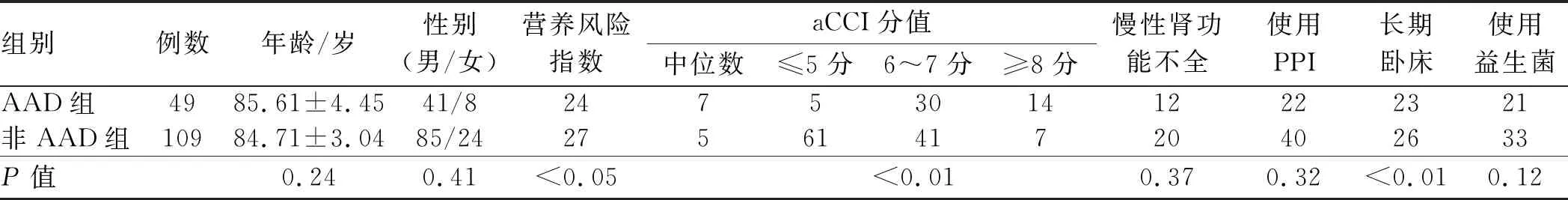
表1 两组患者临床资料比较 Tab 1 Comparison of clinical data between the two groups
2.2 抗生素的使用所有患者中,联合使用抗生素者53例,其中AAD组20例。抗生素连续使用时间为3~32 d,其中AAD组有21例患者使用时间超过2周,与对照组相比,差异无统计学意义(P>0.05)。但把统计时间增加到3周时,AAD组的比例明显高于非AAD组(P<0.05)。关于抗生素的使用种类的统计,考虑到目前临床上使用头孢或青霉素与酶抑制剂合剂的患者比例较高,且酶抑制剂对AAD可能存在一定的影响,故单独列一类。两组中各抗生素使用分别是头孢或青霉素与酶抑制剂合剂共44例,青霉素类17例,三代或四代头孢42例,碳青霉烯类80例,喹诺酮类27例,四环素类12例。AAD组中,使用酶抑制剂合剂的患者21例,明显较对照组增多,差异有统计学意义(P<0.05)(见表2)。

表2 两组患者抗生素使用情况 Tab 2 Use of antibiotics in two groups
2.3 预后所有患者中,8周内病情好转130例,病情恶化20例,死亡8例。其中AAD患者中36例好转,8例病情恶化,5例死亡。死亡原因主要考虑原发性疾病加重所致。住院时间>30 d的患者共87例,其中AAD患者39例。AAD组高龄老年患者的好转比例低于对照组,而死亡比例和住院时间均显著高于非AAD组,表明AAD组的高龄老年患者住院时间更长,病情转归更差(见表3)。

表3 两组患者的预后情况 Tab 3 Prognosis of the two groups
2.4 AAD相关因素的回归分析以AAD为因变量,纳入年龄以及AAD与非AAD组间差异有显著统计学意义的因素,如aCCI、GNRI、长期卧床、连续使用抗生素超过3周、使用酶抑制剂合剂等,采用二元Logistic回归分析模型(见表4)。结果表明,aCCI高得分和使用酶抑制剂合剂是高龄老年住院患者发生AAD的独立高危因素。

表4 老年AAD患者相关因素回归分析 Tab 4 Regression analysis of AAD related factors in the elderly patients
3 讨论
AAD是老年住院患者最常见的肠道感染之一。考虑到AAD的发病率和重症率随着年龄的增长有增加的趋势,本研究中,选择接受抗生素治疗的高龄老年住院患者,AAD的发病率为31.0%,与之前文献报道的老年患者AAD发病率相似[9]。本研究中发现,GNRI、aCCI、长期卧床、使用酶抑制剂合剂与抗生素连续使用时间较长与高龄老年患者AAD发生有关。其中,aCCI和使用酶抑制剂合剂是高龄老年住院患者发生AAD的独立高危因素。aCCI得分越高,AAD的发生风险就越高。
CCI是目前常用的共病评估指标之一。此前一项包含大样本研究[10]证实了年龄调整CCI(aCCI)在预测死亡及不良事件中的作用。本文用aCCI能更客观地提示高龄老年患者的共病情况,根据多元回归分析表明,aCCI高得分是老年AAD发病的易感因素。之前也有报道提示CCI与严重AAD有关,如CDAD。共病与CDAD的发生几率和病程之间有着确定的联系[11-12]。但在老年人中的研究报道较少,本研究首次报道了aCCI与老年AAD的相关性。
关于营养与AAD相关性,曾有报道提示[13]低蛋白血症是AAD的危险因素。本研究用GNRI评估老年患者营养情况,避免传统营养指标中基础疾病的影响因素,更能反映出客观的营养指标对AAD的影响。
本研究发现长期卧床与高龄老年AAD患者密切相关,首先,长期卧床患者中长期住院的比例较高,曾有Meta分析结果显示,患者住院天数较长是发生AAD的危险因素[14]。其次,长期卧床导致自理能力下降,ADL量表是老年日常活动能力的综合评估,其与肠道菌群可能存在一定的相关性[15],而肠道菌群与AAD密切相关,故长期卧床的患者可能由于肠道菌群的改变而影响了AAD的发生。
对AAD的研究已经证明几乎所有的抗生素均会导致AAD。我们的分析显示,使用酶抑制剂合剂增加了高龄老年患者发生AAD的风险,与之前的研究相符[16]。之前还有研究提示,哌拉西林他唑巴坦对胃肠道微生物群失调有影响,从侧面也显示出其与AAD之间可能存在相关性[17]。在老年住院患者中,联合使用和长期使用抗生素较多,研究表明,长期使用抗生素容易导致AAD[18],我们的研究对于3周以上的连续使用抗生素显示出这种趋势。
同时,本研究显示,未发现使用益生菌对高龄老年患者AAD有保护作用。目前针对AAD及CDAD的标准治疗中,益生菌疗效仍存在争议[19-20],关于哪些益生菌菌株可以预防尚未达成共识,未来仍需进一步研究明确。
另外,本研究也提示老年AAD患者的总体病情的严重程度较重,住院时间较长,增加了医疗费用和医疗人力的负担[21],因此,有必要对老年患者进行使用抗生素治疗的风险评估,提前干预,减少经济和社会负担。
通过本研究提示,对于高龄老年住院患者来说,其自身营养水平因素、基础疾病以及是否长期卧床对早期识别高危AAD非常重要,尽量避免长时间使用抗生素以及酶抑制剂合剂,尽早干预,方可降低防AAD的发生率。

