CCL7通过ERK/JNK通路影响肝癌细胞的侵袭和迁移
陈对对,杨 强 ,叶 子,陈祖兵,沈世强
武汉大学人民医院肝胆外科,湖北 武汉 430060
原发性肝癌(primary liver cancer,PLC)是我国第四位常见肿瘤和第三大致死肿瘤类型[1],其中肝细胞癌(hepatocellular carcinoma,HCC)占PLC的75%~85%,尽管肝癌的靶向治疗、免疫治疗不断取得突破,且治疗方法在向个体化、系统化、综合化发展[2],但肝癌易侵袭和转移的特性是导致患者预后不良的主要原因之一。趋化因子[3](Chemokine)作为一种小分子蛋白,与炎症反应、白细胞运输、肿瘤转移及血管生成等密切相关。趋化因子7[chemokine (C-C motif) ligand 7,CCL7],也叫单核细胞趋化蛋白3(monocyte chemotactic protein 3,MCP-3),是趋化因子家族中的一员,与肿瘤的侵袭和转移相关[4]。目前CCL7在肝癌中的作用及机制鲜有相关报道。本研究探讨CCL7与肝癌细胞侵袭和迁移能力的关系,为肝癌的治疗进一步提供实验依据。
1 材料与方法
1.1 材料人正常肝细胞株L02和人肝癌细胞株SMMC-7721、HepG2均购自中国科学院细胞库; RPMI-1640培养基购自美国Hyclone公司(SH30809);DMEM高糖培养基购自美国Hyclone公司(SH30022);胎牛血清购自杭州四季青生物工程材料有限公司(141215);胰酶Trypsin购自吉诺生物医药技术有限公司(GNM25200);重组人CCL7购自Peprotech公司(300-17);CCL7 siRNA购自锐博公司(p201909090011);Rutin hydrate购自美国MCE公司(HY-N0148A);E-cadherin抗体(#14472)、Snail抗体(#3879)、JNK抗体(#9252)、p-JNK抗体(#4668)、ERK抗体(#4695)、p-ERK抗体(#4376)均购自CST公司;Vimentin抗体(ab92547)、Twist抗体(ab50887)均购自英国Abcam公司;HRP-Goat anti Rabbit二抗购自ASPEN公司(AS1107);人CCL7酶联免疫吸附检测(ELISA)试剂盒购自ELK Biotechnology公司(ELK1167);CCK-8检测试剂盒购自碧云天生物技术有限公司(C0038);EnTurboTMSYBR Green PCR SuperMix试剂盒购自美国ELK Biotechnology公司(EQ001)。
1.2 细胞培养HepG2细胞用89% DMEM高糖培养基+质量浓度为100 g/L胎牛血清+1%双抗培养,L02细胞和SMMC-7721细胞用RPMI-1640培养基+质量浓度100 g/L胎牛血清+1%双抗培养。所有细胞用25 cm2透气盖培养瓶培养,放置于含体积分数为5%的CO2的37 ℃培养箱中。细胞贴壁繁殖生长达瓶底面积85%左右时用胰蛋白酶进行消化传代。
1.3 细胞转染取1×105个/ml的SMMC-7721细胞接种在24孔板上,培养24 h后将原有培养基弃去,加入2 ml含血清的RPMI-1640细胞培养基。置于体积分数为5%的CO2培养箱中于37 ℃培养至细胞汇合为30%~50%。用30 μl Opti-MEM无血清培养稀释1.25 μl 20 μmol/L siRNA存储液,轻轻混匀。加入3 μl riboFECTTMCPReagent,轻轻吹打混匀,室温孵育15 min,制备成转染复合物。将riboFECTTMCPReagent转染复合物加入到适量无双抗完全培养基中,轻轻混匀。将培养板置于37 ℃的体积分数为5%的CO2培养箱中培养48 h。通过qRT-PCR和Western blotting方法观察或检测转染基因的表达情况。
1.4 ELISA检测分别收集L02、HepG2、SMMC-7721、si-NC、si-CCL7细胞,4 ℃,2 000 r/min,10 min离心,弃去不溶物,取上清。确定用于稀释标准液、空白液和样品的孔。准备7个标准孔,1个空白孔。取100 μl标准品、空白品和样品的稀释液分别添加到适当的孔中。平板封口机盖住孔。在37 ℃下孵育2 h。清除每个孔中的液体。吸出溶液,并用250 μl洗涤溶液清洗每个孔,静置1~2 min。将板卡在吸水纸上,完全清除所有孔中的残留液体。完全清洗3次。最后一次清洗后,抽吸或倾析除去所有剩余的洗涤缓冲液。翻转板并将其吸在吸水纸上。向每个孔添加100 μl生物素化抗体工作溶液,用平板密封剂盖住孔,并在37 ℃下孵育1 h。向每个孔中加入100 μl链霉亲和素-HRP工作溶液,用平板密封剂盖住孔,并在37 ℃下孵育1 h。重复吸取/冲洗过程,共5次。向每个孔中添加90 μl TMB底物溶液。盖上新的平板。在37 ℃下避光孵育15 min。加入TMB底物,液体将变成蓝色。向每个孔中分别添加50 μl终止试剂。液体将变成黄色。敲击板的侧面混合液体。Stop试剂的插入顺序应与TMB底物溶液的插入顺序相同。除去平板底部的水滴和指纹,并确认液体表面无气泡。最后,使用酶标仪并立即在450 nm下进行测量。上述操作按照Human MCP3 ELISA Kit试剂盒进行。
1.5 CCK-8检测细胞增殖将对数生长期SMMC-7721细胞用胰蛋白酶消化,配制成细胞悬液,按1×104个/孔接种于96孔板,置于体积分数为5%的CO2培养箱中37 ℃下培养24 h以贴壁。后分别更换为100 μl细胞样品含100 ng/ml、200 ng/ml CCL7浓度药物的培养基,对照组更换为含溶剂的培养基。每个浓度的样本设5个重复。所有孔中加入10 μl CCK-8溶液,培养箱中孵育1~4 h。使用酶标仪测定450 nm吸光度值(OD值),以溶剂处理的细胞为对照组,不含细胞的培养基为空白对照组,按公式计算药物对细胞的存活率。细胞存活率%=(实验组-空白对照组)/(阴性对照组-空白对照组)×100%。
1.6 Transwell小室迁移及侵袭实验迁移实验用Corning公司的8 μm孔径的Transwell小室,侵袭实验用BD公司的8 μm孔径的铺胶Transwell侵袭小室,实验前将铺胶Transwell侵袭小室水化2 h。收集转染的细胞、200 ng/ml CCL7共培养细胞,胰酶消化重悬计数,调整浓度值为1×105个/ml,Transwell小室及铺胶Transwell侵袭小室的上室加入200 μl细胞悬液,下室加入600 μl完全培养基。培养箱中培养24 h后取出,吸去上室及下室培养基,PBS轻轻清洗,4%多聚甲醛固定15 min,0.1%结晶紫染色20 min,PBS清洗3遍,棉签擦去未穿过的细胞,100倍光学显微镜下计数穿过细胞数,随机选取5个视野,取其平均值用于统计。
1.7 Western blotting将空白对照组、si-NC组、si-CCL7组、CCL7组、JNK/ERK通路抑制剂组和CCL7+JNK/ERK通路抑制剂组细胞分别种植于6孔板,待细胞贴壁,融合度为70%~90%时,用PBS缓冲液润洗贴壁细胞2~3次。加入RIPA裂解液(每孔加入150 μl),提取细胞蛋白;BCA法测定蛋白浓度,进行SDS-PAGE电泳、转膜、封闭1 h后,加入E-cadherin抗体、Snail抗体、JNK抗体、p-JNK抗体、ERK抗体、p-ERK抗体、Vimentin抗体、Twist抗体;4 ℃孵育过夜,TBST漂洗3次后,加入HRP-Goat anti Rabbit二抗 (1∶1 000),37 ℃温育30 min,用TBST在室温下摇床上洗4次,每次5 min。增强化学发光系统显色。利用投射仪图像分析系统扫描确定X线片上杂交条带的OD值,实验独立重复3次,以3次实验所得OD值的平均数表示蛋白含量。
1.8 qRT-PCRTRIzol法提取细胞总RNA,按逆转录试剂盒EntiLinkTM1st Strand cDNA Synthesis Kit试剂盒合成cDNA,在Life technologies公司的StepOneTMqRT-PCR仪上完成,每个样品均作3个复孔,使用EnTurboTMSYBR Green PCR SuperMix试剂盒进行(ELK Biotechnology,EQ001)。

表1 引物序列Tab 1 Primer sequence

2 结果
2.1 CCL7在肝癌细胞中高表达通过ELISA分析CCL7在人正常肝细胞系L02、肝癌细胞系SMMC-7721、HepG2中的表达情况,结果如图1所示,CCL7在SMMC-7721、HepG2细胞中的表达量显著高于其在正常肝细胞L02中的表达量,差异有统计学意义(P=0.003、P=0.0037)。

图1 L02、SMMC-7721和HepG2细胞中CCL7蛋白的表达情况Fig 1 The expressions of CCL7 protein in L02, SMMC-7721 and HepG2 cells
2.2 CCL7促进SMMC-7721肝癌细胞侵袭和迁移能力通过Transwell实验分析共培养CCL7对SMMC-7721的侵袭和迁移能力的影响,结果如图2A~2C所示,CCL7可显著增强SMMC-7721细胞的迁移和侵袭能力,差异有统计学意义(P<0.05)。使用不同浓度的CCL7与SMMC-7721共培养24、48、72 h,再用CCK-8实验来检测细胞增殖效果,结果如图2D所示、CCL7对SMMC-7721细胞增殖能力呈一定浓度、时间依赖性,差异有显著统计学意义(P<0.01)。
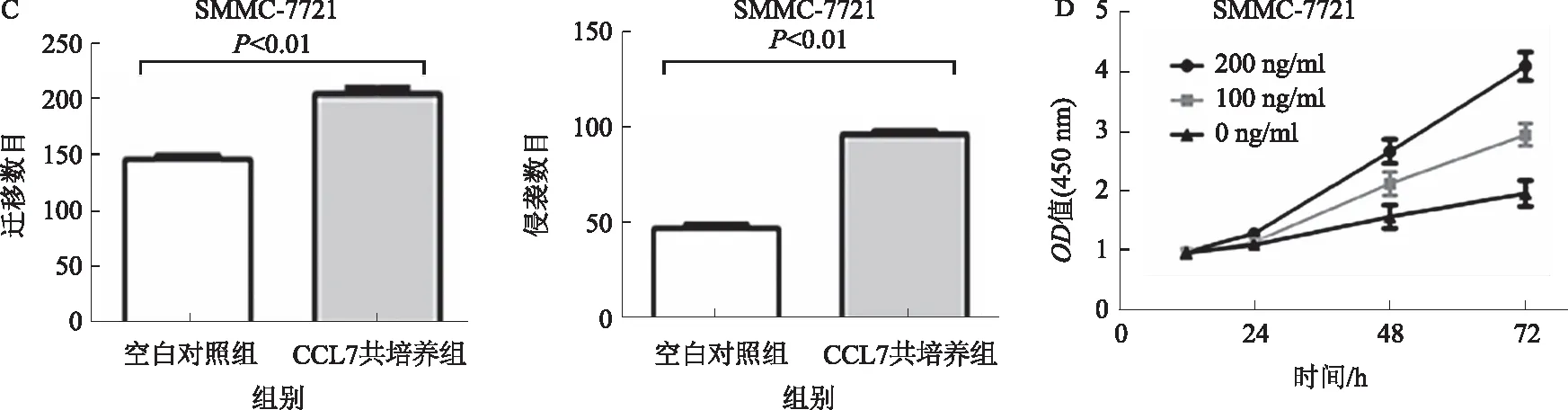
图2 SMMC-7721与CCL7共培养对其侵袭、迁移和增殖能力的影响 A:SMMC-7721细胞的迁移能力;B:SMMC-7721细胞的侵
2.3 CCL7 siRNA抑制CCL7表达后抑制肝癌细胞的侵袭和迁移能力CCL7 siRNA通过瞬时转染抑制SMMC-7721细胞中CCL7的表达,其中包括3个靶点、1个空白对照组、1个阴性对照组。使用qRT-PCR、Western blotting和ELISA方法检测CCL7 siRNA的干扰效率,确定其中能显著抑制肝癌细胞SMMC-7721中CCL7的表达水平为最佳干扰靶点(见图3A~3D)。与si-NC组相比,si-CCL7组肝癌细胞的侵袭能力和迁移能力明显受到抑制(见图3E~3F)。进一步通过相关性分析,肝癌细胞的侵袭能力与CCL7表达量呈正相关,肝癌细胞的迁移和侵袭能力也与CCL7表达量呈正相关(见图3G~3H)。





图3 siRNA转染SMMC-7721后侵袭和迁移能力的影响 A:Western blotting 检测CCL7 siRNA最佳靶点;B:A的统计学数据;C:qRT-PCR检测CCL7 siRNA最佳靶点;D:ELISA检测CCL7 siRNA最佳靶点;E:Transwell迁移实验分别检测各组SMMC-7721细胞的迁移能力和侵袭能力;F:E的数据统计;G:CCL7与SMMC-7721迁移性Pearson分析;H:CCL7与SMMC-7721侵袭性Pearson分析
2.4 CCL7促进肝癌细胞上皮-间质转化(EMT)200 ng/ml CCL7与SMMC-7721共培养72 h,通过用Western blotting实验来检测E-cadherin、Vimentin、Snail、Twist表达量。与对照组相比,CCL7共培养组E-cadherin的表达明显升高,而Vimentin、Snail、Twist的表达明显降低(见图4A~4B)。用CCL7 siRNA最佳靶点转染SMMC-7721细胞后,细胞中E-cadherin的表达量显著上升,Vimentin、Snail、Twist的表达量显著下降(P<0.01)(见图4C~4D)。


图4 CCL7对SMMC-7721 EMT相关蛋白表达的影响 A:Western blotting 检测对照组和CCL7共培养组中E-cadherin、Vimentin、Snail和Twist的表达量;B:A的统计学数据;C:Western blotting检测对照组、NC组和si-CCL7组中E-cadherin、Vimentin、Snail和Twist的表达量;D:C的统计学数据
2.5 肝癌细胞通过ERK/JNK通路调节EMTsiRNA抑制SMMC-7721细胞中CCL7的表达后,细胞中p-ERK、p-JNK的表达量显著下降(P<0.01),但ERK、JNK的表达量差异无统计学意义(P=0.674),p-ERK/ERK和p-JNK/JNK的比值显著变小(见图5A~5B)。
JNK/ERK抑制剂20 nmol/L,24 h(UO126)抑制SMMC-7721细胞中ERK/JNK信号通路后,细胞中E-cadherin的表达量显著上升,Vimentin、Snail的表达量显著下降(P<0.01)(见图5C~5D)。


图5 肝癌细胞通过JNK/ERK通路调节EMT A:Western blotting 检测对照组、NC组和si-CCL7组中p-ERK、ERK、p-JNK和JNK蛋白水平的表达量;B:A的统计学数据;C:Western blotting 检测对照组、CCL7组、JNK/ERK通路抑制剂和CCL7+JNK/ERK通路抑制剂组中p-ERK、ERK、p-JNK、JNK、E-cadherin、Vimentin和Snail蛋白水平的表达量;D:C的统计学数据
3 讨论
HCC作为常见的恶性肿瘤之一,其较高的侵袭能力和迁移能力使患者的预后较差。CCL7也叫MCP-3,是趋化因子CC亚族成员,首次发现于骨肉瘤上清液中[5]。正常情况下,CCL7由成纤维细胞、单核细胞、气道平滑肌细胞、角质形成细胞等表达。在病理情况下,肿瘤细胞也可表达。CCL7作用于多种靶细胞,如单核细胞、嗜酸性粒细胞、嗜碱性粒细胞、树突状细胞(DC)、自然杀伤细胞(NK)和活化的T淋巴细胞等,通过与上述靶细胞表面受体结合可以使靶细胞向炎症组织迁移,参与免疫应答,控制炎症反应。然而,有研究表明,病灶性牛皮癣[6]、获得性免疫缺陷综合征[7]、急性中性粒细胞性肺炎和肺纤维化的恶化[8]与CCL7的异常升高有关。目前在结肠癌[9-10]、结肠癌肝转移[11]、非小细胞肺癌[12]、肿瘤相关成纤维细胞[13]等研究中发现CCL7与肿瘤的侵袭、迁移相关。在本项研究中我们发现,与正常人肝细胞株相比,CCL7在肝癌细胞SMMC-7721中过表达,这表明CCL7可能在HCC中作为致癌基因发挥作用。
为研究SMMC-7721细胞中CCL7是否影响其侵袭、迁移能力,我们首先使用SMMC-7721细胞与200 ng/ml的CCL7共同培养24 h,通过Transwell实验我们发现,共培养组与空白对照组相比,SMMC-7721细胞的侵袭、迁移能力明显增强。之后使用siRNA抑制SMMC-7721细胞中CCL7的表达后再次检测肝癌细胞的侵袭、迁移能力,结果表明,CCL7的抑制显著降低SMMC-7721细胞的侵袭、迁移能力,相关性分析表明,SMMC-7721细胞中CCL7的表达量与肝癌细胞的侵袭、迁移能力呈正相关,证实CCL7参与并促进了肝癌细胞的侵袭和迁移过程。
EMT在多种肿瘤的侵袭、迁移中发挥重要作用。目前已经明确E-cadherin、N-cadherin、EMT转录因子(EMT-TFs)、Snail、Twist等间质蛋白在EMT中的关键作用。本研究显示,共培养组中CCL7浓度与E-cadherin的表达成反比,与Vimentin、Snail、Twist的表达成正比。用最佳CCL7 siRNA干扰靶点转染SMMC-7721细胞后再用Western boltting检测细胞中E-cadherin、Vimentin、Snail、Twist表达量,结果显示,用CCL7 siRNA最佳靶点转染SMMC-7721细胞后,细胞中E-cadherin的表达量显著上升,Vimentin、Snail、Twist的表达量显著下降。说明CCL7有可能通过调节EMT来参与肝癌细胞的侵袭和迁移。
趋化因子与其受体结合可以影响肿瘤细胞的血管生成[14]、肿瘤生成、EMT[15-16]。趋化因子及其受体结合将激活各种细胞生物学过程(包括细胞增殖、分化和迁移)的丝裂原活化蛋白激酶(MAPK)信号传导途径[17-19]。其中参与肿瘤发生、发展主要为3种:细胞外信号相关激酶(ERK-1/2)、JUN氨基末端激酶(JNK1/2/3)和p38蛋白。近期有研究发现,CCL7可以激活MAPK下游通路[20],但关于CCL7-MAPK介导的EMT仍不清楚。Western blotting实验显示,siRNA抑制SMMC-7721细胞中CCL7的表达后,细胞中p-ERK、p-JNK的表达量显著下降,但ERK、JNK的表达量未见变化,p-ERK/ERK和p-JNK/JNK的比值显著变小。结果说明,CCL7在肝癌细胞中可能通过促进ERK/JNK活化来增强ERK/JNK信号通路的作用,而抑制CCL7的表达可以减少ERK/JNK的磷酸化水平。
为了进一步研究CCL7诱导的肝癌细胞侵袭和迁移中ERK/JNK信号通路是否与EMT之间存在关系,我们用特异性ERK/JNK抑制剂UO126抑制SMMC-7721细胞中ERK/JNK信号通路,结果使用UO126抑制SMMC-7721细胞中ERK/JNK信号通路后,细胞中E-cadherin的表达量显著上升,Vimentin、Snail的表达量显著下降。此结果与用CCL7 siRNA转染SMMC-7721细胞后的结果相一致。
综上所述,我们发现CCL7在SMMC-7721细胞中高表达,且与其侵袭和迁移能力呈正相关。共培养的CCL7可以促进SMMC-7721细胞的侵袭和迁移,而siRNA抑制SMMC-7721细胞中的CCL7可以抑制其侵袭和迁移。进一步研究发现CCL7可能通过诱导ERK/JNK的磷酸化激活ERK/JNK信号通路来影响EMT,从而促进SMMC-7721细胞的侵袭和转移。

