不同化疗方案在乳腺癌术后的应用效果对比
付祖德
乳腺癌是妇科常见恶性肿瘤。乳腺癌的发病机制目前尚不明确,发病因素主要包括乳腺癌家族史、生育经历及既往乳腺良性疾病未治愈等[1,2]。乳腺癌的发病率处于较高水平,其病死率也很高,仅次于肺癌,严重威胁女性的身体健康[3]。对于中早期的乳腺癌患者手术切除肿瘤是其有效的治疗方式,但是术后存在一定的复发几率。近年来,随着对乳腺癌生物学行为认识的不断深入,乳腺癌从手术治疗模式逐渐防治成为全身综合干预模式[4]。手术切除后予以辅助化疗能降低残留病灶的复发和转移几率,有助于延长患者的术后生存时间[5]。随着乳腺癌患者数量的不断增多,术后化疗的需求也逐渐上升,但目前关于乳腺癌患者术后化疗的方案较多,尚未形成标准的方案[6,7]。本次研究选取2013 年12 月~2016 年12 月本院94 例行手术治疗的乳腺癌患者作为研究对象,通过对比不同化疗方案在乳腺癌患者术后的应用效果,以期为乳腺癌的术后化疗方案选择提供参考。现报告如下。
1 资料与方法
1.1 一般资料 选取2013 年12 月~2016 年12 月本院94 例行手术治疗的乳腺癌患者作为研究对象,年龄26~77 岁,平均年龄(49.7±9.6)岁;肿瘤组织学类型:乳腺浸润性导管癌63 例,浸润性小叶癌17 例,髓样癌14 例;乳腺癌分期:Ⅰ期 27 例,Ⅱ期 48 例,Ⅲ期19 例。采用随机数字表法将患者分为试验组和对照组,每组47 例。对照组患者年龄26~75 岁,平均年龄(49.5±8.9)岁;肿瘤组织学类型:乳腺浸润性导管癌30 例,浸润性小叶癌9 例,髓样癌8 例;乳腺癌分期:Ⅰ期14例,Ⅱ期23例,Ⅲ期10例。试验组患者年龄27~77岁,平均年龄(49.9±9.4)岁;肿瘤组织学类型:乳腺浸润性导管癌33 例,浸润性小叶癌8 例,髓样癌6 例;乳腺癌分期:Ⅰ期13 例,Ⅱ期25 例,Ⅲ期9 例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:①经手术病理学检查确诊为乳腺癌,且无远处转移;②年龄18~80 岁;③卡氏评分≥70 分;④自愿参与本次研究。排除标准:①合并其他恶性肿瘤者;②存在心肝肾等脏器严重疾病者;③临床资料不完整;④哺乳或妊娠期患者。
1.2 方法 对照组患者采用TAC 方案(多西他赛 +阿霉素+环磷酰胺)进行术后化疗:d1:多西他赛(浙江海正药业股份有限公司,国药准字H20093092)50~75 mg/m2,缓慢静脉滴注;阿霉素50~60 mg/m2,静脉注射;环磷酰胺(Baxter Oncology GmbH,国药准字H20160467)500~600 mg/m2,加生理盐水20~30 ml 静脉注射。试验组患者采用AC-T 方案(阿霉素+环磷酰胺-多西他赛)进行术后化疗:d1:阿霉素,剂量50~60 mg/m2,静脉注射;环磷酰胺500~600 mg/m2,加生理盐水20~30 ml 静脉注射;连续治疗4 个周期后改为多西他赛(浙江海正药业股份有限公司,国药准字H20093092)继续治疗4 个周期,剂量90~100 mg/m2,缓慢静脉滴注。两组患者均以治疗3 周为1 个周期,连续治疗8 个周期。治疗过程中密切观察患者症状、体征的变化,根据情况给予5-羟色胺拮抗剂类止吐剂减轻化疗的胃肠道反应,并进行保肝治疗。
1.3 观察指标及判定标准 ①随访统计两组患者治疗2 年内的无病生存率和总生存率情况,经此评定临床治疗效果。②按世界卫生组织抗癌药物不良反应评定标准评定两组患者术后化疗期间的不良反应情况,不良反应主要包括血液系统毒性、心脏方面毒性、消化系统毒性、皮肤黏膜毒性、肝毒性及神经系统毒性情况。
1.4 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差 ()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者治疗2 年内的无病生存率和总生存率比较 试验组患者2 年内无病生存率和总生存率分别为76.60%、89.36%,与对照组的80.85%、91.49%,比较差异无统计学意义(P>0.05)。见表1。
2.2 两组患者不良反应发生情况比较 试验组患者血液系统毒性和心脏方面毒性发生率分别为23.40%、29.79%,均低于对照组的51.06%、59.57%,差异有统计学意义(P<0.05);两组消化系统毒性、肝毒性、皮肤黏膜毒性、神经系统毒性发生率比较,差异无统计学意义(P>0.05)。见表2。

表1 两组患者治疗2 年内的无病生存率和总生存率比较[n(%)]
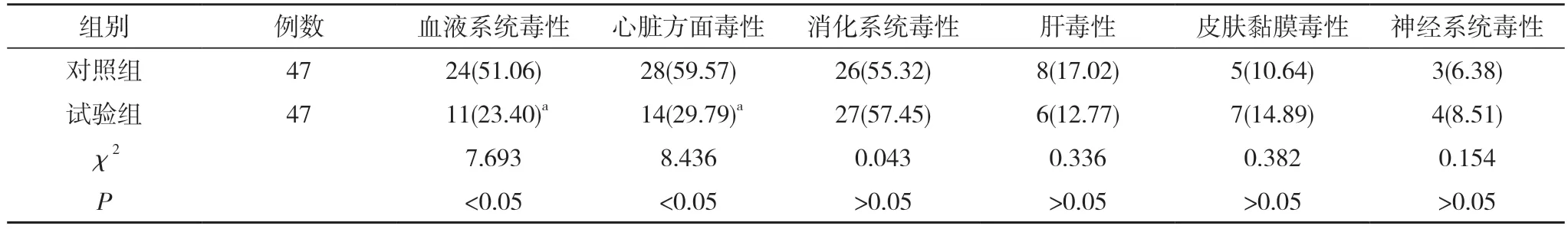
表2 两组患者不良反应发生情况比较[n(%)]
3 讨论
乳腺癌是女性常见的恶性肿瘤之一,随着现代医疗诊疗水平的不断提升,乳腺癌的临床检出率也随之上升,而病死率也有所下降,但仍需要早诊断早治疗[8]。手术治疗乳腺癌目前已日趋成熟,但是由于乳腺癌具有易复发和多途径转移的特点,且中晚期乳腺癌患者常伴有区域淋巴结转移及远处播散,因此术后需要采用放化疗等方法进行辅助治疗,以保障治疗效果[9]。术后辅助化疗能缩小残留病灶,防止癌细胞复发、转移,帮助患者延长生存周期。但目前乳腺癌术后化疗的方案种类较多,其中以表阿霉素、阿霉素为代表的蒽环类药物是乳腺癌化疗的常用药物,其能通过抑制癌细胞聚合酶阻滞核酸的合成从而发挥抗癌的效果,是杀死乳腺癌细胞的主要药物之一[10]。多西他赛等紫杉醇类药物也是乳腺癌化疗的重要药物。紫杉醇类抗肿瘤药主要通过干扰细胞有丝分裂和分裂间期细胞功能所必需的微管网络,加强微管蛋白的聚合抑制其解聚,抑制肿瘤有丝分裂从而发挥抗肿瘤的功效。多西他赛属于半合成的紫杉类药物,其抗肿瘤作用要强于紫杉醇[11]。TAC 方案是含蒽环类和紫杉醇类两种主力抗肿瘤药物的化疗方案,其中含有环磷酰胺属于双功能烷化剂,能干扰癌细胞核酸的功能,抑制癌细胞增殖。有研究[12]发现,TAC 方案对于降低乳腺癌患者术后复发率和病死率方面的效果要优于不含蒽环类药物的CMF 方案,但TAC 方案中蒽环类药物对于心脏的毒性较高,紫杉醇类药物则对于血液系统的毒性较大,尤其是中性粒细胞下降显著。而AC-T方案则是以蒽环类药物为基础,后期再替换为紫杉醇类药物的序贯化疗方案,其选用的药物与TAC 方案基本一致。有学者[13]认为AC-T序贯化疗方案有助于提升化疗效果。本次研究结果显示,试验组患者2 年内无病生存率和总生存率分别为76.60%、89.36%,对照组患者2 年内无病生存率和总生存率分别为80.85%、91.49%,比较差异无统计学意义(P>0.05)。由此说明相比TAC 方案,AC-T 方案对于患者生存的改善作用并没有得到显著提升,这与国内张新军等[14]的报道一致。但本次研究仅进行了随访2 年,未进行长期随访,且纳入患者例数有限,因此目前关于AC-T 方案的疗效还需要进一步探讨。本次研究结果显示,试验组患者血液系统毒性和心脏方面毒性发生率分别为23.40%、29.79%,均低于对照组的51.06%、59.57%,差异有统计学意义(P<0.05);两组消化系统毒性、肝毒性、皮肤黏膜毒性、神经系统毒性发生率比较,差异无统计学意义(P>0.05)。由此验证了吴妍妍等[15]的结论,这可能是由于紫杉醇类和蒽环类药物的血液系统毒性、心脏方面毒性均存在剂量依赖性,AC-T 序贯治疗方案相较TAC 方案,两种药物的总使用剂量都有所下降,因此血液系统毒性和心脏方面毒性有所减弱,患者的耐受性更好。
综上所述,乳腺癌患者术后应用AC-T 方案治疗中期疗效与AC-T 方案相似,但是相比血液系统毒性和心脏方面毒性较低,安全性较高。

