术前淋巴细胞/单核细胞比值与子宫内膜癌FIGO分期的关系研究
陈丽艳 于达 张谦 姜继勇
子宫内膜癌是一种较为常见的女性生殖系统肿瘤,是发生于子宫内膜的上皮性恶性肿瘤,一般多发于围绝经期与绝经后的女性。现阶段,随着社会经济的快速发展,人们的经济条件得到了极大的改善,但随之而来的是,子宫内膜癌的发病率也在逐年上升[1]。世界每年有接近 20 万的新发病例,成为继卵巢癌和宫颈癌之后导致死亡的第三位常见妇科恶性肿瘤[2]。这是由于子宫内膜癌随着病情的进展癌细胞极易发生转移,尤其是发生盆腔淋巴结转移。而一旦发生癌细胞转移,将会极大的降低患者的生存几率。目前对于子宫内膜癌发病的原因尚未完全清楚,一项良好、有效的检验方式在子宫内膜癌的患者中意义非常重大,其可以及时反映患者的病情恢复情况。其中,术前外周血淋巴细胞/单核细胞比值(lymphocyte-to-monocyte ratio,LMR)被认为是结直肠癌、胃癌和肺癌等多种实体肿瘤有效的预后预测因子[3]。因此,本研究通过探究术前外周血LMR 与子宫内膜癌FIGO 分期的相关性,旨在分析术前外周血LMR 对子宫内膜癌手术患者预后的预测价值,以期为指导患者术后个体化治疗提供临床依据。
1 资料与方法
1.1 一般资料 将本院在2010 年1 月~ 2015 年12 月收治的100 例罹患子宫内膜癌的患者作为研究对象,根据子宫内膜癌FIGO 分期不同将患者分为早期子宫内膜癌组(FIGOⅠ~Ⅱ期,35 例)及晚期子宫内膜癌组(FIGO Ⅲ~Ⅳ期,65 例)。早期子宫内膜癌组患者中,年龄40~75 岁,平均年龄(54.6±6.9)岁;病理分级:G1 13 例、G2 19 例、G3 3 例;有淋巴转移11 例、无淋巴转移24 例。晚期子宫内膜癌组患者中,年龄40~73 岁,平均年龄(53.8±6.6) 岁;病理分级:G1 21 例、G2 34 例、G3 10 例;有淋巴转移26 例,无淋巴转移39 例。两组患者的一般资料对比,差异无统计学意义(P>0.05),具有可比性。
1.2 方法 收集患者的临床资料、组织学类型及血液参数等临床变量,分析子宫内膜癌FIGO 分期的影响因素,绘制LMR 预测子宫内膜癌FIGO 分期的ROC 曲线,确定LMR 预测子宫内膜癌FIGO 分期的最佳临界值。LMR 的计算方式为淋巴细胞绝对计数值/单核细胞绝对计数值。病理组织学类型以术后酶免疫组织化学技术检验结果为准。
1.3 统计学方法 采用SPSS21.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验;采用Cox 回归模型分析影响子宫内膜癌 FIGO 分期的独立因素;LMR 预测子宫内膜癌FIGO 分期通过绘制Kaplan-Meier生存曲线表示。P<0.05表示差异具有统计学意义。
2 结果
2.1 影响子宫内膜癌FIGO 分期的单因素分析 两组患者的组织学类型、恶性腹水、血清CA125、LMR 比较,差异均有统计学意义(P<0.05);两组患者的年龄比较,差异无统计学意义(P>0.05)。见表1,表2。
表1 影响子宫内膜癌FIGO 分期的单因素分析(n,)
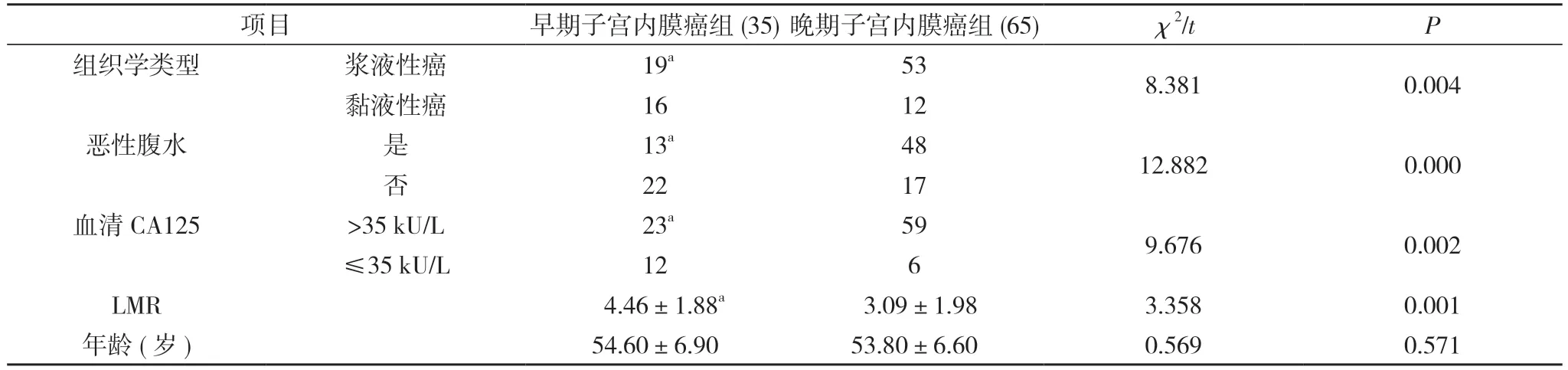
表1 影响子宫内膜癌FIGO 分期的单因素分析(n,)
注:与晚期子宫内膜癌组比较,aP<0.05
2.2 影响子宫内膜癌FIGO 分期的多因素分析 Cox回归模型多因素分析显示,LMR、血清CA125、组织学类型、恶性腹水是影响子宫内膜癌FIGO 分期的危险因素。见表3。
2.3 LMR 预测子宫内膜癌FIGO 分期的ROC 曲线分析 子宫内膜癌FIGO 分期采用LMR 预测的最佳临界值为3.63,其中49 例子宫内膜癌患者的LMR>3.63,51 例子宫内膜癌患者的LMR≤3.63。ROC 曲线下面积为0.761,灵敏度为73.73%,特异度为77.08%。见图1。

表3 影响子宫内膜癌FIGO 分期的Cox 回归模型多因素分析
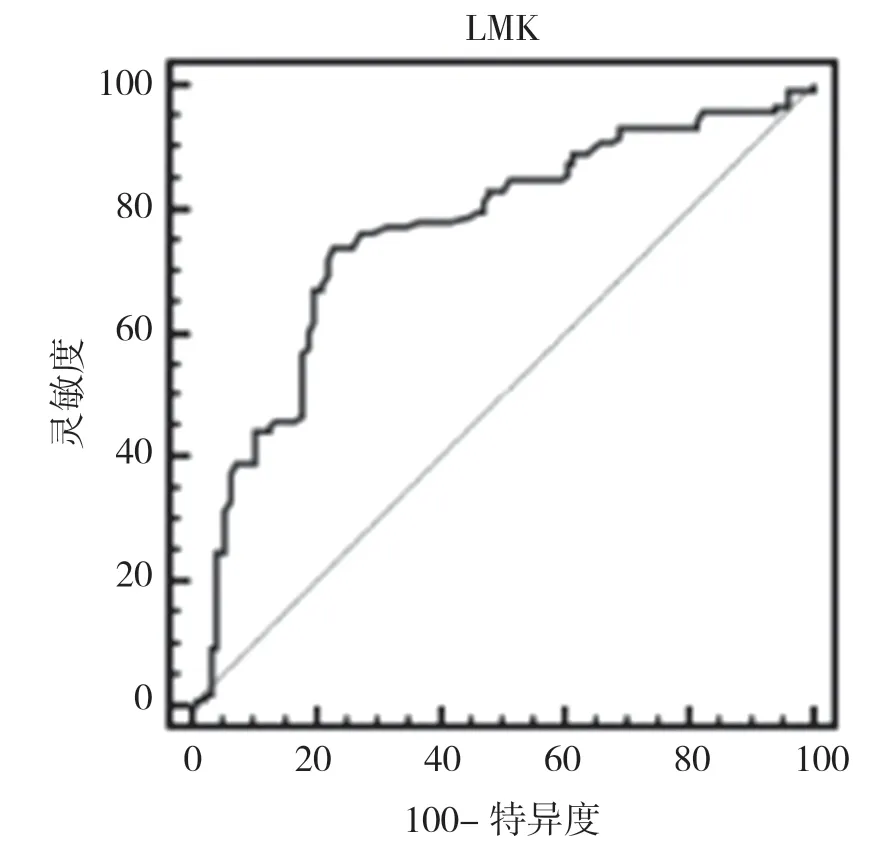
图1 LMR 预测子宫内膜癌FIGO 分期的ROC 曲线
3 讨论
有研究表明,子宫内膜癌患者的病灶如果只限于子宫体内,那么患者生存率在5 年以上的几率>95%,病灶如果发生转移,累及盆腔或更远处扩散,那么患者生存率在5 年以上的几率将会大大降低[4]。由此可以得出,子宫内膜癌患者发生癌细胞转移将会极大的降低患者的生存率、缩短生存时间。现阶段,我国针对子宫内膜癌患者的治疗手段主要是早期进行手术治疗,按照病例分期以及高危因素选择最合适的辅助治疗方式,晚期患者主要以综合治疗为主,根据患者的实际情况选择治疗方案。淋巴细胞是构成抗肿瘤细胞免疫的重要成分,其通过浸润至肿瘤微环境中发挥抗肿瘤作用。外周循环淋巴细胞的缺乏导致CD4+辅助性淋巴细胞下降和CD8+抑制性细胞上升,反映机体脆弱的免疫状态,提示抗肿瘤能力下降[5-7]。另一方面,单核细胞扮演着促肿瘤进展的角色。研究表明,外周循环过多的单核细胞会在肿瘤间质中聚集、分化成肿瘤相关的巨噬细胞(tumor-associated macrophage,TAM)。TAM不仅能够促进肿瘤的侵袭转移,而且能够降低抗肿瘤免疫细胞的攻击能力。因此,外周循环单核细胞的上升反映机体较高的肿瘤负荷以及免疫抑制状态,已被证实与多种实体肿瘤的预后不良相关[8]。外周血循环淋巴细胞的下降和单核细胞的相对上升,既改造肿瘤的免疫微环境,促进肿瘤诱导的炎性反应,又打破肿瘤细胞免疫的平衡,从而有利于肿瘤细胞侵袭转移。作为一种简单易行的炎性反应指标,术前LMR 水平能够让肿瘤科医师初步了解子宫内膜癌患者的预后情况,有利于开展术后个体化治疗[9]。基于此,在临床治疗中予以这些危险因素充分的重视,能够根据子宫内膜癌患者的临床病理特征有效评估患者发生盆腔淋巴结转移的危险程度,预测子宫内膜癌患者盆腔淋巴结转移风险,并对此采取具有针对性的治疗措施,能够帮助患者获得更好的预后,对延长患者的生命具有非常重要的意义[10]。术前LMR 检测方便且价格便宜,与子宫内膜癌FIGO 分期有关,3.63 是LMR 预测子宫内膜癌FIGO 早、晚分期的最佳临界值。
综上所述,术前外周血LMR 水平可以有效预测子宫内膜癌FIGO 早、晚分期。因检测方便廉价,计算简单易行,可作为肿瘤预后判断的补充性指标。但本研究是单中心的回顾性研究,样本量有限且随访时间较短,研究结果有待多中心随机对照试验验证。

