Wnt/β-catenin信号通路抑制剂在肝细胞癌中的研究
裴志燕,张岭漪
兰州大学第二临床医学院肝病科,甘肃 兰州 730000
肝癌是全球第六大常见癌症,也是仅次于肺癌、结直肠癌、胃癌的第四大癌症致死原因[1]。肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的75%~85%[2],其中72%发生在亚洲,中国占50%以上[1]。HCC的发生与慢性肝病密切相关,由于危险因素的流行程度不同,HCC在全球范围内的发病率是不均匀的,非洲和东亚地区为高发地区,这些地区的患者多有乙型肝炎病毒(HBV)和黄曲霉毒素B(Aflatoxin B)暴露史[1]。
近年来,HCC发病率的不断上升促使人类对其细胞、遗传和分子机制进行深入研究,以期开发出更有效的治疗方法。最近的基因组学研究准确地描述了HCC发生、发展的基因变化情况,并确定了最常见分子生物学通路,其中Wnt/β-catenin信号通路的异常激活促进了HCC的发生、发展[3-5];且该通路的激活可导致上皮-间充质转化(epithelial-mesenchymal transition, EMT)的发生,增强HCC的侵袭能力[6]。约95%的HCC存在Wnt/β-catenin信号通路的失调,并呈现β-catenin核聚集现象[7]。已证实Wnt/β-catenin信号通路中关键基因的突变在HCC的发生、发展中起着重要作用[8]。在HCC中,编码β-catenin蛋白的CTNNB1基因突变率为15%~37%[9],Axin1和Axin2失活突变率分别为10.4%和3.3%,结肠腺瘤性息肉蛋白(adenomatous polyposis coli,APC)突变率约为1.4%[10]。此外,最新研究显示,β-catenin核聚集现象仅限于晚期HCC,在早期阶段,β-catenin主要位于多个钙黏连蛋白家族蛋白成员的质膜上,通过增强生长因子受体(EGFR)的信号传导促进肿瘤细胞的存活[11]。这充分揭示了β-catenin在HCC早期已经发挥促癌功能,并强调了β-catenin在HCC进展过程中具有复杂的作用。
1 Wnt/β-catenin信号通路
Wnt/β-catenin信号通路是高度保守且在生物学功能的调节过程中发挥着不可或缺的作用[5,12]。经典Wnt信号通路(β-catenin-dependent)传导的关键是细胞质和细胞核中β-catenin的水平。Wnt配体在内质网(ER)中通过酰基转移酶(Wnt acyl-transferase porcupine,PORCN)的棕榈酰化修饰后释放,在细胞膜上通过自分泌或旁分泌的方式发出信号[10]。在通路激活状态下,Wnt配体与跨膜卷曲受体(Frizzled,FZD)和低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein-5/6,LRP5/6)在细胞膜上结合,促进由Axin-GSK3-CK1α-APC构成的破坏复合物(destruction complex)的降解,使β-catenin不能被磷酸化-泛素-蛋白酶体途径降解[7]。非磷酸化的β-catenin在胞质中逐渐积累并入核,与T细胞因子/淋巴增强因子(TCF/LEF)形成转录复合物,并招募共激活因子(BCL9、CBP/P300)启动下游靶基因(c-Myc、cyclin D1、survivin)的表达[13](见图1A)。相反,在Wnt配体缺失时,破坏复合物对β-catenin进行磷酸化修饰,经泛素-蛋白酶体途径对其进行降解,抑制下游信号通路的传导[14](见图1B)。此外,不依赖β-catenin的信号通路(β-catenin-independent)也可启动下游信号,主要包括平面细胞极性信号通路(the planar cell polarity signaling pathway)、钙依赖性信号通路(calcium-dependent signaling pathway)和GTP酶依赖性信号通路(small-GTPase-dependent signaling pathway)[15]。

图1 Wnt/β-catenin信号通路
2 Wnt/β-catenin信号通路的调节
Wnt/β-catenin信号通路在干细胞中处于激活状态,而在正常组织中处于抑制状态,主要是通过Wnt配体和β-catenin破坏复合物的平衡调节[16]。SFRP(secreted frizzled-related protein,SFRP)、Dikkopfs(DKKs)和Wnt抑制因子(WIF),以及与LRP6结合的Kallistatin通过抑制配体受体的结合,对Wnt/β-catenin信号通路具有负调节作用[17-18]。此外,胞质中的β-catenin受到破坏复合物的严格调控,破坏复合物主要由Axin-GSK3-CK1α-APC构成,其中Axin和APC主要起稳定破坏复合物的作用,促进β-catenin的磷酸化及蛋白酶体降解,起到抑制信号通路的作用[16,19]。
3 Wnt/β-catenin信号通路抑制剂在HCC中的应用
诸多研究证实,Wnt/β-catenin信号通路在HCC的发生、发展中具有重要的生物学功能,这极大地促进了对该通路抑制剂的深入探究。近年来,针对各种肿瘤类型研发有效的Wnt/β-catenin信号通路抑制剂取得了巨大进展,表1概括了目前对HCC有效的Wnt/β-catenin信号通路抑制剂。现分别对阻断受体与配体结合、稳定破坏复合物、干扰β-catenin转录因子三类抑制剂进行阐述。
3.1 配体/受体抑制剂
3.1.1 OMP-54F28、sFZD7和Salinomycin:FZD蛋白由7个跨膜结构域和1个胞外N端富含半胱氨酸结构域(CRD)构成,在信号传导过程中,FZD和单通道跨膜分子LRP5/6同时与Wnt配体结合,激活Wnt/β-catenin通路的下游信号[20]。OMP-54F28(Ipafricept)作为诱饵受体,可与Wnt配体结合,阻断Wnt/β-catenin信号通路的传导[21]。OMP-54F28联合索拉非尼治疗晚期HCC患者的临床试验(NCT02069145)进一步评估了其安全性及耐受性。在一项基础研究中,FZD7的胞外结构域蛋白(sFZD7)可明显减少HCC细胞系中β-catenin/TCF4的转录活动。在体外,sFZD7剂量依赖性地降低了三种HCC细胞系(HepG2、Hep40和Huh7)的存活率,但对三种供体的正常肝细胞几乎无影响[22]。此外,sFZD7与阿霉素联合使用,在体内、外研究中均显著增强了阿霉素对HCC细胞的生长抑制作用,蛋白免疫印迹实验进一步验证了下游蛋白的表达水平明显下降[23]。Salinomycin主要作为抗生素应用于临床,研究证明其不仅可以下调HCC中具有干细胞特性的CD133+细胞亚群的比例,还可降低晚期HCC患者对5-氟尿嘧啶(5-FU)的耐药性,增强5-FU的抗瘤效果[24-25]。
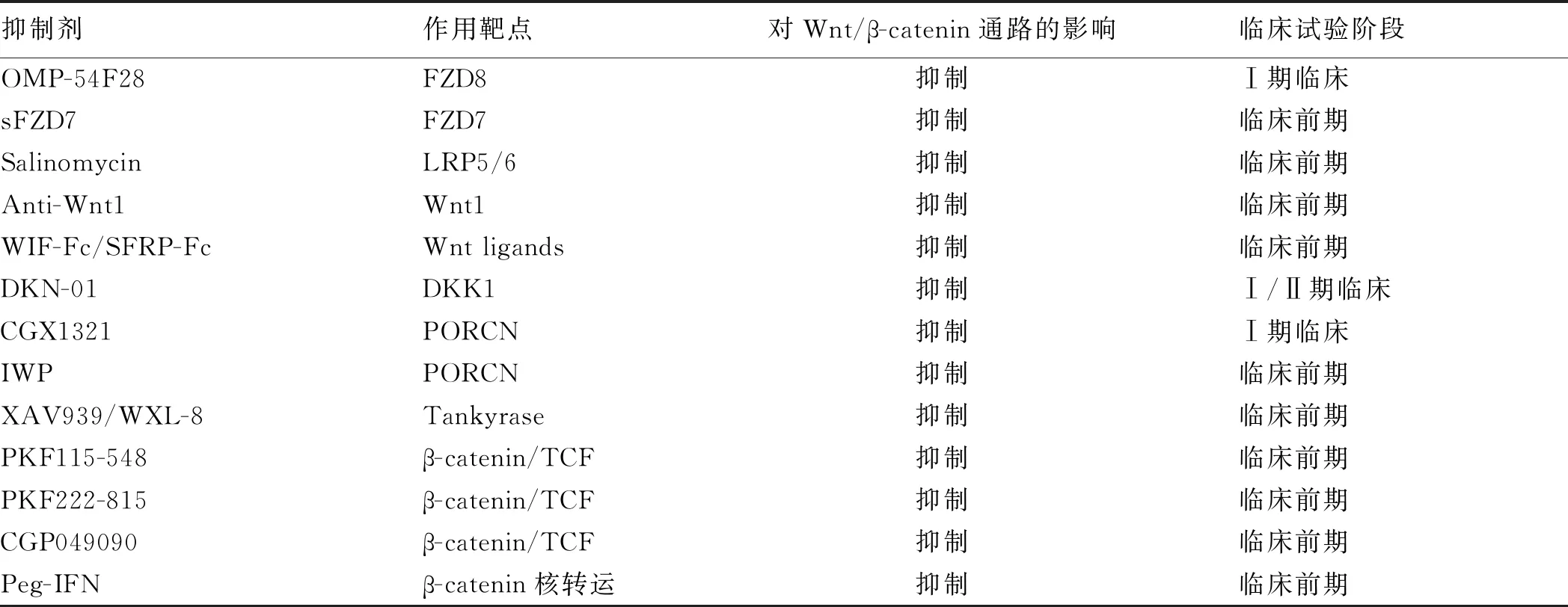
表1 HCC中具有抗瘤作用Wnt/β-catenin信号通路抑制剂Tab 1 Wnt/β-catenin signal pathway inhibitors which have anti-tumor effect in HCC
3.1.2 Anti-Wnt1、WIF-Fc/SFRP-Fc和IWP12:Wnt-1配体在HCC细胞系和HCC组织中的高表达,且与HCC患者的预后不良相关[26]。研究证明,anti-Wnt-1抗体降低HCC细胞(Huh7、Hep40)增殖和存活能力,但并不影响Wnt-1低表达的正常肝细胞[27]。此外,anti-Wnt-1抗体不仅可以减少β-catenin/TCF4的转录活动,而且可以抑制Huh7异种移植瘤模型中肿瘤的生长;Wnt-1是HCC细胞的生存因子,阻断Wnt-1介导的信号通路可能为治疗过表达Wnt-1的HCC亚群提供一种潜在的特异性治疗策略[26]。在另一项研究[28]中,在HCC细胞中表达融合蛋白WIF1-Fc和sFRP1-Fc,可下调E2F1、c-Myc、cyclinD1的表达,促进HCC细胞的凋亡。进一步研究证明,WIF1-Fc和sFRP1-Fc均能显著抑制人微血管内皮细胞和小鼠内皮祖细胞(endothelial progenitor cells, EPCs)的成管和迁移。研究数据表明,Wnt拮抗剂WIF1-Fc和sFRP1-Fc通过增加肿瘤细胞的凋亡和抑制肿瘤新生血管的形成,抑制Wnt/β-catenin信号通路,发挥强大的抗肿瘤活性。
3.2 β-catenin破坏复合物抑制剂(XAV-939和WXL-8)端锚聚合酶(Tankyrase,TNKS)促进Axin-GSK3-CK1α-APC复合物中Axin的降解,从而导致胞质及细胞核中β-catenin水平升高[29]。XAV-939和WXL-8可抑制TNKS活性,降低下游β-catenin水平,抑制通路的过度激活。通过RT-PCR发现HCC组织中TNKS1/2 的mRNA水平较癌旁组织明显升高,在HCC细胞系(Huh7、Hep40)中,XAV939和WXL-8明显抑制HCC细胞增殖和集落形成,降低胞质与细胞核的β-catenin水平。在HCC异种移植动物体内注射XAV939或WXL-8可明显抑制皮下异种移植瘤的生长(P<0.05)[30]。这提示TNKS是Wnt/β-catenin依赖性HCC的潜在治疗靶点。
3.3 干扰β-catenin转录复合物抑制剂
3.3.1 PKF118-310、PKF115-584和CGP049090:Wnt/β-catenin信号通路中的关键蛋白β-catenin入核后可与TCF、CBP等转录因子结合,共同启动下游靶基因的表达,促进癌细胞的增殖与迁移[13]。PKF118-310、PKF115-584和CGP049090可以选择性地干扰β-catenin和TCF4的结合。在一项基础研究[31]中,这三种化学物质在体外对三种HCC细胞系(HepG2、Hep40和Huh7)均表现出明显细胞毒性,且呈剂量依赖性;但其对正常肝细胞的毒性较HCC细胞低10倍。在HepG2和Huh7细胞中,三种化合物降低TCF4/β-catenin的结合能力和转录活性,并下调c-Myc、cyclinD1和survivin等下游靶基因的表达。此外,三种化合物可诱导HepG2和Huh7细胞凋亡和细胞G1/S期阻滞。在HepG2移植瘤模型中,所有的拮抗剂均抑制了肿瘤的生长,并与细胞凋亡和c-Myc、cyclinD1、survivin的表达降低有关。研究结果表明,PKF118-310、PKF115-584和CGP049090可特异性的干扰TCF4/β-catenin转录活性,为HCC的临床治疗提供新的选择。
3.3.2 聚乙二醇干扰素α(pegylated-interferon-α,Peg-IFN):Peg-IFN是HBV和丙型肝炎病毒(HCV)患者的一线治疗药物,临床研究已证实其可降低患者远期并发症HCC的发生率[32]。研究[33]证明,使用Peg-IFN处理HCC细胞,可通过Wnt/β-catenin信号通路抑制肿瘤细胞的增殖、侵袭能力。在体外,Peg-IFN通过降低HCC细胞中β-catenin/TCF的转录活性,并诱导DKKs和RanBP3(Ran binding protein 3,RanBP3)等负性调节因子的表达;在体内,Peg-IFN亦可降低细胞核β-catenin和cyclinD1的水平。Peg-IFN在体、内外均显示了其通过抑制Wnt/β-catenin信号通路降低HCC细胞增殖和侵袭能力。Peg-IFN的药代动力学特征与安全性已在长期的临床应用中得到证实,其降低肝炎患者的HCC发生率可能与其早期干预Wnt/β-catenin信号通路有关。
4 展望
越来越多的证据表明,Wnt/β-catenin信号通路的异常激活在HCC的发生、发展中起重要作用。靶向Wnt/β-catenin信号通路为HCC的治疗开辟了一条新的途径,该领域众多的小分子抑制剂和生物制剂的开发将为HCC的治疗提供新的思路。此外,苦参碱等天然化合物可通过调控Wnt/β-catenin信号通路削弱HCC的恶性程度,这为HCC的防治提供了更多的选择[34]。然而,针对Wnt/β-catenin信号通路的小分子抑制剂在HCC治疗中的应用仍未获得突破性进展,深入的研究有助于设计更有效的治疗策略,推动具有特殊分子特征HCC新疗法的进程。

