腹泻型肠易激综合征动物模型建立及评价
贺 星,刘 卫,唐 郡,朱 斌,李 超,郑 岩,崔立红
1.中国人民解放军联勤保障部队第九○一医院消化内科,安徽 合肥 230031; 2.中国人民解放军总医院第六医学中心消化内科
肠易激综合征(irritable bowel syndrome,IBS)是一种常见的功能性肠病,其主要症状是反复出现的与腹痛相关的排便异常[1]。IBS的发病机制复杂多样,胃肠动力和感觉异常是其病理生理基础[2],其发病与脑-肠轴功能改变有关[3],是一种生物-心理-社会障碍,因此构建动物模型存在一定的困难。IBS的分型中腹泻型IBS(diarrhea-predominant IBS, IBS-D)最常见[4-5],相关动物模型研究也最多[6],但目前仍无法完整的复制该疾病,缺乏完美的IBS-D动物模型。本研究结合相关报道和课题组前期经验,采用急-慢性应激结合的方法构建IBS-D大鼠模型,通过精神和躯体双重应激改变大鼠的肠道动力和敏感性模拟IBS-D的发病,取得良好效果,现报道如下。
1 材料与方法
1.1 实验动物及分组选择20只SPF级雌性Wistar大鼠为实验动物[7-8],体质量(160±10)g,购自北京科宇动物养殖中心,平衡饲养3 d后用于实验。实验前1周使大鼠适应实验环境,大鼠均被安置在独立代谢笼内。实验过程中,除非特殊干预,一直供应大鼠标准饮食及自来水,温度控制在(22±2)℃,并保持12 h/12 h照明/黑暗节律。将20只大鼠采用随机数字法分为模型组和对照组,每组10只。模型组:接受急-慢应激法构建IBS-D大鼠模型,对照组:正常饲养,不接受任何干预及处理。
1.2 实验仪器及试剂光源实时控制仪(CHNT);电热恒温培养箱(天津市泰斯特仪器有限公司,DH5000);动脉夹(北京合理科创,DMJ-1.6);水平振荡器(金坛市城西峥嵘实验仪器厂,SHZ-82);电子天平(METTLER、TOLEOD);大鼠固定器(北京搏贝科技有限公司,BB-500GB);自制AWR阈值检测仪器(血压计、导尿管、灌胃针及无菌手套);全封闭组织脱水机、组织包埋机型号、切片机、显微镜由我院病理科提供;10%水合氯醛(河北蓝梦生物科技有限公司);2.5%戊二醛(北京天悦基因有限公司,200 ml);二甲苯、石蜡、Ehrish苏木精、10%甲醛、伊红酒精染色剂、中性树胶等由我院病理科提供。
1.3 造模方法急-慢应激法[9]:给予Wistar大鼠以下刺激,夜间连续照明12 h,45 ℃闷热的环境中5 min(见图1A),禁水24 h,4 ℃寒冷的环境中3 min(见图1B),夹尾1 min(见图1C),水平振动(120次/min),40 min(见图1D)和食物剥夺24 h。每周按照随机顺序给予模型组上述刺激,每连续2 d给予的刺激顺序不能重复,避免大鼠能够预知刺激的发生,连续3周,然后休息1周。再给予纸带束缚前肩、前上肢、胸部,限制前上肢搔抓头面部,但不限制其活动(见图1E),束缚时间为1 h。

图1 急-慢应激刺激图示 A:闷热刺激;B:冷刺激;C:夹尾应激;D:水平震荡;E:急性束缚应激; F: 避水应激Fig 1 Acute-chronic stress A: stuffy stimulation; B: cold environment; C: tail clamp; D: level vibration; E: acute restraint stress;F: water avoidance stress
1.4 检测指标
1.4.1 大鼠体质量:使用电子天平对两组大鼠进行称重并记录数值(g)。
1.4.2 蔗糖水摄入量[10]:在模型制备前,对所有大鼠进行1%蔗糖水摄入训练,训练方法:连续48 h给予大鼠自由摄入1%蔗糖水,然后24 h的禁水处理,最后测量1 h内1%蔗糖水摄入量(ml)。
1.4.3 1 h排便量:采用避水应激法[11]测量大鼠排便量(见图1F)。实验设备由透明有机玻璃容器(45 cm×25 cm×25 cm)和固体平台(10 cm×8 cm×8 cm)组成,平台置于玻璃容器底部,玻璃容器中装入室温水,高度为距离平台顶端1 cm,将大鼠置于平台上,使其对水产生心理应激反应,促进大鼠排便。观察记录其1 h排便粒数(干便)或次数(稀便)。于实验28~30 d连续记录5次数值,取平均值。
1.4.4 稀便率:通过滤纸印记判断湿便次数[9],记录24 h内大便总次数、湿便次数,根据湿便次数及大便总次数计算稀便率。稀便率=湿便次数/大便总次数×100%。于造模后记录模型组、对照组大鼠稀便率。
1.4.5 肠道敏感性:采用检测大鼠腹部回撤反射(abdominal withdrawal reflex,AWR)压力阈值(mmHg)的方法检测大鼠肠道敏感性(见图2A)[12]。大鼠禁食12 h,不禁水。将大鼠置于固定器内,石蜡油润滑后将气囊插入肛门约6 cm,胶布固定防止滑脱。苏醒后适应20 min,血压计恒速向气囊注气加压,当大鼠出现腹部肌肉收缩(AWR评分2分)(见图2B),此时压力为疼痛压力阈值[13]。
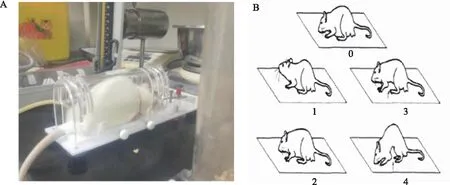
图2 AWR压力阈值检测方法(A)及AWR评分示意图(B)Fig 2 Detection method of AWR pressure threshold(A) and AWR score diagram(B)
1.4.6 HE染色观察结肠组织结构[14]:处死大鼠后,收集远端结肠,冲洗并固定在10%甲醛。然后经连续清洁和脱水处理结肠组织,并包埋在石蜡块中。最后将结肠组织切成薄片并进行标准HE染色。由病理科专业人员使用奥林巴斯光学显微镜放大40倍观察大鼠乙状结肠黏膜上皮的完整性,有无组织缺损、糜烂、水肿及溃疡。

2 结果
2.1 两组大鼠1 h排便量和湿便率比较造模后,比较两组大鼠1 h排便量,模型组(7.14±0.84)粒或次/h明显高于对照组(0.82±0.42)粒或次/h,差异有统计学意义(t=21.281,P=0.000);模型组大鼠湿便率(12.15±0.85)%明显高于对照组(0),差异有统计学意义(t=45.202,P=0.000)(见表1)。

表1 两组大鼠1 h排便量和湿便率比较Tab 1 Comparison of defecation number and wet feces rate between two groups of rats
2.2 两组大鼠造模前后疼痛压力阈值(AWR 2分)、糖水摄入量及体质量比较造模前,模型组与对照组大鼠疼痛压力阈值、蔗糖水摄入量及体质量比较,差异无统计学意义(P>0.05)(见表2);造模后,模型组大鼠疼痛压力阈值、蔗糖水摄入量及体质量明显低于对照组,差异有统计学意义(t=13.123,P=0.000;t=7.600,P=0.000;t=9.434,P=0.000)(见表2)。

表2 两组大鼠造模前后疼痛压力阈值、蔗糖水摄入量及体质量比较Tab 2 Comparison of pain pressure threshold, sucrose water intake and body weight between two groups of rats before and
2.3 两组大鼠肠道组织HE染色光镜下结果HE染色光镜下显示,两组大鼠结肠黏膜均未见明显水肿、糜烂、溃疡、出血,固有层内无中性粒细胞浸润,间质无明显水肿(见图3)。
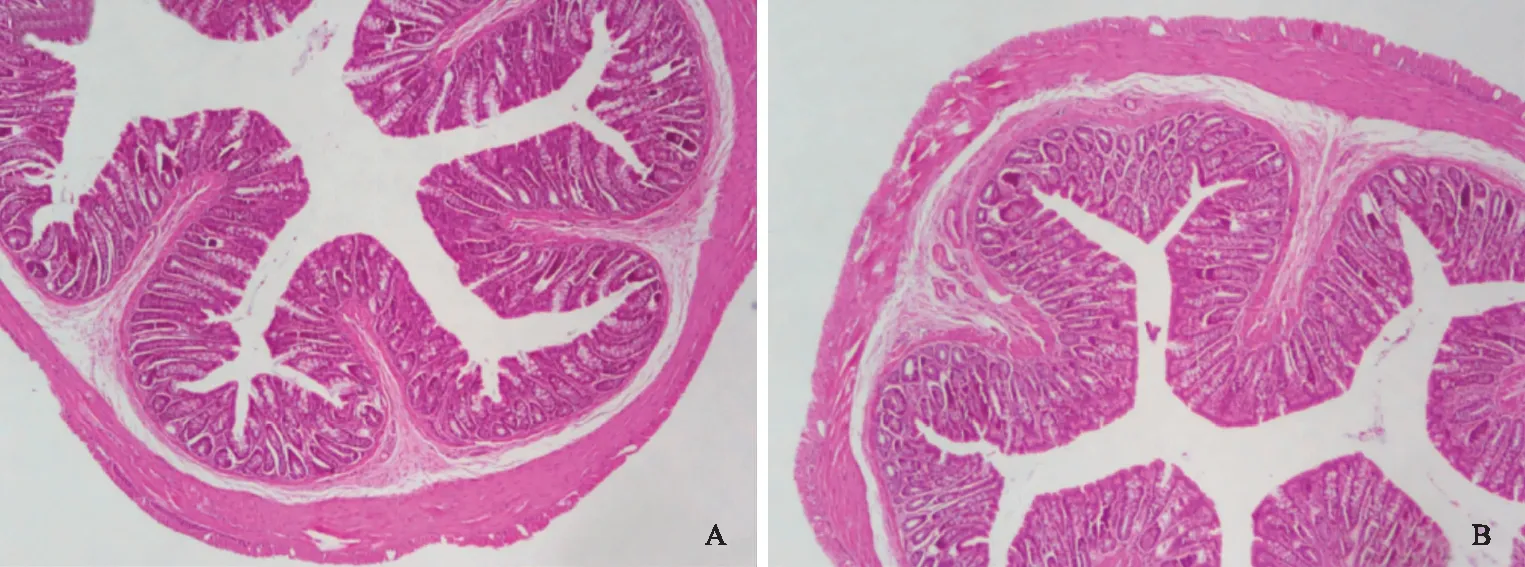
图3 两组大鼠结肠黏膜光镜下表现(HE染色,40×) A: 对照组; B: 模型组Fig 3 Intestinal mucosal structure under light microscopy (HE staining,40×) A: control group; B: model group
3 讨论
IBS是一种常见的功能性肠病,在人体内的病理生理学尚不完全清楚,因此通过动物模型成功鉴定IBS症状改善的分子生物学基础,对于其临床前和转化研究十分重要[15]。目前研究常用的动物模型主要针对IBS-D,包括束缚应激模型、母婴分离、避水应激模型、多因素精神应激模型、结直肠扩张、感染后肠易激综合征(post-infectious IBS,PI-IBS)动物模型、理化刺激模型及转基因模型[16-19],均从一定程度上构建出IBS-D的内脏敏感和动力异常特征,但仍无法完整复制疾病特点。本研究采用的应激方式涵盖睡眠、饮食、运动、感知及情绪方面,旨在通过反复中小强度的多因素刺激使大鼠通过“脑-肠轴”达到一种应激与适应相对平衡状态,即IBS-D状态,从而短暂模拟人类IBS-D患者病理生理。结果发现,通过28 d的慢性应激+1 d的急性应激后,所有大鼠均无死亡,模型组大鼠在排便次数、稀便率、蔗糖水摄入量、体质量、疼痛压力阈值等方面出现IBS-D样变化,效果明显且安全可行。
造模完成后,课题组首先分析两组大鼠1 h排便量和湿便率,对应IBS-D症状中的排便次数增加和稀便。本研究采用避水应激方法检测1 h排便量,可以模拟IBS-D在应激时排便增多的特点,主要反映大鼠的肠道动力和敏感性;采用的滤纸印迹法可以精确反应大鼠湿便次数,湿便率升高与肠道黏膜屏障功能障碍有关。研究发现,模型组大鼠1 h排便量和湿便率均高于对照组,该结果提示从症状角度,IBS-D大鼠模型构建成功。但本研究的IBS-D大鼠湿便率并未达到IBS-D定义的25%[20],该结果考虑与本实验采用判断湿便的方法(滤纸印记)以及大鼠本身的生理特征有关。
其次,为了直观地观察大鼠肠道敏感性,本研究使用目前公认的AWR评分进行判断[21]。观察大鼠疼痛压力阈值,发现IBS-D大鼠AWR 2分压力阈值明显低于正常大鼠,提示IBS-D大鼠肠道敏感性低于正常大鼠,从肠道敏感性角度提示大鼠造模成功。
另外,为明确模型组大鼠情绪状态,课题组对两组大鼠的蔗糖水摄入量进行研究。蔗糖水摄入量是判断大鼠抑郁情绪的一种手段[9],蔗糖水摄入量降低代表大鼠快感缺失。本实验结果显示,模型组大鼠蔗糖水摄入量明显低于对照组大鼠,提示模型组大鼠存在情绪障碍,体现出脑-肠轴在IBS-D发病中的作用。
本研究同时分析了大鼠的体质量动态变化,发现两组大鼠体质量均呈升高趋势,但受到应激刺激的大鼠体质量增长幅度较小,造模成功后体质量明显低于对照组,考虑与大鼠处于应激状态及排便量多有关。体质量方面的差异与人类IBS患者特点有所差异,原因可能大鼠是适应应激方面与灵长类动物尚存在差距,提示动物模型还有待完善。
本研究重点对两组大鼠显微结构进行了观察,结果通过40倍光镜下观察并未发现水肿、糜烂、溃疡、出血以及炎性细胞浸润,符合IBS-D肠道组织无器质性病变的特点[22],从该角度分析造模成功。
综上所述,急-慢刺激后的大鼠在肠道症状、动力及感知、情绪障碍、显微结构方面与IBS-D发病特点一致,是一种安全有效的IBS-D造模方法。

