唾液胃蛋白酶检测对胃食管反流病诊断价值的Meta分析
吴 昊,陈 婧,郭宝娜,李 莉,姜佳丽,王 凝,张 川,展玉涛,郭子皓
首都医科大学附属北京同仁医院 1.心内科; 2.消化内科,北京 100730
胃食管反流病(gastroesophageal reflux disease,GERD)是一种常见病,全球患病率为8%~33%,我国患病率为5.7%~16.9%。随着人口老龄化加剧、超重和肥胖患病率增加,我国GERD患病率有逐年上升趋势。GERD指胃及十二指肠的胃内容物反流进入食管,引起不适症状和(或)并发症的疾病。反流至食管时典型的症状为反酸、烧心,可合并食管炎,严重者可发生Barrett食管甚至食管腺癌。反流物反流至咽喉、支气管等时可引起一系列食管外症状,如咽部不适、声音嘶哑、咳嗽、哮喘等,这部分患者常被误诊为呼吸系统或咽喉疾病而延误病情[1-2]。
目前GERD的主要诊断方法包括症状相关问卷调查、经验性质子泵抑制剂(proton pump inhibitors,PPIs)治疗、胃镜检查、24 h食管pH监测和24 h食管pH-阻抗监测(24 hours pH and multichannel intraluminal impedancemetry,24 h pH-MII)。症状相关问卷调查的灵敏度和特异度较低。胃镜检查多用于有报警症状的患者或难治性GERD患者的进一步鉴别诊断,非糜烂性反流病(non-erosive reflux disease,NERD)和大多数食管外反流(extra-esophageal reflux,EER)及咽喉反流胃镜下无食管炎表现。目前GERD诊断的金标准是24 h pH-MII,但该检查具有费用高、侵入性、耐受性差等缺点[3]。
胃蛋白酶是胃液的主要成分,也是反流物的成分,它是由胃主细胞分泌的胃蛋白酶原在胃液中经胃酸活化后产生的。正常情况下胃蛋白酶仅存在于胃液中,如果能从唾液中检测到胃蛋白酶,则表明存在有胃及十二指肠内容物的反流,理论上为反流性疾病的客观诊断依据,有望成为GERD简单、无创的诊断方法。目前已有多项临床研究评估了唾液胃蛋白酶在GERD中的诊断价值,但单个临床研究样本量较小,且各研究间采用了不同的检测方法及阈值,研究结果存在差异。本研究旨在通过Meta分析的方法,对唾液胃蛋白酶检测对GERD的诊断价值进行综合评价,从而提供更全面确切的循证医学证据。
1 资料与方法
1.1 文献检索计算机检索中国知网(CNKI)、万方数据库、PubMed、Embase、The Cochrane Library,收集有关唾液胃蛋白酶检测诊断GERD的诊断性试验,检索时间截至2020年1月。中文检索词包括唾液、胃蛋白酶;英文检索策略为(“salivary”or“saliva”) and (“pepsin”),未限定语言种类。同时为降低漏检的可能,还检索了相关综述及纳入文献的参考文献,尽可能纳入更全面的相关研究。
1.2 文献纳入及排除标准纳入标准:(1)研究目的为评价唾液胃蛋白酶对GERD诊断价值的研究;(2)成人患者;(3)可从文献资料提取出四表格资料数据,包括真阳性数(ture positive,TP)、假阳性数(false positive,FP)、真阴性数(true negative,TN)、假阴性数(false negative,FN);(4)病例数不少于20例。排除标准:(1)病例数少于20例;(2)文献属于动物实验、综述、个案、会议报道、信件、评述报告;(3)原始文献不能直接或间接获得四表格资料;(4)重复文献仅纳入最新、数据最全的一次;(5)除英文及中文以外的文献。
1.3 数据提取及文献质量评估由研究组成员共同制定数据提取表,2名研究者独立阅读文献标题及摘要,按照纳入及排除标准进行取舍。当对文献纳入有争议时,进行讨论决定。提取文献年份、作者、发表地区、样本量、研究设计、检测方式、TP、FP、TN、FN。采用诊断性试验准确性质量评价工具QUADAS-2评价文献质量及偏倚,共11条项目,每个项目均按照“是”、“否”、“不清楚”3个标准进行判断。如果11条项目质量评价标准均为“是”则研究存在偏倚的可能性极低(A级);如果其中任何一条或多条质量评价标准为“不清楚”,则该研究存在偏倚的可能性为中等(B级);如果其中任何一条或多条质量评价标准为“否”,则该研究存在高度偏倚的可能性(C级)[4]。应用Revman 5.2绘制文献质量及偏倚图表。
1.4 统计学分析采用Stata 13及Meta-disc 1.4软件进行诊断性研究的统计分析。通过计算Cochrane-Q值和I2值检验非阈值效应引起的异质性,并计算P值,当P≤0.1时,提示各研究结果间存在异质性。I2<25%存在低度异质性,25%≤I2≤50%存在中度异质性,I2>50%存在高度异质性。如存在高度异质性(P≤0.05,I2>50%),采用随机效应模型进行Meta分析,如各研究结果见无异质性,采取固定效应模型进行分析。计算特异度、灵敏度、阴性似然比(negative likelihood ratio,NLR)、阳性似然比(positive likelihood ratio,PLR)和诊断比值比(diagnostic odds ratios,DOR),并计算各指标相应的95%可信区间(confidence intervals,CI)。汇总受试者工作特征(summary receiver operating characteristic,SROC),并计算曲线下面积(area under the curve,AUC),AUC越高,提示诊断价值越好,一般认为AUC<0.6为低区分度,0.6~0.75是中区分度,>0.75为高区分度。采用Meta回归分析发现可能的异质性来源,必要时采用亚组分析重新计算DOR[5-6]。采用漏斗图分析是否存在发表偏倚。
2 结果
2.1 文献检索结果通过文献全面检索,初检出相关文献577篇,经筛选后最终纳入13项研究[7-19],共1221例GERD患者及883例对照者。文献筛选流程及结果见图1。

图1 文献筛选流程及结果 Fig 1 Flowchart of study identification and inclusion
2.2 纳入文献特征13项研究中,英文文献9篇(英国4篇,中国2篇,日本、捷克、韩国各1篇),中文文献4篇。诊断标准依据食管pH/pH-阻抗监测结果的文献为11篇。其中8篇应用Peptest监测唾液胃蛋白酶,3篇应用蛋白印迹法,1篇应用乳胶增强免疫比浊法,1篇应用酶联免疫标记法(ELISA)(见表1)。

表1 纳入研究的基本特征Tab 1 Summary of study characteristics
2.3 纳入研究的方法学质量评价总体而言,有1篇文献[17]偏倚的可能性极低(A级),9篇文献[7,10-14,16,18-19]存在偏倚的可能性为中等(B级),3篇文献[8-9,15]存在高度偏倚的可能性(C级)(见图2)。

图2 QUADAS-2文献质量评价情况 Fig 2 Quality of the studies assessed by QUADAS-2 questionnaire
2.4 统计学分析结果Meta分析结果见图3~4。唾液胃蛋白酶诊断GERD各研究的灵敏度合并为79.3%(95%CI:76.9%~81.6%),特异度合并为66.1%(95%CI:62.9%~69.2%),PLR为2.2(95%CI:1.6~2.9),NLR为0.44(95%CI:0.31~0.63),DOR为5.4(95%CI:3.0~9.8)。唾液胃蛋白酶诊断GERD的SROC曲线下面积为0.76,提示具有较好的诊断价值。本研究I2>50%(P≤0.05),提示各研究结果间存在明显统计学异质性,故选择随机效应模型进行Meta分析。同时通过Meta回归分析模型发现可能的异质性来源,纳入分析的指标包括研究纳入的样本量(>50或≤50)、研究地区(亚洲或其他)、研究中应用的金标准(24 h pH监测/pH-阻抗监测或其他)、阈值(>36 ng/ml或≤36 ng/ml)、检测方法(Peptest或其他),结果提示均无异质性(P>0.05)。
2.5 发表偏倚评价评价发表偏倚的漏斗图未呈现明显的不对称性(见图5),差异无统计学意义(P=0.51),说明所纳入的研究不存在明显发表偏倚。
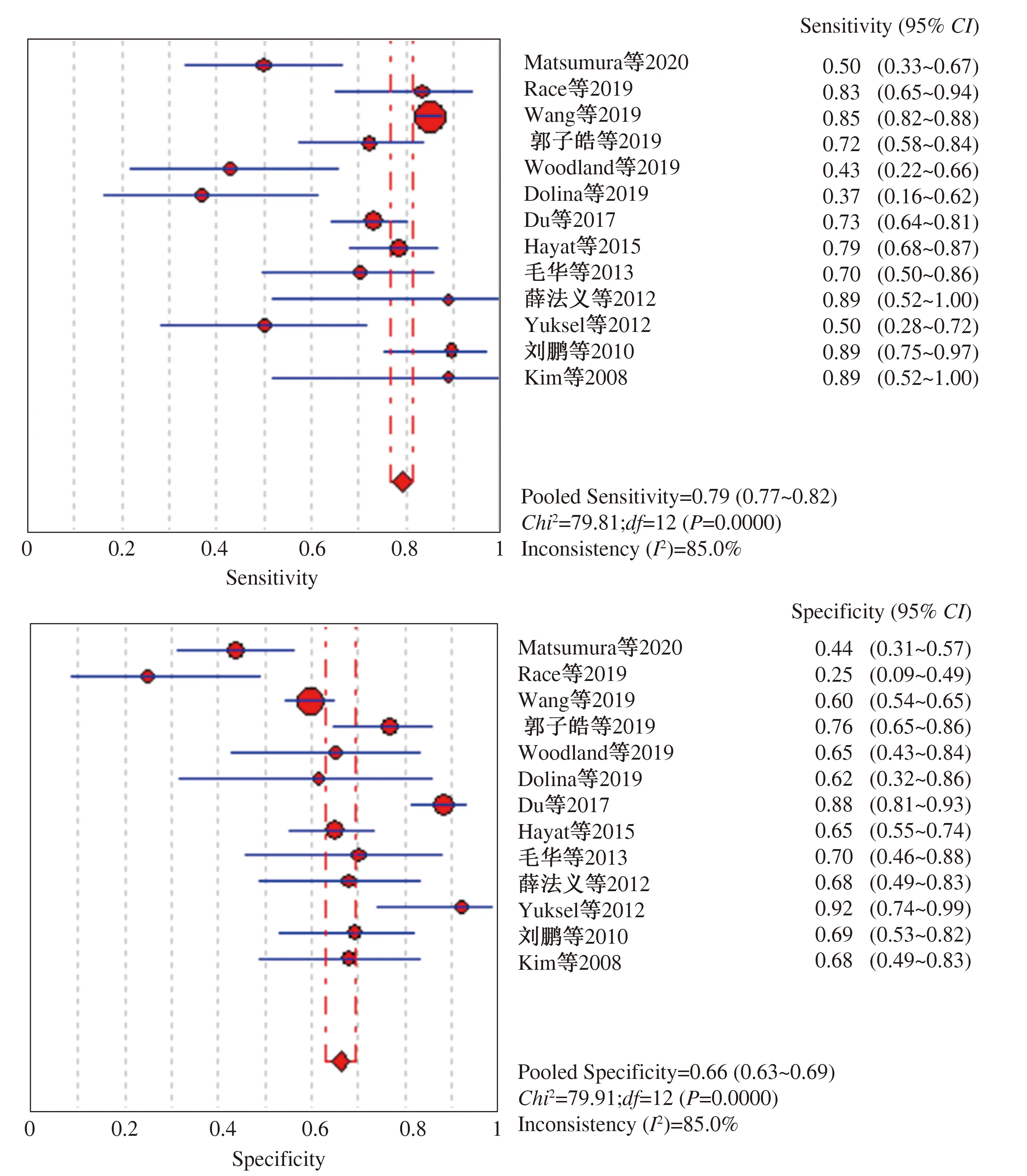
图3 唾液胃蛋白酶检测诊断GERD的灵敏度和特异度的Meta分析 Fig 3 Sensitivity and specificity of salivary pepsin detection for diagnosis of GERD


图4 唾液胃蛋白酶检测诊断GERD的SROC曲线;图5 检测发表偏倚的Deeks漏斗图 Fig 4 SROC curve of salivary pepsin detection for GERD; Fig 5 Publication bias of Deeks funnel plot
3 讨论
唾液胃蛋白酶仅在胃内产生,是由胃主细胞分泌的胃蛋白酶原被胃酸活化后形成的,因此它是胃反流的特异性生物标志物。与胃镜检查及食管反流监测(24 h食管pH监测、24 h pH-MII、48 h食管无线pH监测)相比,在唾液中检测胃蛋白酶是一种无创、方便的诊断工具。目前有多种检测唾液胃蛋白酶的方法,包括酶联免疫吸附法、纤维蛋白原溶解检测法、蛋白印迹法等,及近期热门的Peptest检测法[20-21]。蛋白印迹法、纤维蛋白原溶解检测法为定性的检测方法,酶联免疫吸附法为定量的检测方法。Peptest检测简单易行,在Peptest试剂条的取样区滴加离心后的唾液上清液,15 min后即可得出胃蛋白酶定性检测结果,最低检测线为16 ng/ml,>16 ng/ml即可在测试区出现阳性结果,如配备相应的读取系统,可定量测出唾液中的胃蛋白酶浓度。Peptest方法较其他检测方法相比具有标准化的优点,检测过程对试验条件和操作者技术要求较低,在西方国家应用较广[20-21]。
不同研究中唾液胃蛋白酶对GERD的诊断价值各不相同,本Meta分析纳入的研究中,诊断的灵敏度波动于43%~89%,特异度波动于25%~92%[7-19]。唾液胃蛋白酶诊断GERD的各研究的灵敏度合并为79.3%,特异度合并为66.1%,SROC的曲线下面积为0.76,提示具有较好的诊断价值。在正常人群中存在生理性反流,偶尔也可在唾液中检测出胃蛋白酶,故生理性反流的存在可能降低唾液胃蛋白酶诊断GERD特异度,提高诊断阈值可提高诊断的特异度[5]。反流到口腔的唾液胃蛋白酶,经过唾液的稀释及食管的廓清,浓度可下降,故也存在有病理性反流但唾液胃蛋白酶浓度较低或未检出的问题,增加留取唾液的次数,有助于增加敏感性[20]。
目前唾液胃蛋白酶检测对GERD诊断尚无规范化的检测流程,如留取标本的时机及标本量,标本的处理方法等。有研究显示,有症状时留取唾液标本具有更高的阳性检出率[12]。Na等[22]研究表明,在有食管近端反流可靠证据的患者中,晨起收集的唾液中胃蛋白酶的浓度显著高于其他时间收集的唾液。而Hayat等[14]研究表明,GERD患者餐后唾液样本阳性率高于空腹,并建议24 h内进行多次餐后采样。
唾液胃蛋白酶检测不仅用于诊断,还可用于预测治疗反应。一项前瞻性的单队列研究显示,唾液/痰液样本中的Peptest阳性结果与良好的PPI反应显著相关,阳性预测值为79.2%[23]。一项试点试验表明,唾液胃蛋白酶可能是治疗成功的一个标志,在腹腔镜手术成功治疗GERD的患者中,胃蛋白酶中值从206.3 ng/ml下降到76.0 ng/ml[24]。
目前尚无荟萃分析纳入中文文献评估唾液胃蛋白酶对GERD的诊断价值,本文纳入中文文献进行唾液胃蛋白酶对GERD诊断价值研究的荟萃分析。Calvo-Henriquez等首次系统回顾了唾液胃蛋白酶对咽喉反流(laryngopharyngeal reflux,LPR)诊断价值,文中纳入各种唾液胃蛋白酶检测方法,但未进行Meta分析合并的灵敏度和特异度[20]。Wang等[21]首次对唾液胃蛋白酶对LPR诊断价值进行了Meta分析,虽然在上述两篇文章的标题只提及对LPR的诊断价值,但纳入的研究包括了GERD和LPR的研究。本研究未纳入唾液胃蛋白酶诊断咽喉反流的研究。尽管理论上讲咽喉反流是一种高位的反流,同时有研究表明,咽喉反流患者的咽部平均细胞间隙明显增加,提示LPR与GERD有共同的发病机制[25]。然而,也有研究显示在有咽喉反流症状的人群中,并未见反流性食管炎的患病率增加,食管外器官对反流物的抵抗能力和清除能力均弱于食管,对反流物的反应阈值通常低于食管,且可能存在其他的发病机制[26]。同时,LPR和GERD的诊断标准相差较大,如合并分析存在较大的异质性,故本研究仅纳入了唾液胃蛋白酶对GERD诊断的研究。
本研究具有以下局限性:首先,本研究异质性较高,Meta回归分析未提示研究纳入的样本量(>50或≤50)、研究地区(亚洲或其他)、研究中应用的金标准(24 h pH监测/pH-阻抗监测或其他)、阈值(>36 ng/ml或≤36 ng/ml)、检测方法(Peptest/其他)为显著的异质性来源。考虑异质性来源可能在以下方面:纳入研究对唾液胃蛋白酶的检测方法不同,同时检验阈值不同,存在异质性可能;对于GERD的诊断标准不尽相同,包括问卷、24 h pH监测、24 h PHMII及试验性治疗,可导致纳入病例缺乏严格同质性;部分研究纳入健康人作为对照,不能避免病例选择的偏倚。不同研究中无标准化的唾液留样及检测流程、阈值的不同,不同研究机构对病例筛选标准不统一及存在潜在数据解释偏倚均有可能是异质性的来源。其次,由于目前的研究是基于已发表的研究,发表偏倚是一个不可避免的问题。最后,一些文章的数据无法提取及部分信息缺失,限制我们进行更详细的分析。
综合Meta分析的结果,唾液胃蛋白酶检测对GERD存在一定的诊断价值。今后应进行较大规模的前瞻性研究进一步评估唾液胃蛋白酶检测对GERD的诊断价值,同时制定统一的取样、检测流程及阈值。

