两种呼吸道感染方式建立小鼠流感病毒感染模型的比较
杨玉琴,徐春华,周文江,周晓辉∗
(1.上海市第一人民医院,上海 200080;2.上海市公共卫生临床中心,上海 201508;3.复旦大学药学院,上海 201203)
流感是由流感病毒引起的一种急性呼吸道传染病,容易引起爆发流行,对人类公共健康构成严重威胁。据统计,每年约有25~50万人死于季节性流感,占每年所有死亡人数的0.5%~1%[1-2]。近些年来新型的跨物种呼吸道流感病毒不断出现,如1997 年H5N1、2009 年H1N1、2013年 H7N9,这些新型呼吸道流感病毒不可预知、传播速度快、防控困难、死亡率高,对人类的威胁更为严重[3]。因此,对于流感发病机制及新型疫苗和药物的开发研究是十分必要的,而选择合适的流感动物模型是进行此类研究的基础与保证。
目前已知人类流感的传播方式主要有三种,一是气溶胶,二是飞沫,三是接触[4]。因此,选择与人类传播方式类似的感染方式对构建流感动物模型至关重要。滴鼻和气溶胶感染是目前被认为较为合理的感染方式[5-6],本研究通过对这两种感染方式建立模型的比较,分析不同建模方式对流感模型的影响,从而为流感病毒不同层面的研究选择合适感染方式建立模型提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
120只4~6周龄SPF级雄性C57BL/6小鼠,体重18~20 g。由上海西普尔-必凯实验动物有限公司【SCXK(沪)2018-0004】提供。实验在 ABSL-2(动物生物安全Ⅱ级)实验室(注册备案号:金字第022006005号)中开展,温度22~26℃、湿度40%~60%,12 h日夜周期交替。所有操作均符合上海市公共卫生临床中心实验动物伦理要求(IACUC号:公卫伦审2018-A60-02)。
1.1.2 病毒株
流感病毒株为 H1N1 PR8,经无特定病原体(specific pathogen free,SPF)鸡胚增殖后收集病毒尿囊液,病毒浓度为每毫升1×106TCID50,-80℃储存备用,实验均在BSL-2(生物安全II级)实验室中进行。
1.1.3 主要试剂与仪器
DMEM 培养液(Gibco,1868707),异氟烷(上海雅培制药有限公司,B506),RNA抽提试剂盒(QIAGEN GmbH,52906),RT-PCR kit(Perfect Real Time,RR096A),CBA KIT(BD,552364)。
生物安全柜(HR40-II A2,Haier,中国),流式细胞仪(LSR Fortessa,BD 公司,美国),PCR 仪(ViiA7,ABI,美国),匀浆机(607EUR,Biospec,美国),微量分光光度计(Nanodrop 1000,Thermo,美国)。
1.2 方法
1.2.1 LD50的测定和小鼠感染
H1N1 PR8 分别稀释 1、10、100、1000、10000,80只C57BL/6小鼠,随机分成滴鼻和气溶胶各5组,每组8只,气溶胶各组分别将小鼠放入气雾攻击装置,将不同浓度5 mL病毒放入吸入的玻璃管中,按照一定程序进行气溶胶感染,具体程序参考文献[7]。滴鼻各组分别给每只小鼠鼻腔滴入不同浓度50 μL病毒,逐日观察小鼠死亡情况,按 Reed-Muench法计算两种感染方式的半数致死量(LD50)。
40只C57BL/6小鼠,随机分成滴鼻组和气溶胶组,用0.5 LD50的病毒浓度进行感染,感染当日记为0 d,感染后小鼠分笼饲养在独立送风隔离笼具中,观察14 d。逐日观察小鼠发病情况,并记录每日体重变化及死亡情况。
1.2.2 观察指标
每日观察感染小鼠的临床表现,称体重,每组感染小鼠分别于感染后第3、7、14天处死,各处死4只,剩余小鼠继续观察。小鼠处死前称量体重和采血,小鼠处死后打开胸腔,迅速取出肺称量肺湿重,肉眼观察肺大体病变后进行取材。取左肺上叶同一部位约1 cm×1 cm×1 cm组织做HE染色,镜下观察其病理变化;取部分肺组织做病毒和细胞因子检测。并统计感染小鼠体重改变率和肺指数变化,具体计算方法参考文献[7]。
1.2.3 肺组织总RNA提取及病毒载量检测
抽提组织中的总 RNA,测定核酸浓度(OD 260/OD 280)后,加 RNAase-free DNAse I 37℃放置20 min,然后65℃放置10 min。纯化后的样本进行荧光定量PCR检测,扩增体系为25 μL:12.5 μL TaqMan PCR基础液,上下游引物各1.5 μL(10 μmol/L),TaqMan 探针1.2 μL,2.5 μLRNA 模板,水(无 RNA 酶)5.8 μL。 扩增程序:42℃ 10 min;95℃1 min;95℃ 15 s,60℃ 45 s,45 个循环(表 1)。
1.2.4 肺组织细胞因子的测定
肺组织匀浆后,取上清,采用CBA细胞因子检测试剂盒进行检测,严格参照流式微珠阵列术说明书进行操作。
1.3 统计学分析
2 结果
2.1 LD50的测定结果
根据试验结果按Reed-Muench法计算H1N1 PR8通过滴鼻和气溶胶两种方式感染C57BL/6小鼠的 LD50值,结果分别为每毫升 7.94×103TCID50和每毫升1.32×102TCID50,用不同浓度的病毒感染小鼠,滴鼻和气溶胶感染小鼠死亡率比较见表2。
2.2 临床症状观察
两组小鼠在感染后的第3天均开始出现反应迟钝、厌食、竖毛及体重减轻等症状,分别于第5、7天开始出现小鼠死亡,存活的小鼠在感染后第10天症状开始减轻。在体重方面,两组小鼠都是体重先降低后逐渐恢复。在感染早期的体重降低期,两组小鼠的体重降低率为气溶胶组大于滴鼻组,在感染后期的体重恢复期,体重恢复率也是气溶胶组大于滴鼻组(图1A)。两组小鼠的肺指数变化均为先增高后降低,在感染后第7天达到最高。第3天的肺指数,气溶胶组与滴鼻组相比有显著的差异(P<0.05);第7天和第14天的肺指数,两组无差异(图1B)。
2.3 感染小鼠肺组织病毒载量测定
各组小鼠于感染后第3、7、14天处死,肺组织匀浆后取上清进行病毒载量的测定,检测结果为各感染组均于感染后第3天的病毒载量最高,第7、14天逐渐降低。第3天气溶胶组小鼠的病毒量载量显著高于滴鼻组小鼠(P<0.05);第7、14天的气溶胶组小鼠的病毒载量仍高于滴鼻组小鼠,但无显著性差异(图2)。
2.4 感染小鼠病理学观察
滴鼻感染组小鼠肺的病理变化:感染后第3天小鼠肺部的病变范围为10%~30%,主要集中在主支气管肺部,镜下可见一定量的炎细胞浸润肺泡间隔;感染后第7天小鼠肺部的病变范围为70%~90%,镜下可见大量的炎细胞的浸润到肺泡间隔及肺泡内,部分区域出现间质性肺炎或肺水肿。感染后第14天小鼠肺部的病变范围为50%~70%,炎细胞浸润较7 d减少,局部可见肺水肿(图3)。气溶胶组小鼠病理结果显示:感染后第3天小鼠肺的病变范围为20%~50%,从主支气管肺部向末端细支气管肺部扩散,镜下可见一定量的炎细胞浸润肺泡间隔,炎细胞数目较滴鼻组小鼠多;肉眼观察感染后第7天小鼠肺的病变范围为70%~90%,镜下可见大量的炎细胞的浸润到肺泡间隔及肺泡内,部分区域形成间质性肺炎或肺水肿。肉眼观察感染后第14天每只小鼠肺的病变范围为60%~70%,镜下观察可炎细胞浸润较7 d减少,但局部仍可见肺水肿(图3)。气溶胶感染小鼠的病变进程与滴鼻感染小鼠相似,除第3天病变较滴鼻感染范围大、炎细胞多外,两种感染方式感染的小鼠都出现了间质性肺炎,肺水肿等典型病变。

表1 H1N1 PR8引物序列Table 1 Primer sequences of H1N1 PR8
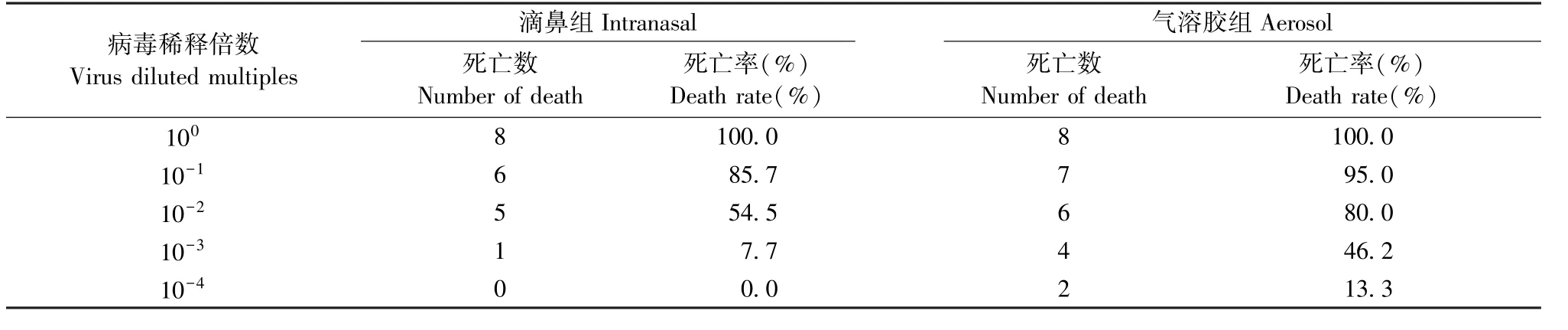
表2 两种感染方式小鼠死亡情况(n=8)Table 2 The death of mice in two modes of infection(n=8)

图1 攻毒后小鼠体重变化率及肺指数Note.Significant difference in lung index of the groups of intranasal and aerosol, ∗P< 0.05.(The same in the next figure)Figure 1 The body weight change ratio of the mice and lung index of the mice after inoculation
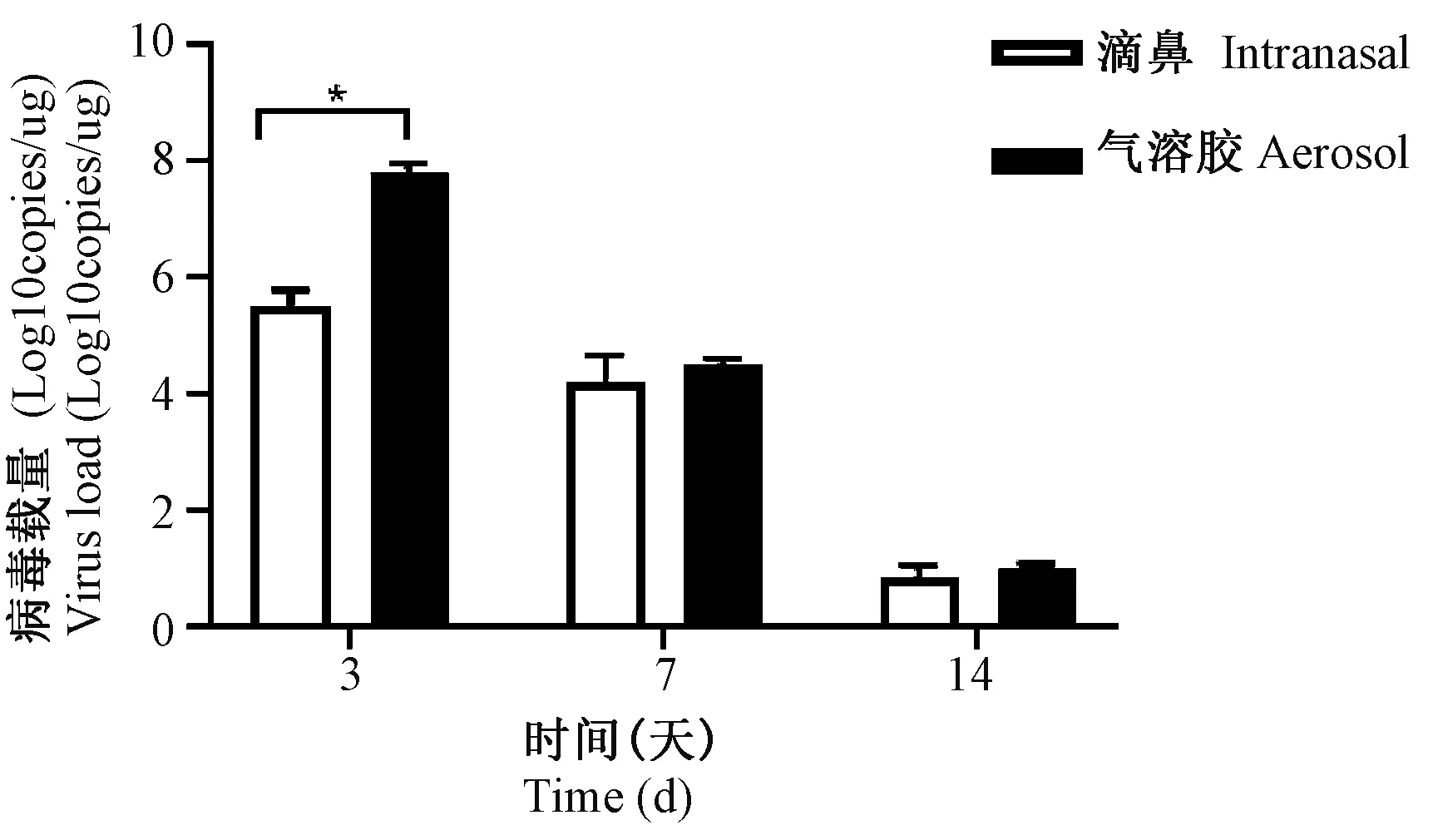
图2 攻毒后小鼠病毒载量Figure 2 Viral load of the mice after virus inoculation
2.5 感染小鼠肺炎症细胞因子的测定
各组小鼠于感染后第3、7、14天处死,取肺组织匀浆上清进行 IL-1α、IL-6、TNF-α 和 IFN-γ 等炎症细胞因子的检测,结果显示气溶胶组小鼠肺内IL-1α、IL-6的表达量在感染后第3、7天均高于滴鼻组(P<0.05),第14天稍高于滴鼻组,但无显著性差异。气溶胶组小鼠肺内TNF-α的表达量在感染后第7天高于滴鼻组(P<0.05),在感染后第3、14天稍高于滴鼻组,但无显著性差异。IFN-γ在各个时间点气溶胶组略高于滴鼻组,但无显著差异(图4)。
3 讨论
建立流感动物模型有很多感染方式。人类流感为呼吸系统疾病,因此建立模型最有效的方式就是呼吸道感染,滴鼻和气溶胶是目前最常用的两种呼吸道感染方式[7-8]。病毒气溶胶是指病毒以单独悬浮状态、与干燥固体颗粒(尘埃)、液体微粒(液体小滴)相连接在空气中悬浮,其粒径约 0.001~100 μm[9]。Tellier[10]证实在部分人类流感传染过程中气溶胶传染方式起主要作用,因此近年来,很多学者采用气溶胶的方式来建立流感动物模型。滴鼻方式主要模拟人类飞沫感染方式,是目前被广泛采用的建立流感动物模型的方法[11],气溶胶与滴鼻两种感染方式建立的流感动物模型有什么差异?目前未见相关报道。因此开展两种感染方式建立模型的比较研究,对于合理使用动物模型以及深入研究该疾病的发病机制都有重要意义。

图3 攻毒后小鼠肺的病理改变Note.A.Gross pathological changesin unaided viewing.B.Histopathological changes in microscopic.HE staining.Figure 3 Pathological changes in the mice after virus inoculation
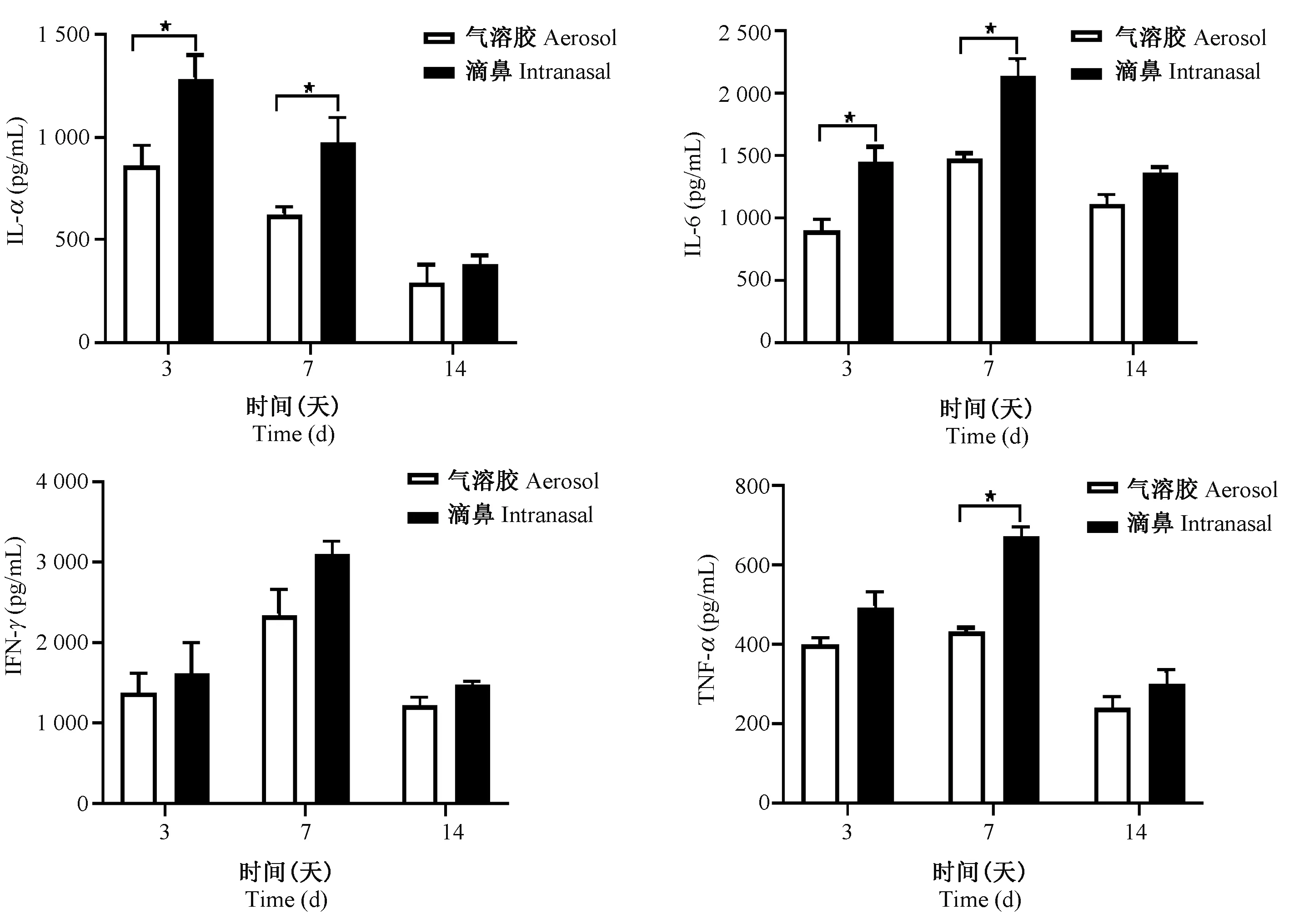
图4 攻毒后小鼠肺内细胞因子含量Figure 4 Level of cytokines in lung of mice after inoculation
本研究采用滴鼻和气溶胶两种感染方式构建流感模型,结果发现两种方式均可成功建立流感小鼠模型,病程进展的总体趋势基本一致。但两组小鼠流感模型的感染特点存在一定差异,在感染的早期,气溶胶感染组小鼠肺内病毒载量和炎症细胞因子的浸润程度明显高于滴鼻组;提示气溶胶感染方式更易快速引起肺部的感染并激活人的免疫系统。推测可能的原因是滴鼻方式感染时小鼠处于病理的麻醉状态,而气溶胶方式感染时小鼠处于清醒状态,因此病毒更容易进入肺内复制并引发体内的应答,且气溶胶方式完全模拟了流感病毒空气内的传播方式,在流感的预防感染研究方面具有优势。因此气溶胶感染方式建立的小鼠模型是更理想的流感预防和发病机制研究模型。同时气溶胶感染方式也存在缺陷,如目前并不是所有流感病毒都能够通过气溶胶传播,或即使能够在某种动物间表现出气溶胶传播特性的病毒在其它品种的易感宿主间可能不能传播[12]。因此对于一些不能用于气溶胶传播的病毒或动物感染研究时,可以选择滴鼻感染方式进行模型构建。
人类疾病模型的价值在于与人临床症状和病变程度的相似程度[13]。本文通过对气溶胶和滴鼻两种感染方式建立的模型进行了初步的研究比较,发现气溶胶感染方式建立的小鼠模型更适用于预防和发病机制研究,滴鼻方式建立的小鼠模型可用于不通过气溶胶传播的流感病毒研究。本文只是对目前与人类最相似的两种呼吸道感染方式建立的模型进行了初步研究,若想选择出更理想的小鼠流感模型及了解流感发病机制和预防,还需进一步的深入研究。

