基于RIP-Seq技术检测MRTF-A结合RNA在小鼠MCAO/R模型中表达
于志君,袁琼,金志刚,向梓非,龙萍,朱明,杨越旺,胡霞敏∗
(1.武汉科技大学医学院,新药创制研究所,职业危害识别与控制湖北省重点实验室,武汉 430065;2.华润武钢总医院,武汉 430080;3.上海健康医学院,上海 200030)
心肌素相关转录因子A(myocardin-relate transcription factor-A,MRTF-A)是血清反应因子(serum response factor,SRF)的转录共激活因子,广泛存在于大脑皮层、心脏、血管、胚胎及肿瘤组织中,参与包括阿尔茨海默病[1]、心脏缺血再灌注损伤[2]、动脉粥样硬化[3]、恶性肿瘤[4]等在内的多种病理生理过程。研究发现,MRTF-A主要定位于胞质,可通过与肌动蛋白结合与解离在细胞质和细胞核之间穿梭。外界刺激(如缺血、缺氧等)可引起胞质内 G-肌动蛋白与 MRTF-A解离,促进MRTF-A由胞质转移至胞核,入核的MRTF-A与SRF形成复合物后,结合靶基因启动子上的CC[A/T]6GG DNA序列,又称CArG盒,引起靶基因的转录激活,参与细胞增殖、分化、凋亡及信号转导等过程[5],从而对外界刺激产生快速基因反应。杨辉等[6]研究发现,在心肌缺血再灌注损伤时,上调心肌中MRTF-A表达,可促进Bcl-2、Mcl-1表达,抑制Bax表达,缩小心肌梗死面积,抑制心肌细胞凋亡,发挥心肌保护功能。本课题组前期研究也证实,在脑缺血再灌注(ischemic/reperfusion,I/R)诱导的大鼠模型及氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)诱导的细胞模型中,MRTF-A可通过SRF/CArG途径激活抗凋亡基因Mcl-1、Bcl-2转录发挥重要的神经保护作用[7]。
目前,关于MRTF-A机制的研究均基于对转录水平的调节,其可否通过结合RNA发挥其他生物功能目前尚不清楚。因此,为了深入了解MRTF-A在脑I/R损伤中的分子功能,本研究利用RIP-Seq技术对小鼠MCAO/R模型中MRTF-A结合RNA的表达谱进行深度测序,以挖掘差异基因,继而通过生物信息方法在分子功能、信号通路等方面进行探讨,为下一步实验研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
18只6~8周龄SPF级健康雄性C57BL/6小鼠,体重20~25 g,购自湖北省实验动物研究中心【SCXK(鄂)2015-0018】。小鼠饲养于武汉科技大学实验动物中心【SYXK(鄂)2018-0045】。饲养期间小鼠自由进食、饮水。饲养环境:昼夜各半循环照明,湿度恒定,温度在22~25℃。实验前将小鼠随机分为假手术组及I/R组(n=9),进行2,3,5-氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)染色、RNA结合蛋白免疫沉淀-高通量测序(RNA immunoprecipitation,RIP-Seq)及测序结果验证(n=3)。所有操作均符合武汉科技大学实验动物伦理学要求(审批号:201849)。
1.1.2 主要试剂与仪器
线栓购于广州佳灵生物有限公司;RIP试剂盒、IgG抗体购自Millipore公司;MRTF-A抗体购自CST公司,辣根过氧化物酶标记的羊抗兔/鼠二抗购自Santa Cruz公司;酚∶氯仿∶异戊醇=125∶24∶1(pH=4.3),购自索莱宝科技有限公司。
体式显微镜(Motic SMZ-140,麦克奥迪实业集团有限公司);荧光定量PCR仪(Bio-Rid CFX96,美国伯乐);旋转混匀器(SilentShake,美国CRYSTAL);恒温摇床(KYC-100B,上海福玛实验设备有限公司);测序仪器(Hiseq 2500,美国Illumina公司)。
1.2 方法
1.2.1 小鼠MCAO模型的建立
参照改良的Longa法[8]制备小鼠右侧局灶性MCAO模型。术前小鼠禁食8~10 h,自由饮水。腹腔麻醉,仰卧固定于37℃恒温手术台上。消毒颈部皮肤,体式显微镜下暴露右侧颈部总动脉(common carotid arter,CCA),颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)。 结扎ECA远心端后,切开ECA,插入线栓,使线栓经由CCA、ICA后入颅,直至大脑中动脉(middle cerebral artery,MCA),插入深度约 0.8~1 cm。待缺血 1 h后缓慢拔出线栓实现再灌注,24 h后处死小鼠,取样。假手术组只暴露相关血管而不插入线栓。
1.2.2 神经功能学评分
动物麻醉清醒后,采用Longa’s 5分法进行评分。0分:无神经损伤症状;1分:不能伸展左侧前爪;2分:提尾向左侧转;3分:向左侧倾倒;4分:不能自发行走,意识丧失。剔除0分及4分,选取1~3分的小鼠进行RIP-Seq。
1.2.3 TTC染色
在设备生产运行过程中,长期存在着过载工况,原有的系统在此工况下,会长时间出现电机温升过高,严重情况下甚至导致电机被动停机。新系统通过优化堵转保护功能,在检测到电机最大转矩工作转速降至200r/min后,电机主动停机,防止堵转发生,重新调整原料多少后,再重新启动运行,相比原系统的异步机人工拉闸动作,安全系数更高提高,避免了操作工人的紧张情绪,不再担心堵转发生,快速拉闸动作。
再灌注24 h后,每组随机选取3只小鼠,断头取脑进行梗死体积检测。新鲜脑组织-80℃速冻3 min后取出,以2 mm厚度做冠状切片,随后浸泡于1%TTC磷酸盐缓冲液中,37℃避光孵育15 min,期间将脑片上下翻转至少1次,使之染色均匀。TTC染剂可将正常脑组织染为深红色,梗死区脑组织染为白色。最后将脑片浸泡于4%多聚甲醛中,4℃固定过夜,拍片,计算脑梗死体积百分比。脑梗死体积百分比利用Image J图像分析软件对梗死体积进行量化,首先计算每片脑组织的梗死体积,每片脑片梗死体积=梗死面积 ×切片厚度,再求和算出总梗死体积,脑梗死体积百分比=总梗死体积/全脑体积 ×100%。
1.2.4 RIP实验
RIP实验所有试剂均需无酶处理。再灌注24 h后取患侧大脑半球组织(梗死区及非梗死区),用预冷的 PBS冲洗匀浆,制成单细胞悬液。4℃,1500 rpm离心5 min,弃上清,加入等体积裂解液冰上裂解5 min,-80℃保存备用。RIP实验具体操作按照Millipore公司RIP试剂盒操作说明进行。即每组50 μL 磁珠中,加入 MRTF-A/IgG 抗体5 μg,室温孵育1 h,获得磁珠抗体复合物。洗涤磁珠,900 μL RIP免疫共沉淀缓冲液中加入100 μL脑组织裂解液,4℃孵育过夜,蛋白酶K消化后酚∶氯仿∶异戊醇=125∶24∶1(pH=4.3)提取 RNA,待质检合格后进行高通量测序,验证样本则用于差异RNA表达qRT-PCR检测。
1.2.5 RNA高通量测序
样本(Sham MRTF-A-RIP组及I/R MRTF-ARIP组)委托广州市锐博生物科技有限公司,采用Illumina HiSeq TM2500测序方式进行。
1.2.6 测序数据分析
Illumina HiSeq TM2500测序所得50 nt序列(reads),通过初步过滤,得到干净序列。利用Tophat(v2.0.13)软件将其与参考基因组比对,挑选出比对reads进行全基因组分布、结合峰(Peak)检测、注释及相关统计分析,最后获得差异Peaks,并对差异基因进行GO和KEGG分析。基因表达采用RPKM法估算,用Zscore值表示某Peak在成对样本中的差异程度,以|Zscore|>2作为RNA差异性表达的筛选条件。
1.2.7 qRT-PCR验证基因表达
使用Thermo Scientific逆转录试剂对RIP纯化后的RNA样品进行逆转录,逆转录条件为:42℃60 min,70℃ 10 min,4℃,终止反应。 qRT-PCR 按照Yeasen试剂盒说明书进行扩增,反应条件为:95℃,2 min;95℃ 10 s,60℃ 20 s,72℃ 20 s,共40 个循环,反应结束后对所得数据进行处理,按2-ΔΔCt法计算基因的相对表达量。引物序列见表1。

表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequence
1.3 统计学分析
2 结果
2.1 成功构建小鼠脑I/R模型
小鼠MCAO模型成功构建是本实验的关键,因此我们采用神经功能缺陷评分和TTC染色对脑损伤程度进行评估,以确保测序样本符合脑I/R损伤。结果显示,I/R组均出现不同程度的神经损伤症状,评分为2.5±1.0,而假手术组无神经损伤症状(图1A)。每组随机选取3只小鼠行TTC染色,结果如图1B所示,假手术组脑组织染色正常,而I/R组呈现不同程度的梗死灶,梗死体积百分比为(28.42±7.73)%(图1C),以上结果提示,小鼠脑I/R模型构建成功。
2.2 MRTF-A结合RNA差异表达
本研究以|Zscore|>2作为筛选条件,共获得429个RNA差异结合峰,其中上调203个,下调226个;通过对 RNA类型分析发现 mRNA 384个,ncRNA 45个,其中长链非编码 RNA(lncRNA)24个。表2显示变化最显著的10个结合峰,具体为Gm33780、 LOC105245688、 Gm3871、 Rpph1、 Hic2、Olfr856-ps1、Gm32291、Jarid2、Gm10845、Malat1,其中lncRNA有7个,可见lncRNA在MRTF-A参与的脑I/R损伤中可能发挥重要作用。

图1 成功构建小鼠脑I/R模型Note.A.Neurological score.B.TTC staining.C.Percentage of cerebral infarction volume.Compared with sham group, ∗∗P < 0.01.Figure 1 Successful construction of mice cerebral I/R injury model
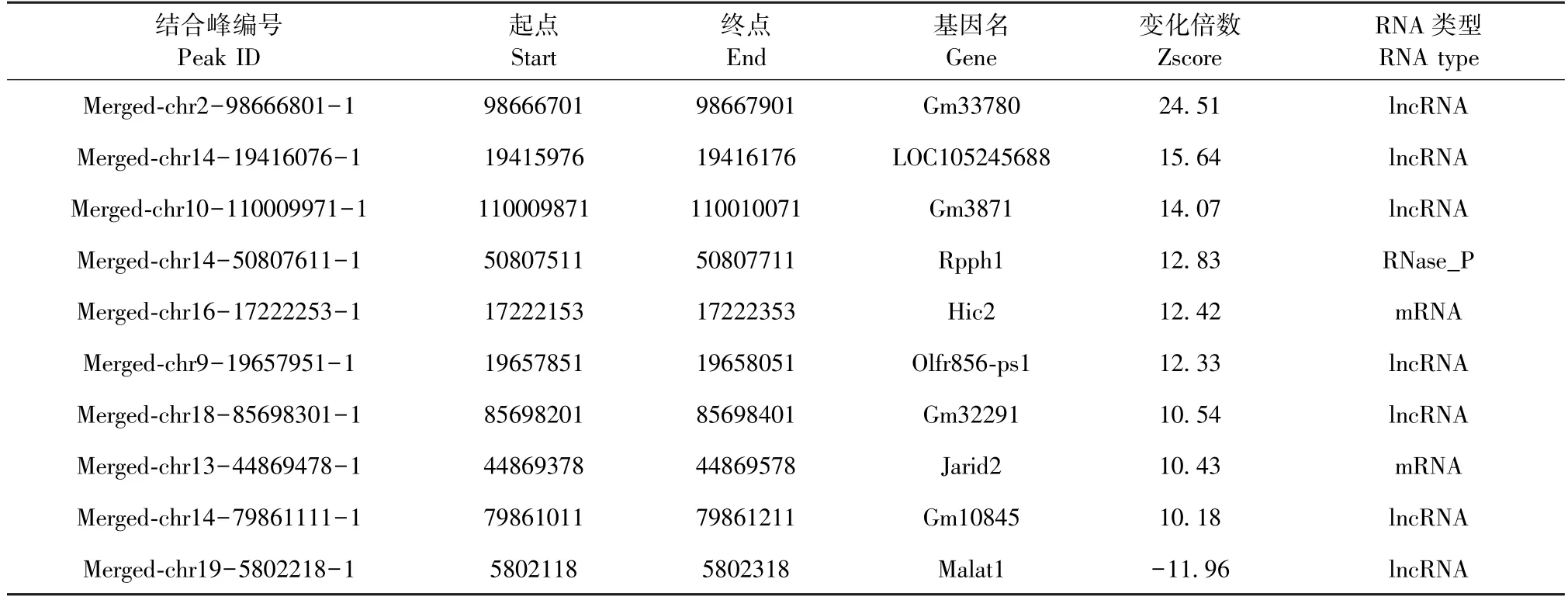
表2 10个最显著RNA差异结合峰Table 2 Ten most significant RNAs differential binding peaks
2.3 RNA差异结合峰在功能元件及染色体来源上的分布分析
通过分析RNA差异性结合峰在不同基因组功能元件上的分布,发现差异性结合峰主要分布于外显子(exon)、内含子(intron)及3’UTR区,分别为63.40%、14.69%及13.05%,其他8.86%分布于基因间区(Intergenic)、5’UTR区和宿主基因上游(upstream)序列,分别为 4.20%、4.20%和 0.47%(图2A)。染色体来源分析发现,大量差异性结合峰来源于4号及7号染色体(图2B)。其中4号染色体178个,约占总差异性结合峰的41.49%;7号染色体100个,占总差异性结合峰的23.31%,而6、11、17、X染色体未发现peak富集。以上结果提示,脑I/R后MRTF-A相关的RNA不仅在功能元件上分布不同,且与染色体来源关系密切。
2.4 RNA差异表达基因GO分析
对MRTF-A结合RNA差异性表达基因进行GO分析发现,差异基因在生物进程中主要富集RNA、mRNA的加工、拼接、代谢过程,细胞及骨架组成、微管解聚以及蛋白质复性等。在细胞组成方面,富集包括轴突、突触、神经元、神经元突触后密度、投射神经元等。在分子功能注释中主要富集与多种物质的结合功能,如与MHC的结合、钙结合素结合、脂蛋白受体结合等,其中富集最多的注释为RNA结合,共富集31个基因,而富集最为显著是Poly(A)RNA结合(表3,P<1.09×10-5)。结果提示,脑I/R损伤时MRTF-A可以通过募集特异性RNA,在RNA结合、Poly A RNA结合等方面发挥重要的生物功能。

图2 MRTF-A结合RNA差异结合峰分析Note.A.Distribution of RNAs differential binding peaks on functional elements.B.Chromosome source of RNAs differential binding peak.Figure 2 MRTF-A binding RNAs differential binding peak analysis
2.5 RNA差异表达基因KEGG通路分析
通过对MRTF-A结合RNA差异性表达基因进行KEGG信号通路分析显示,差异表达基因主要富集10条信号通路,分别是甲状腺激素合成、胃酸分泌、唾液分泌、雌激素信号通路、多巴胺能突触、谷氨酸突触、胰岛素分泌、安非他明成瘾、内质网蛋白加工及RNA转运。在10条显著富集的信号通路中,雌激素信号通路是富集最显著的信号通路(表4,P<6.09×10-4),共富集 6个基因,分别为Hsp90b1、Hspa8、Gabbr2、Hsp90aa1、Calm1、Atf2。 提示,在脑I/R损伤后,MRTF-A主要通过雌激素信号通路发挥神经保护功能。
2.6 qRT-PCR验证筛选基因的表达
为了验证测序结果及生物信息预测结果的可信度,本实验在差异表达前10的RNA中随机选取4 个基因(Gm33780、Gm3871、Hic2、Malat1)进行测序结果的验证;同时在KEGG预测富集最显著的雌激素信号通路中选取3个基因(Hsp90b1、Hspa8、Calm1)进行生物信息预测结果验证,结果发现MRTF-A抗体无论在假手术组还是I/R组均能富集到相应RNA表达(图3),且均发生差异性改变,其变化趋势与测序结果一致。

图3 差异RNA的qRT-PCR验证Note.Compared with sham group,∗P < 0.05,∗∗P < 0.01Figure 3 qRT-PCR verification of differential RNAs
3 讨论
MRTF-A是SRF转录共激活剂,主要通过核转位与SRF结合,促进SRF结合靶基因启动子上的CArG盒,激活靶基因转录,从而在转录水平发挥调节功能[5]。然而MRTF-A是否存在其他作用方式,目前尚未阐明。随着各种测序技术及生物信息学技术的发展,为探寻分子在不同水平的作用机制提供了技术支持。RNA结合蛋白免疫共沉淀-高通量测序技术(RIP-Seq)是研究细胞内RNA与蛋白结合及转录后调控网络动态过程的工具,能帮助发现蛋白-RNA复合体的相互作用。因此,为了深入了解MRTF-A在脑 I/R损伤中的作用方式,探寻与MRTF-A相关的潜在靶基因,我们采用RIP-Seq技术对比正常小鼠与脑I/R损伤小鼠脑组织中MRTF-A抗体结合RNA表达,以获得差异表达谱。

表3 GO分析中的分子功能注释Table 3 Annotation of molecular functions in GO analysis

表4 KEGG通路分析Table 4 KEGG signal pathway analysis
本研究结果显示,在脑 I/R损伤时,429个MRTF-A结合RNA呈现显著改变,其分类主要为mRNA,少量为ncRNA。在变化最显著的10个差异RNA中 lncRNA占 7/10,可见 lncRNA可能在MRTF-A参与的脑I/R损伤中发挥着不可忽视的调控作用。LncRNA是一类长度大于 200 nt的ncRNA,能够与DNA、RNA及蛋白质作用参与机体的各种生理病理过程[9]。研究发现,脑I/R损伤时存在大量lncRNA异常表达[10],它们通过影响细胞凋亡、炎症、自噬、血管生成等在疾病的进展及转归中发挥作用[11]。本研究获得多条已证实在脑卒中中发挥重要作用 lncRNA,如 Malat1、Meg3及Kcnq1ot1等[12-13],除此还筛选出多个尚未报道功能的 lncRNA,如 Gm33780、Gm32291、LOC105245688等。为了验证测序结果的可靠性,我们在差异表达最显著的10个RNA中选取4个进行qRT-PCR验证,其中包括lncRNA 3个。结果显示MRTF-A抗体可以富集这些RNA,同时在缺血性脑卒中后发生差异性改变,其变化趋势与测序结果一致,可见本次测序结果可靠,而这些RNA,尤其是lncRNA如何通过与MRTF-A结合发挥生物功能有待进一步研究。
为了深入了解MRTF-A在脑I/R损伤中的作用机制,我们采用生物信息学方法对差异表达基因进行了GO及KEGG分析。GO分析发现MRTF-A主要通过RNA结合、Poly(A)RNA结合发挥生物功能,于是推测 MRFT-A可能作为 RNA结合蛋白(RNA binding protein,RBP)及 Poly(A)结合蛋白(Poly(A)binding protein,PABP)参与脑I/R损伤病理进程。RBP是一类可与双链或单链RNA结合,在转录后水平发挥重要调节作用。人抗原R(HuR)是一种RBP,研究发现,缺血性脑中风时,HuR可正性调节炎症相关基因 TNF-α,IL-6,IL-1β的mRNA稳定和翻译效率,参与脑损伤过程[14]。同样,存在于胞浆中PABP,可通过RNA识别基序与真核mRNA的3’Poly(A)尾结合,发挥 mRNA成熟、输出及稳定功能[15]。本实验中检测出多个与mRNA成熟、稳定密切相关的差异基因,如Eef1a1、Eif5b等。内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)是心血管系统的重要保护因子,可调节一氧化氮的产生,与缺血性脑卒中发生密切相关[16],研究发现Eef1a1可通过维持eNOS mRNA稳定,上调其表达,保护脑血管内皮免受脑缺血损伤[17]。而Eif5b在脑I/R损伤中目前尚无报道,但研究指出,正常非必需的Eif5b在缺氧条件下是缺氧诱导因子(hypoxia-inducible factor,HIF)1α和2α合成机制的重要组成部分,它们的转录和翻译表现出显著的 Eif5b依赖性[18]。因此,推断MRTF-A可通过与这些基因结合发挥生物学功能。KEGG信号通路分析发现,雌激素信号通路是富集最为显著通路。研究证实雌激素通路在脑I/R损伤中发挥重要作用,雌性动物脑缺血后神经元损伤弱于雄性动物,且随着生殖衰老或内源性雌激素释放停止而消失[19],雌激素缺乏小鼠在脑I/R后长期给予雌激素受体激动剂可通过抑制炎症减轻脑损伤[20]。为了进一步证实生物信息学预测结果,本实验在雌激素信号通路预测富集的6个差异表达基因中随机选取3个进行验证,结果发现,MRTF-A可以富集这些mRNA,并且在缺血性脑卒中后发生差异性改变,其改变趋势与测序趋势一致。因此,我们推测在脑I/R损伤时MRTF-A可结合差异表达RNA通过雌激素信号通路发挥作用。研究报道lncRNA可通过雌激素通路在肿瘤增殖、转移等过程中发挥重要作用[21],lncRNA Malat1在乳腺癌肿瘤中的表达改变与雌激素通路及其靶基因差异表达密切相关,且与不良预后相关[22]。然而在缺血性脑卒中研究中,尚未发现lncRNA通过雌激素通路发挥相关功能。因此,lncRNA通过雌激素信号通路在脑缺血神经损伤中发挥作用,还需要进一步深入研究。
综上,本研究通过 RIP-Seq技术获得小鼠MCAO/R模型中与MRTF-A相关的潜在靶基因,通过生物信息学分析推断MRTF-A可能作为RBP或PABP通过雌激素信号通路等发挥生物学功能,从而为深入了解MRTF-A作用机制提供了理论基础,为探讨其在脑I/R损伤中的新机制提供研究方向,课题组将在下步实验中进行深入研究。

