miR-328在运动改善高血压大鼠胸主动脉L型钙通道表达中的作用
邱方,周杨,张严焱,金城,刘晓东,吴迎,2,吕媛媛,石丽君,2∗
(1.北京体育大学运动生理教研室,北京 100084;2.北京体育大学运动与体质健康教育部重点实验室,北京 100084;3.北京体育大学中国运动与健康研究院,北京 100084)
据世界卫生组织最新的卫生统计数据,高血压是一个主要的公共卫生问题,影响到25岁及以上40%的成年人,其发病率和死亡率很高。长期高血压时,全身动脉系统受血管内高压力的影响会产生病变,导致血管结构和功能的改变。在高血压病理过程中,大动脉长期承受高应力的影响,导致血管顺应性下降,是心血管功能异常的主要原因。血管平滑肌细胞(vascular smooth muscle cell,VSMC)是构成血管壁结构和功能的主要成分,L型电压门控钙通道(voltage-gated L-type Ca2+channel,LTCC)是存在于VSMC膜上的一种主要钙通道,控制外钙内流,是VSMC收缩的结构基础,在调节血管张力和血压中起重要作用[1]。LTCC由成孔 α1C和辅助 β、α2δ和γ亚基组成,它们共同调节通道功能[2]。其中α1C亚基是LTCC的门控装置和Ca2+的渗透孔道,作为支架蛋白,β亚基可以定位和整合细胞内信号以影响LTCC门控特性。研究证实,VSMC中LTCC的上调是高血压的一个标志性特征,且细胞膜中LTCC蛋白表达量与体内血压水平呈正相关[3],但其潜在的机制尚不清楚。有研究发现,与正常血压大鼠(Wistar Kyoto,WKY)相比,自发性高血压大鼠(Spontaneously hypertensive rat,SHR)肠系膜动脉LTCC转录水平略高,但其蛋白水平高3.4倍[4]。在猪肺动脉高压模型中,肺动脉LTCC蛋白表达显著升高,但转录水平没有变化[5]。因此,转录后调控可能在LTCC表达中发挥更重要的作用。
MicroRNA(miRNA,miR)是一种短的非编码RNA片段,通过靶向mRNA在转录后调控基因和蛋白质的表达[6]。miRNAs的失调可能导致疾病的发展,因参与多种细胞功能,例如增殖、迁移和凋亡。多篇综述报道miRNA在高血压的病理生理过程中发挥重要作用[6-7]。近期研究发现miRNA可能是LTCC转录后水平的一种调控机制,miR-1、miR-145和miR-328直接靶向或调节VSMC中LTCC的功能[8-9]。在血管和心肌细胞中检测发现,miR-328对LTCC α1C亚基基因(CACNA1C) 和 β1亚基基因(CACNB1)有靶向作用,该研究发现miR-328可以抑制缺氧性肺动脉高压LTCC的表达,miR-328的过表达可以降低右心室收缩压和肺动脉壁厚度[10-11]。
长期规律运动是预防和控制高血压推荐的非药物疗法。我们前期研究发现,有氧运动可逆转高血压血管平滑肌LTCC结构和功能重构,改善血管功能,调控血压水平[12-14],但运动调控血管平滑肌离子通道功能的潜在机制仍不清楚。规律有氧运动作为一种环境表观遗传调制器,可通过DNA甲基化、组蛋白修饰和miRNA等表观遗传修饰,调控心血管相关基因表达,进而改善心血管结构和功能[15-16]。miRNA作为表观调控的重要组成部分在心血管系统中高度表达,参与调节VSMC离子通道功能[11]。规律有氧运动作为一种良性刺激,在逆转高血压LTCC重构过程中,miR-328是否参与其中,目前尚不清楚。因此,本研究通过建立有氧运动模型,观察有氧运动对正常血压大鼠和高血压大鼠胸主动脉中LTCC亚基和miR-328的表达影响,并探讨miR-328在其中的调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级12周龄雄性正常血压大鼠WKY和自发性高血压大鼠SHR各24只,WKY体重约270 g、SHR体重约245 g,购于北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】,饲养于北京体育大学动物实验室【SYXK(京)2016-0033】。大鼠自由饮水进食,温度 22~24℃,相对湿度 40%~60%,所有实验方案获得北京体育大学运动科学实验室伦理委员会批准(IACUC 2017003A)。
1.1.2 主要试剂与仪器
戊巴比妥钠、去甲肾上腺素(Norepinephrine,NE)和硝苯地平(Nifedipine)均购买于sigma公司,Rabbit polyclonalanti-α1C(Alomone Laboratories,Israel),Anti-β1(Sigma,USA),GAPDH(Santa Cruz Biotechnology,USA),Rabbit Polyclonal to α-SM-actin(Abcam,UK),BCA 试剂盒(Pierce,USA),miRcute miRNA提取分离试剂盒(Tiangen,China),RevertAid First Strand cDNA Synthesis Kit(Thermo Scientific,USA),Alexa Fluor488 goat anti-rabbit IgG antibody(Life Technologies,USA),Lipofectamine RNAiMAX试剂(Invitrogen,USA),DMEM 培养基、HBSS缓冲液、胎牛血清、双抗Penicillin/streptomycin均购买于Gibco公司。
实验仪器包括智能无创血压仪(BP-2010A,Softron Biotechnology,中国),PowerLab 系统(PL3504,AD Instruments,Australia),离体微血管环张力测定系统(620 M,Danish Myo Technology,Denmark),PCR 仪(ABI,USA),荧光定量 PCR 仪(ABI,USA),Chemi DOC XRS+ 成像系统(Bio-Rad,USA),CO2细胞培养箱(Thermo,USA),倒置生物显微镜(IX71-F22PH,Olympus,Japan),Leica SP8 TCS激光共聚焦系统(Leica,Germany)。
1.2 方法
1.2.1 大鼠分组和有氧运动模型建立
WKY和SHR随机分为安静对照组(WKY-C,SHR-C)和有氧运动组(WKY-EX,SHR-EX),每组各12只。运动组大鼠先进行1周的适应训练,之后进行12周中等强度的跑台运动,坡度0°,每周5 d,每天 1 h,速度为 20 m/min,相当于 55% ~ 65%V·O2max。WKY-C和SHR-C作为对照组不做运动干预。
1.2.2 大鼠尾动脉无创血压监测
大鼠清醒、安静时的血压和心率(heart rate,HR)采用鼠尾动脉智能无创血压仪(BP-2010A)测量。
1.2.3 大鼠心血管反应测定
各组大鼠于12周有氧运动后,各选取6只,进行股动静脉置管术测定大鼠心血管反应。大鼠腹腔注射戊巴比妥钠(50 mg/kg)麻醉,分别于股动脉和股静脉的近心端(2根线)和远心端(1根线)穿线,用动脉夹夹住血管近心端,于远心端结扎部位前剪一小口,将导管沿着血管行走方向插入管腔,之后固定导管,注射50 IU/mL的肝素钠0.5 mL左右进行封管。术后24 h大鼠恢复良好,在清醒安静状态下测试,通过PowerLab系统连接股动脉插管外侧头,记录大鼠基础血压。之后在大鼠股静脉分别注射去甲肾上腺素(Norepinephrine,NE,18 μg/kg)和LTCC阻断剂硝苯地平(Nifedipine,1 mg/kg),观察大鼠血压变化,每种药物的注射间隔时间在5 h以上,以保证血压恢复正常水平。
1.2.4 HE染色
取大鼠胸主动脉,剥离周边组织后进行固定,经梯度乙醇二甲苯脱水后溶于石蜡,切片脱蜡后用苏木素和伊红染色,乙醇二甲苯处理后封片并拍摄,用Image J软件进行测量。每个样本组织切片随机5个视野,每个视野测量3次并取平均值,将5个视野的平均值作为胸主动脉壁厚。
1.2.5 免疫蛋白印迹
大鼠胸主动脉低温下与裂解液混匀,离心后取上清液测定蛋白浓度。用SDS-PAGE电泳分离等量蛋白质(约50 μg)并转至 PVDF膜上,用5%BSA封闭。 加入一抗 Rabbit polyclonal anti-α1C(1∶200),Anti-β1(1 ∶200)和 GAPDH(1 ∶500)4℃孵育过夜。第2天加入二抗室温孵育1 h,滴加ECL发光液到PVDF膜上,放入Chemi DOC XRS+成像系统显影。
1.2.6 Real time PCR
LTCC α1C和β1亚基 mRNA测定,取胸主动脉的总RNA进行常规的Real time PCR。miR-328测定采用miRcute miRNA提取分离试剂盒提取胸主动脉的 miRNA;采用 RevertAid First Strand cDNA Synthesis Kit,以U6为内参基因,使用miR-328含特异茎环结构的引物[9]进行反转录反应;cDNA扩增采用Power SYBR Green PCR Master Mix进行反应。 LTCC α1C亚基(CACNA1C) 和 LTCC β1亚基(CACNB1)以GAPDH为内参照,miR-328以 U6为内参照。所有PCR反应均重复进行,采用2-△△Ct法进行评估,分析目的基因的相对表达。扩增引物由上海吉玛公司合成,序列如下(表1):

表1 RT-PCR引物序列Table 1 RT-PCR primers sequences
1.2.7 VSMC原代与传代培养
取12周龄健康雄性WKY,麻醉后,无菌条件下取出大鼠胸主动脉,浸于HBSS溶液中,剥离干净动脉周围的脂肪组织,并将动脉内血液排除,呈白色;在胶原酶培养皿中,37℃孵育大鼠动脉约45 min,剥离动脉外膜,并去除内皮;转移至弹性蛋白酶培养皿中,把动脉剪成细小碎片(1 mm×1 mm),37℃孵育30~35 min,用巴氏吸管进行反复吹打使组织碎片消失;1800 rpm离心10 min,丢弃上清液,将原代VSMC用含10%胎牛血清和1%双抗的DMEM培养液培养,放入37℃和5%CO2培养箱中培养细胞。当培养皿中VSMC密度达80%~90%时,加入胰酶进行消化并传代;VSMC传至5~7代且细胞密度达60%~80%时进行转染。使用平滑肌特异性肌动蛋白α-actin鉴定VSMC,纯度要达90%~95%方可进行后续转染实验。
1.2.8 VSMC免疫荧光染色
吸走培养皿中的培养基,VSMC于4%的多聚甲醛固定30 min;用0.2%Triton X-100对细胞进行膜穿孔孵育15 min,PBS清洗3次;用5%BSA孵育60 min,封闭非特异性结合抗体部位;滴加一抗Rabbit Polyclonal to α-SM-actin(1∶200),4℃过夜孵育,PBS清洗3次;滴加二抗Alexa Fluor488 goat anti-rabbit IgG antibody(1∶1000),对细胞孵育 60 min,PBS 漂洗后滴加封片剂以盖玻片封片。在24 h后激光共聚焦成像系统进行信号捕捉与成像。
1.2.9 脂质体转染
取生长状态良好的VSMC,将细胞随机分为三组miR-328 mimic组、miR-328 inhibitor组和空脂质体 negative control(NC)组,采用 Lipofectamine RNAiMAX试剂将各miR-328干扰序列转染进VSMC(表 2)。 于转染后 24、48、72、96 h 收集 VSMC进行蛋白指标检测,于转染后12、24、48、72 h收集VSMC进行mRNA定量。
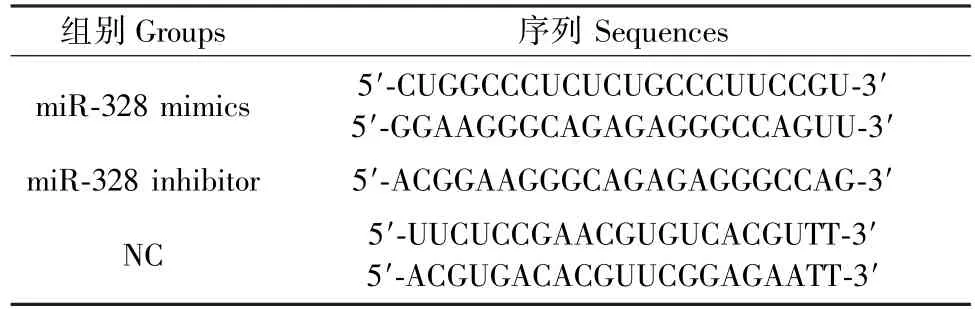
表2 各组miRNA干扰序列Table 2 miRNA interference sequence
1.3 统计学分析
2 结果
2.1 有氧运动对高血压大鼠体重、血压和心率的影响
各组大鼠于运动干预前(12周龄)和12周有氧运动干预后(24周龄)采用尾动脉无创血压仪测量大鼠血压和心率。运动前SHR-C组体重显著低于WKY-C组(P<0.05),而 SHR-C组的收缩压(systolic blood pressure,SBP)、舒张压 (diastolic blood pressure,DBP)和HR显著高于WKY-C组(P<0.01)。WKY-EX组和 SHR-EX组体重、SBP、DBP和HR与各自对照组相比均无显著差异(图1)。
12周有氧运动后,WKY-EX组和SHR-EX组体重均显著低于各自对照组(P<0.05),SHR-C组体重仍显著低于WKY-C组(P<0.05)。WKY-EX组SBP显著低于WKY-C组(P<0.05);SHR-C组SBP、DBP和HR显著性高于WKY-C组,而SHR-EX组SBP、DBP和HR显著低于SHR-C组(P<0.01)(图1)。
2.2 有氧运动对各组大鼠胸主动脉形态学的影响
HE染色观察各组大鼠胸主动脉壁厚变化(图2)。WKY-C组和WKY-EX组大鼠胸主动脉壁厚无明显差异,与WKY-C组相比,SHR-C组胸主动脉管壁明显增厚(P<0.01);SHR-EX组胸主动脉壁厚显著小于SHR-C组(P<0.05)。

图1 有氧运动对WKY和SHR体重、血压和心率的影响(n=12)Note.Compared with group WKY-C,∗P < 0.05,∗∗P < 0.01.Compared with groupSHR-C,#P < 0.05,##P < 0.01.(The same in the next figures)Figure 1 Effects of aerobic exercise on body weight, blood pressure and heart rate of WKY and SHR(n=12)

图2 有氧运动对各组大鼠胸主动脉壁厚的影响(n=6)Note.A.Histological structure of the thoracic aorta(HE staining, ×400.Bar=50 μm).B.Statistical histogram of thoracic aortic wall thickness.Figure 2 Effects of aerobic exercise on the thickness of thoracic aortic aorta of rats(n=6)
2.3 有氧运动对各组大鼠心血管反应的影响
各组大鼠于12周有氧运动后,采用股动静脉置管术监测大鼠的心血管反应。在体股静脉注射NE(18 μg/kg)后,四组大鼠血压均显著增加;与WKYC组相比,SHR-C组注射NE后平均动脉压(mean arterial pressure,MAP)升高幅度(△MAP)显著增加(P<0.05);与SHR-C组相比,SHR-EX组注射NE后△MAP显著下降(P<0.05)(图3A、3C)。
股静脉注射Nifedipine(1 mg/kg)后,四组大鼠血压明显下降;SHR-C组大鼠MAP下降幅度最明显,且显著高于WKY-C组的下降幅度(P<0.05);与SHR-C组相比,SHR-EX组大鼠MAP降低幅度明显减少(P<0.05);WKY-C组与 WKY-EX组 MAP降低幅度无明显差异(图3B、3D)。

图3 有氧运动对各组大鼠心血管反应的影响(n=6)Figure 3 Effects of aerobic exercise on cardiovascular response of rats(n=6)
2.4 有氧运动对高血压大鼠胸主动脉LTCC α1C和β1亚基mRNA和蛋白表达的影响
qPCR检测各组胸主动脉中LTCC α1C和β1亚基与相应的GAPDH的mRNA相对表达值(图4A、4B)。 SHR-C组LTCC α1C和β1的mRNA的表达量明显高于WKY-C组(P<0.01)。经12周有氧运动后,WKY-EX 组和 SHR-EX 组的 LTCC α1C和 β1的mRNA表达量都呈现下降趋势,但与各自对照组相比较,SHR-EX的表达量显著性下调(P<0.01),而WKY-EX组表达量无显著性差异。
Western Blot检测各组胸主动脉LTCC α1C和β1亚基与相应的GAPDH的蛋白相对表达值(图4B、4D)。与 WKY-C组相比,SHR-C组胸主动脉中LTCC α1C和β1表达显著上调(P< 0.01)。 与 SHRC组相比,SHR-EX组的LTCC α1C蛋白表达呈显著性下调(P<0.05),LTCC β1蛋白表达呈非常显著性下调(P<0.01)。WKY-EX组中α1C蛋白表达相比于WKY-C组也有所下降,但表达不明显。
2.5 有氧运动促进高血压大鼠胸主动脉中miR-328表达增加
运动对各组胸主动脉中miR-328与相应的U6相对表达值(图5)。与WKY-C相比,SHR-C组中miR-328的表达呈现显著性降低(P<0.01)。通过12周有氧运动后,与各自对照组相比,SHR-EX组中miR-328表达明显升高(P<0.05),WKY-EX组无显著性差异(图5)。

图4 各组大鼠胸主动脉LTCC α1C和β1亚基mRNA和蛋白表达(n=6)Figure 4 The mRNA and protein expression of LTCC α1Cand β1 subunits in thoracic aorta from four groups(n = 6)
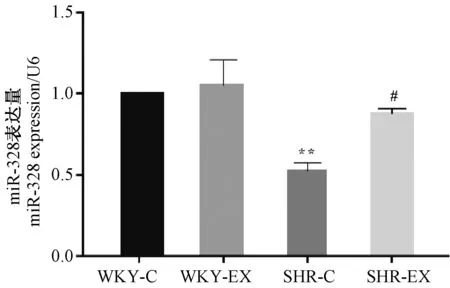
图5 各组大鼠胸主动脉miR-328表达(n=6)Figure 5 Expression of miR-328 normalized to U6 in rat thoracic aorta(n=6)
2.6 miR-328 靶向调控 LTCC α1C和 β1亚基mRNA和蛋白表达
2.6.1 VSMC鉴定
如图6所示,大鼠VSMC原代提取、培养并传代,用平滑肌特异性肌动蛋白α-actin免疫荧光染色进行鉴定,通过激光共聚焦显微镜拍摄发现,VSMC骨架蛋白α-actin清晰可见,细胞质内存在大量红色的细丝,表明培养的细胞为VSMC。
2.6.2 miR-328对LTCC α1C亚基mRNA和蛋白表达量的影响
离体转染 12、24、48、72 h 后检测 VCSMs内LTCC α1C亚基 mRNA 表达,qPCR 结果如图 7A,与相同时间段的NC组相比,α1CmRNA表达在瞬时转染miR-328 mimic组24 h出现下降趋势(P>0.05),48 h表达呈显著性降低(P<0.01);转染miR-328 inhibitor组的α1CmRNA表达量在24 h(P<0.01)和48 h(P<0.05)呈显著性上调。
离体转染24、48、72、96 h 后检测 VCSMs内 LTCC α1C亚基蛋白表达,Western Blot结果如图 7B、7C,与同时间段NC组相比,转染miR-328 mimic组的α1C蛋白表达量在48 h(P<0.05)和72 h(P<0.01)蛋白表达量显著降低,而miR-328 inhibitor组中α1C的蛋白表达量在48 h(P<0.01)和72 h(P<0.05)显著上调。由此可见,miR-328对体外培养的 VSMC的LTCC α1C亚基有明显的抑制作用。
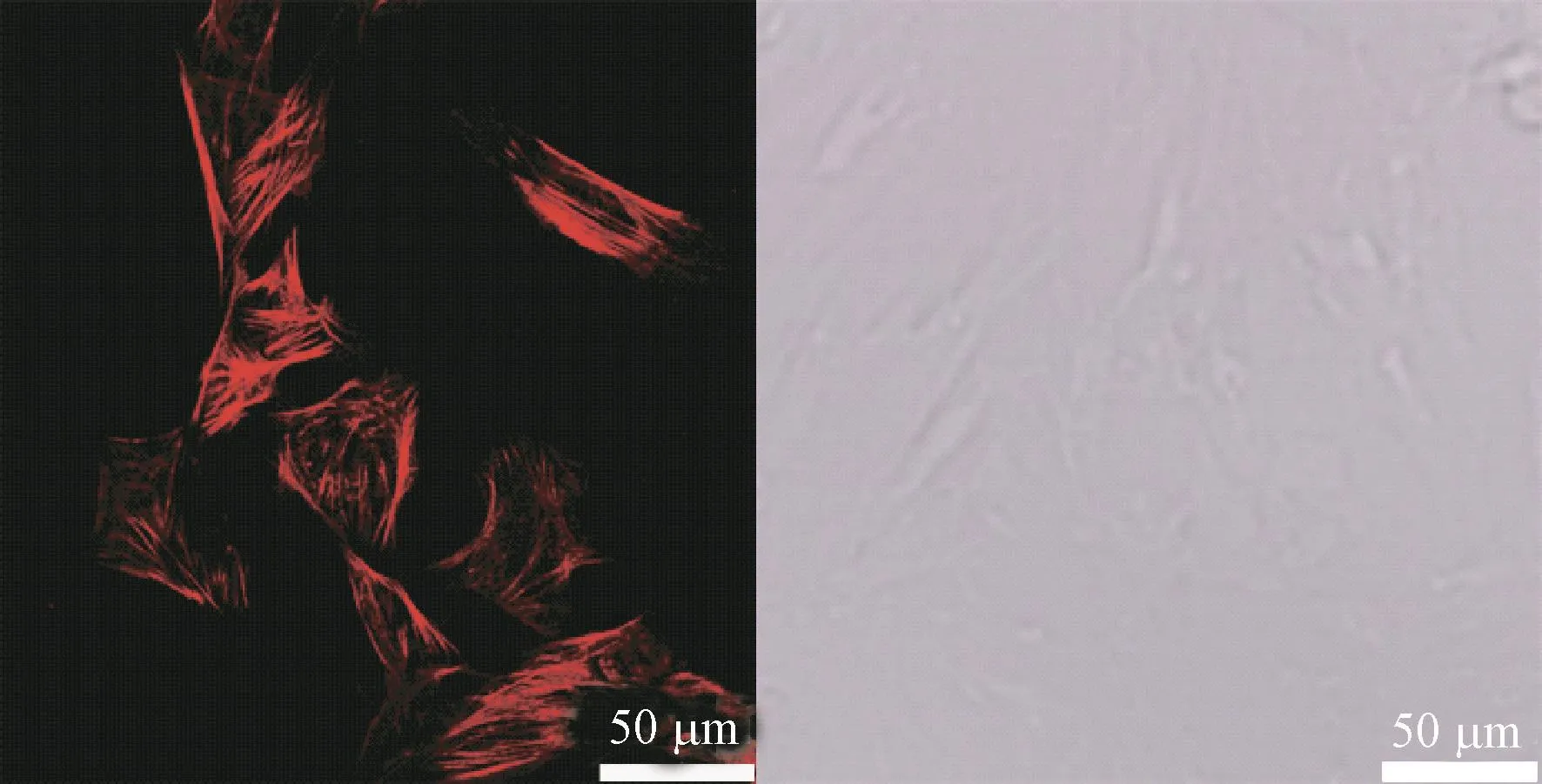
图6 平滑肌特异性肌动蛋白α-actin免疫荧光标记的VSMC代表图Figure 6 Representative immunofluorescence images of VSMC stained with α-SM-actin
2.6.3 miR-328对LTCC β1亚基mRNA和蛋白表达量的影响
离体转染 12、24、48、72 h 后检测 VCSMs内LTCC β1亚基mRNA表达,qPCR结果显示如图7D,与相同时间段NC组相比,转染miR-328 mimic组的β1mRNA表达在24 h显著下调(P<0.05),而转染miR-328 inhibitor组的β1mRNA的表达量在24 h(P< 0.05)、48 h(P< 0.01)和72 h(P< 0.05)呈显著性上调。
离体转染 24、48、72、96 h 后检测 VCSMs内LTCC β1亚基蛋白表达,Western Blot结果如图7B、7E,与同时间段NC组相比,转染miR-328 mimic组的β1蛋白表达在48 h(P< 0.01)和72 h(P<0.05)呈显著性下调,而转染miR-328 inhibitor组中 β1的蛋白表达 48 h(P<0.01)和 72 h(P<0.05)呈显著性上调。由此可见,miR-328对体外培养的 VSMC的 LTCC β1亚基有明显的抑制作用。
3 讨论
本文研究了12周规律有氧运动对SHR胸主动脉LTCC表达的影响,并探讨了miR-328在其中的靶向作用。结果表明,与WKY-C组相比,SHR-C胸主动脉miR-328表达下调,LTCC α1C和β1亚基的表达上调;12周有氧运动后可增加SHR胸主动脉miR-328表达,靶向抑制 LTCC α1C和 β1亚基的表达,从而有效降低SHR血压。
胸主动脉作为人体最大的弹性血管,在维持整个心动周期中动脉血压的相对稳定起重要作用。因此,我们选取胸主动脉作为研究对象。研究表明,高血压的发生、发展与血管结构和功能变化密切相关,主要表现为血管内皮细胞功能障碍,血管平滑肌细胞增生,血管壁增厚,管腔狭窄,血管顺应性下降,导致血压增加[17]。有氧运动可有效降低高血压大鼠的血压和心率作用涉及多种机制[18]。如长期运动导致心脏和动脉结构及功能发生适应性变化,心交感神经减弱,迷走张力增高,主动脉及大动脉血管顺应性变大,外周血管阻力减弱,内皮功能改善等,从而降低心率和血压[19]。本研究SHR-C组胸主动脉的管壁厚度明显高于 WKY-C组,而SHR-EX组胸主动脉壁厚明显低于SHR-C组,说明12周有氧运动可以明显改善高血压大鼠血管壁厚的现象。

图7 VSMC转染miR-328 mimic或inhibitor后LTCC α1C和β1亚基mRNA和蛋白表达(n=6)Figure 7 The mRNA and protein expression of LTCC α1Cand β1subunits after transfection with miR-328 mimic or inhibitor in VSMC(n = 6)
LTCC是VSMC上的一种Ca2+通道,有两个主要亚基 α1C和 β1,α1C主要控制细胞外的钙离子内流,β1则负责α1C生理功能的激活,二者共同作用参与LTCC功能的多样性[20]。研究证明,血管LTCC亚单位组成是动脉张力和血压水平的决定因素[21]。LTCC表达和功能异常会导致肌源性张力和血压的异常变化,VSMC中LTCC上调是高血压的一个特异性标志[22]。为了研究LTCC功能在血压调控中的作用,我们通过在体静脉注射NE和Nifedipine(LTCC特异性阻断剂),结果发现运动可明显降低高血压大鼠对NE的升压反应和Nifedipine的降压反应。说明高血压大鼠LTCC功能显著上调,而有氧运动后可显著降低LTCC在调控血压中的功能亢奋。高血压血管平滑肌LTCC表达的增多被认为是其功能上调的原因。高血压模型VSMC膜上LTCC表达增加,胞外 Ca2+内流增加,从而引起血管收缩[23]。本研究Western Blot和qPCR检测结果亦表明,高血压大鼠胸主动脉中 LTCC α1C和 β1亚基mRNA和蛋白表达显著高于正常血压大鼠,而经12周有氧运动后高血压大鼠的 LTCC α1C和 β1亚基mRNA和蛋白表达明显降低。运动后LTCC表达降低可导致LTCC功能下调,这可能是导致血管功能改善的因素之一。
表观遗传学是指在没有改变基因序列的情况下发生的基因表达的变化,表观遗传修饰主要包括DNA甲基化、组蛋白质修饰和非编码miRNA[24]。已证实miRNA在高血压血管重构中具有重要作用,可调控VSMC的增殖、分化、凋亡和表型转换,为心血管疾病提供新的治疗靶点[25]。miRNA作为重要的表观调控机制之一,很多研究表明,规律运动可以通过表观遗传调控改善高血压[26-27]。有氧运动可使SHR主动脉中miR-27a和miR-155上调,miR-143下调,改善肾素-血管紧张素系统平衡,进而减弱胸主动脉重构和血压[28]。Liao等[29]发现在运动干预过程中,miR-145上调可能参与了高血压动脉VSMC从去分化表型向收缩表型的转变,从而改善血压。在本研究中,SHR-C组胸主动脉miR-328的表达显著低于WKY-C组,而SHR-EX组胸主动脉miR-328表达显著高于SHR-C组。说明miR-328的表达与LTCC α1C和β1亚基mRNA和蛋白表达呈高度负相关,有氧运动可诱导高血压大鼠胸主动脉miR-328升高,靶向抑制LTCC亚基表达从而降低血压。研究发现肺动脉高压时,miR-328可以抑制LTCC α1C亚基的表达,减弱肺动脉重塑[11]。Lu等[10]在小鼠心肌细胞培养过程中发现,敲除miR-328导致α1C和β1蛋白表达的增高。为了进一步验证miR-328对胸主动脉VSMC LTCC α1C和 β1亚基表达的负调控作用。我们进行了胸主动脉VSMC体外培养,脂质体转染 miR-328 mimic,miR-328 inhibitor使之过表达或沉默,也证实miR-328可靶向抑制LTCC α1C及β1亚基mRNA和蛋白表达。
有氧运动可通过调节miRNA的水平,调控心血管相关基因及蛋白表达,进而起到保护心血管作用。本研究通过股动静脉置管术、HE染色、qPCR、Western Blot、细胞培养和转染等技术,从心血管反应、动脉形态结构、LTCC及miR-328表达,证明了规律有氧运动可有效降低SHR血压,调控miR-328在转录后靶向抑制LTCC α1C和β1亚基的表达,提示miR-328可能是运动改善高血压胸主动脉LTCC重构的机制之一,为运动促进心血管健康提供了理论依据。

