T2-T2 FLAIR不匹配征象联合扩散和灌注加权成像预测WHO Ⅱ~Ⅲ级星形细胞瘤IDH突变状态
杨谢锋,邢振,曹代荣,苏妍,陈德华
福建医科大学附属第一医院影像科,福建福州 350005;
胶质瘤是最常见的原发性中枢神经系统肿瘤,在2016 版WHO 中枢神经系统肿瘤分类中,依据异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因突变状态,将星形细胞瘤分为IDH野生型、IDH突变型和非特指3 类[1]。IDH基因是影响胶质瘤预后的重要因素,IDH突变型胶质瘤对放化疗更加敏感,且生存期更长[2]。因此,术前无创性地预测IDH基因突变状态,对胶质瘤患者临床治疗方案的制订及预后评估具有重要意义。目前,MRI 是诊断胶质瘤最常用的影像学检查。扩散加权成像(DWI)和灌注加权成像(perfusion weighted imaging,PWI)作为非侵入性检查,已经广泛应用于胶质瘤分级、基因亚型分类及识别早期恶性转变等[3];同时,T2-T2 FLAIR 不匹配征象也用于鉴别胶质瘤不同基因型[4];但联合T2-T2 FLAIR 不匹配征象、DWI 及PWI 鉴别WHO Ⅱ~Ⅲ级星形细胞瘤的IDH突变状态鲜有报道。本研究拟探讨联合T2-T2 FLAIR 不匹配征象、DWI 和PWI 预测WHO Ⅱ~Ⅲ级星形细胞瘤IDH突变状态的诊断价值。
1 资料与方法
1.1 研究对象 收集2013年7月—2018年6月于福建医科大学附属第一医院经手术和病理证实的WHOⅡ~Ⅲ级星形细胞瘤84 例,其中男51 例,女33 例;年龄12~72 岁,平均(44±15)岁。纳入标准:①具有完整的常规MRI、DWI 和PWI 资料;②经组织病理检查证实为WHO Ⅱ~Ⅲ级星形细胞瘤,且明确IDH基因突变情况;③MRI 检查前未接受任何治疗。排除标准:①病理结果不明确;②图像存在运动伪影等,无法进一步分析者。本研究经福建医科大学附属第一医院医学伦理委员会批准(批号闽医大附一伦理医技审【2015】084 号)。
1.2 MRI 检查 采用Siemens Verio 和SKYRA 3.0T MR 扫描仪。常规MRI 扫描序列包括:轴位T1WI(TR 250 ms,TE 2.48 ms)、T2WI(TR 6000 ms,TE 96 ms),T2 FLAIR(TR 9000 ms,TE 94 ms)。DWI 采用SEEPI 成像序列(TR 8200 ms,TE 102 ms),视野(FOV)220 mm×220 mm,层厚5 mm,层间隔1 mm。PWI 采用GRE-EPI 成像序列,采用高压注射器注射,对比剂采用钆贝葡胺,用量0.1 mmol/kg,注射速度3~5 ml/s,然后以相同流速注射生理盐水20 ml。成像参数:TR 1500 ms,TE 30 ms,FOV 220 mm×220 mm,层厚5 mm,层间隔1 mm。
1.3 T2-T2 FLAIR 不匹配征象分析 由1 名具有5年工作经验的住院医师和1 名具有12年工作经验的主治医师采用盲法分析,意见不一致时协商解决。分析肿瘤的T2-T2 FLAIR 不匹配征象,定义为T2WI 呈均匀高信号、T2 FLAIR 呈相对低信号仅边缘呈环形高信号。
1.4 DWI 图像后处理 利用DWI 数据产生的表观扩散系数(ADC)图,将4~5 个感兴趣区(ROI)放置于肿瘤实性成分扩散受限最明显处,获得肿瘤的最小ADC 值(ADCmin)。ROI 20~40 mm2,尽可能避开肿瘤囊变、出血、坏死等区域。将5 个ROI 置于病灶对侧正常脑白质区,测量5 个ADC 值,取平均值,计算肿瘤区与对侧正常脑白质区ADC 的比值,获得相对ADCmin(rADCmin)。
1.5 PWI 图像后处理 PWI 原始图由采用Siemens Syngo MR B19 工作站的Perfusion MR 软件进行后处理,重建脑血容量(cerebral blood volume,CBV)伪彩图。选择肿瘤实性成分灌注最大层面将5 个ROI 放置于CBV 图上,于肿瘤血供最丰富的区域测得最大CBV 值(CBVmax)。应尽可能避开肿瘤囊变、出血、坏死区域;另将5 个ROI 置于病灶对侧正常白质区,取平均值,计算肿瘤区与对侧正常脑白质区 CBV 的比值,获得相对 CBVmax(rCBVmax)。
1.6 统计学方法 采用SPSS 19.0 软件和MedCalc 18.2.1 软件,正态分布的计量资料以表示,组间比较采用两独立样本t检验;计数资料比较采用χ2检验或Fisher 确切概率法。利用受试者工作特征(ROC)曲线下面积(AUC)和二元Logistic 回归分析单独应用和联合多参数MRI 鉴别WHO Ⅱ~Ⅲ级星形细胞瘤IDH突变状态的敏感度、特异度、阳性预测值(PPV)及阴性预测值(NPV),AUC 比较采用Z检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组一般资料及T2 FLAIR 不匹配征象分析IDH突变组患者年龄低于IDH野生组(P=0.003)。两组性别差异无统计学意义(P>0.05),T2-T2 FLAIR 不匹配征象差异有统计学意义(P<0.001;表1,图1、2)。
2.2 两组ADCmin 值、rADC 与rCBVmax 值比较IDH突变组ADCmin 值小于IDH野生组,差异有统计学意义(t=6.691,P<0.001);两组rADC、rCBVmax比较,差异均有统计学意义(P<0.001,表1)。
2.3 各参数及多参数联合诊断效能比较 ROC 曲线分析显示,ADCmin 值鉴别WHO Ⅱ~Ⅲ级星形细胞瘤IDH突变状态的阈值为0.96,其敏感度、特异度和AUC 分别为 76.74% 、 80.49% 和 0.85 。 当rCBVmax<2.53 时,鉴别IDH突变状态的敏感度、特异度和AUC 分别为81.40%、70.73%和0.81。联合多参数诊断效能见表2。T2-T2 FLAIR 不匹配与T2-T2 FLAIR 不匹配+DWI+PWI 的AUC 比较,差异有统计学意义(Z=6.15,P<0.001);T2-T2 FLAIR 不匹配+DWI与T2-T2 FLAIR 不匹配+DWI+PWI 的AUC 比较,差异无统计学意义(Z=0.052,P=0.96)。
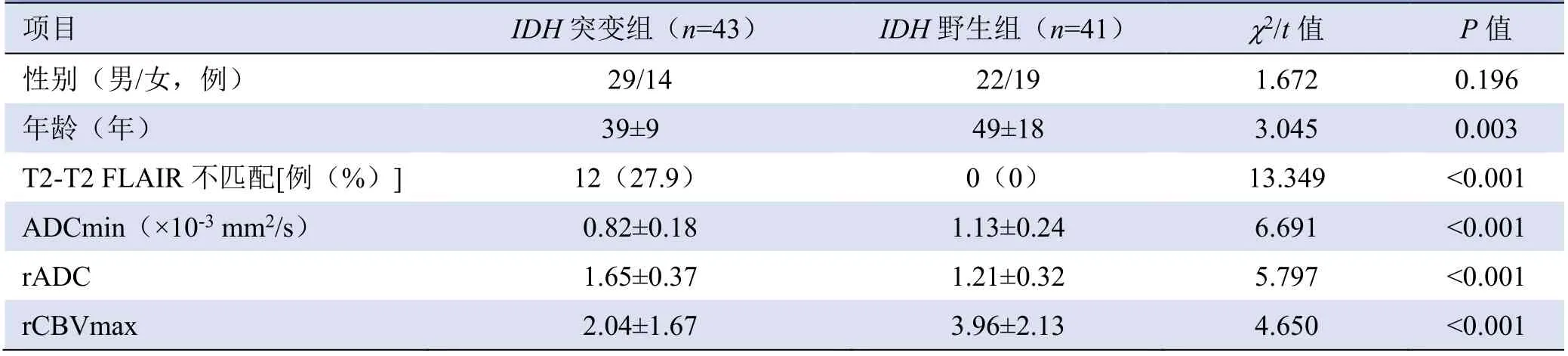
表1 IDH 突变组与IDH 野生组WHO Ⅱ~Ⅲ级星形细胞瘤患者一般资料及T2-T2 FLAIR 不匹配征象分析
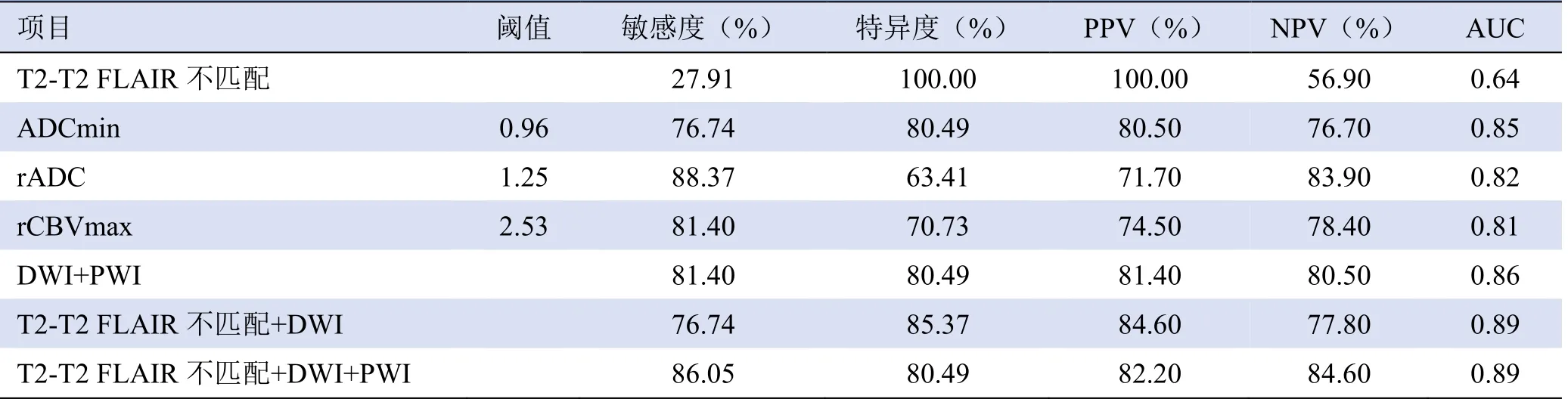
表2 T2-T2 FLAIR 不匹配征象和多参数MRI 鉴别WHO Ⅱ~Ⅲ级星形细胞瘤IDH 突变状态的ROC 曲线分析
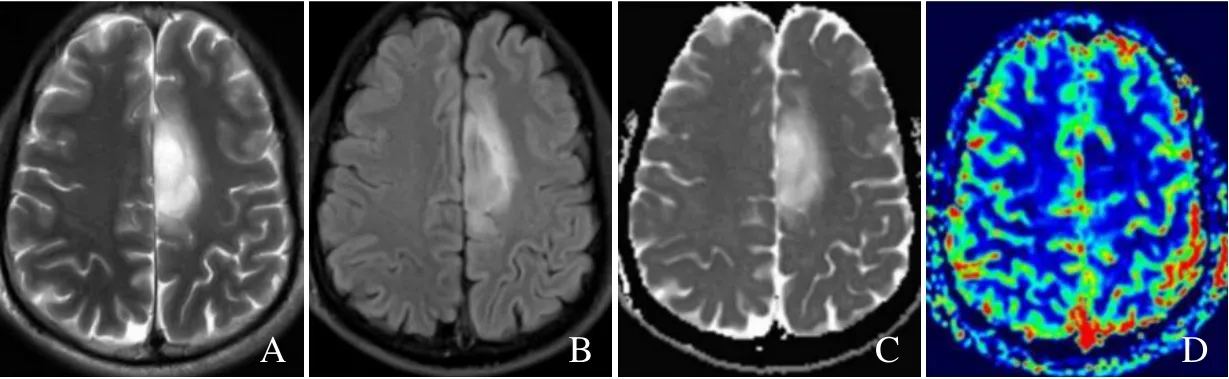
图1 男,46 岁,弥漫性星形细胞瘤,IDH 突变型。T2WI 示左侧额叶病灶呈高信号,边界不清(A);T2 FLAIR 示病灶呈相对低信号周围见环形高信号影,并可见水肿带影(B);ADC 图示病灶呈相对高信号,ADCmin 值及rADC 值分别为1.48×10-3 mm2/s、1.9(C);伪彩CBV 图像显示稍低灌注,rCBVmax 为1.40(D)
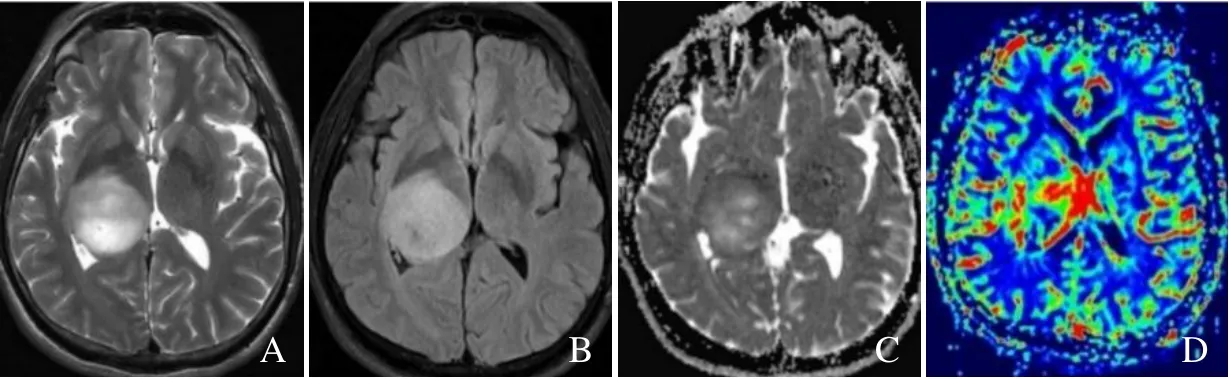
图2 男,49 岁,间变性星形细胞瘤,IDH 野生型。T2WI 示右侧丘脑不均匀高信号灶,边界清楚(A);T2 FLAIR 呈高信号(B);ADC 图示病灶ADC 值与对侧正常丘脑相比呈不均匀稍高信号,ADCmin 及rADC 值分别为0.82×10-3 mm2/s、1.20(C);伪彩CBV 图显示病灶呈高灌注,rCBVmax 为6.65(D)
3 讨论
IDH基因突变由Parsons 等[5]于2008年在胶质母细胞瘤中首次发现,其在星形细胞瘤的发生、发展及演变过程中具有重要作用。IDH突变型WHO Ⅱ、Ⅲ级星形细胞瘤患者的生存期无显著差异[2],而IDH野生型WHO Ⅱ级星形细胞瘤预后相对更差[6]。此外,基于IDH基因突变状态将星形细胞瘤进行亚组分类有助于评估肿瘤预后特征并预测治疗反应[7]。研究表明,胶质瘤患者预后与年龄相关,IDH野生型患者年龄显著大于IDH突变型患者[7],本研究结果与之相符。
既往较多研究报道采用脑叶分布、边界、强化程度、均匀性等常规MR 征象鉴别胶质瘤IDH基因突变状态,发现IDH突变型胶质瘤更好发于额叶,且具有边界更清楚等特点,而肿瘤的强化程度及均匀性结论有一定的差异[6,8-12]。Tay 等[13]于2011年首次报道在原浆型星形细胞瘤中发现T2-T2 FLAIR 不匹配征象,表现为与T2WI 相比,在T2 FLAIR 图像上出现部分信号“抑制”。T2-T2 FLAIR 不匹配征象可用于预测WHO Ⅱ~Ⅲ级胶质瘤的基因型[4,14]。本研究发现,T2-T2 FLAIR 不匹配征象均出现在IDH突变型星形细胞瘤中,其特异度和PPV 均为100.00%,表明此征象是诊断IDH突变型星形细胞瘤的特异性征象。目前,T2-T2 FLAIR 不匹配征象发生的具体机制尚不清楚,推测可能与IDH突变型星形细胞瘤中存在尚未发现的分子亚型有关[4]。
IDH基因突变会导致IDH 的催化活性改变,获得催化α-酮戊二酸还原2-羟基戊二酸(2-hydroxyglutarate,2HG)的酶活性,导致2HG 产生增多,从而影响缺氧诱导因子途径等多个细胞增殖分化的信号通路,抑制肿瘤细胞增殖和血管生成[15-16]。
DWI 是无创性地反映组织中水分子布朗运动的成像方式,使组织间产生对比,水分子的扩散运动与肿瘤细胞增殖情况、细胞密度及核浆比密切相关。ADC 值是DWI 中最常用的一个指标,与胶质瘤的肿瘤细胞密度呈负相关。研究显示,IDH野生型胶质瘤较突变型的ADC 值更低[3,17-18]。Lee 等[14]通过直方图分析显示ADC 值可以用于鉴别胶质瘤的基因型。本研究表明,IDH突变型WHO Ⅱ~Ⅲ级星形细胞瘤的ADCmin 值和rADC 值明显高于IDH野生型,提示IDH突变型星形细胞瘤水分子扩散受限程度较轻,与文献报道一致。
PWI 是研究脑组织和病变血管血流灌注信息功能成像,可反映脑肿瘤微血管数量和血管生成情况[19]。rCBV 在鉴别肿瘤类型及分型中是PWI 最可靠和最有价值的一个脑血流动力学参数,可较为直观地反映脑肿瘤组织不同部位的血供情况[3,20-21]。Law 等[20]研究显示,CBV 可以用于预测胶质瘤患者的生存期,rCBV值较高的胶质瘤患者无进展生存期相对更短。多数研究表明CBV 可以用于鉴别WHO Ⅱ~Ⅲ级胶质瘤IDH基因突变状态。然而,Leu 等[3]研究发现,rCBV 在IDH野生型与突变型WHO Ⅱ~Ⅲ级胶质瘤中无显著差异,可能与该研究纳入样本量较小有关。本研究也发现IDH突变型星形细胞瘤的rCBVmax 值显著低于野生型,与多数研究结果相符。
本研究中ROC 曲线分析显示,与T2-T2 FLAIR不匹配征象比较,联合T2-T2 FLAIR 不匹配征象、DWI 和PWI 能显著提高诊断效能。与联合T2-T2 FLAIR 不匹配征象和DWI 比较,联合T2-T2 FLAIR不匹配征象、DWI 和PWI 可以提高诊断敏感度,但特异度减低,两者的诊断效能无显著差异(Z=0.052,P=0.96),提示对比剂过敏患者可能通过联合T2-T2 FLAIR 不匹配征象和DWI 鉴别星形细胞瘤的IDH基因突变情况。
总之,本研究提示T2-T2 FLAIR 不匹配征象是诊断IDH突变型WHO Ⅱ~Ⅲ星形细胞瘤较特异的征象,与IDH突变型相比,IDH野生型WHO Ⅱ~Ⅲ星形细胞瘤的ADCmin 和rADC 更低、rCBVmax 更高。联合T2-T2 FLAIR 不匹配征象、DWI 和PWI 有助于预测WHOⅡ~Ⅲ级星形细胞瘤的IDH基因突变状态。

