中国拟青霉液体深层发酵条件的优化
周家萍,孟梦,夏国强
(1.天津科技大学现代分析技术研究中心,天津 300457;2.天津科技大学食品营养与安全国家重点实验室,天津 300457;3.天津科技大学食品科学学院,天津 300457;4.优滋福(天津)食品科技有限公司,天津 300457)
中国拟青霉(Paecilomyces sinensis sp nov,PS)是从虫草中分离后,进行发酵培养的无性型菌株[1]。并且中国拟青霉与天然虫草相比,药理学、形态学[2]及所含的有效化学成分极为相似[3]。因此从中国拟青霉中分离出具有生物活性的菌体对虫草的研究与应用具有非常重要的意义。与传统的食药用真菌生产方式相比,真菌液体深层发酵技术有更为明显的优点[4]。研究人员对真菌进行液体发酵培养后,通过对其菌丝体进行检测,结果表明其菌丝体与该真菌的野生型子实体相比,生物活性物质的组成十分相似[5]。在真菌液体发酵培养过程中,不仅菌丝体会大量增殖,其发酵液中也会产生很多生理活性物[6]。因此,研究真菌液体深层发酵技术的意义重大[7]。本文以中国拟青霉为原材料,研究其培养基成分及发酵条件不同对中国拟青霉液体深层发酵产生的影响,从而优化了中国拟青霉液体深层发酵条件。
1 材料与方法
1.1 材料与试剂
中国拟青霉(Paecilomyces sinensis):保存于天津科技大学菌种保藏中心。
葡萄糖、可溶性淀粉、蔗糖、果糖、麦芽糖、蛋白胨、酵母粉、氯化铵、硝酸铵、磷酸氢二钾、磷酸二氢钾、三氟乙酸:分析纯,天津市北方天医化学试剂厂;乙醇、丙酮、乙醚、浓硫酸、冰醋酸、无水葡萄糖、盐酸:分析纯,天津化学试剂一厂;Sepharose 4B:上海Pharmacia拜力公司;透析袋(COMW 7000):北京Sorlabio生物科技公司。
1.2 仪器与设备
SQ810C高压蒸汽灭菌锅:日本雅玛拓公司;DGG-102-2BS电热鼓风干燥箱:天津天宇机电有限公司;FE28 pH测定计:瑞士Mettler Toledo有限公司;BSA822电子天平:美国Sartorius公司;EPOCH酶标仪:美国BioTek公司;SP88857195磁力搅拌器:美国Thermo Fisher公司;Vortex涡旋振荡混合器:德国IKA公司;KQ5200DB超声波清洗器:昆山市超声仪器有限公司;5920R冷冻高速离心机:德国Eppendorf公司;UV-2550PC紫外可见分光光度计:日本岛津公司。
1.3 方法
1.3.1 菌种的活化及培养
在马铃薯葡萄糖琼脂培养基上接种保存的中国拟青霉母种,将其置于25℃培养箱中进行培养,菌丝长满斜面后备用。从斜面上挑取活化好两块菌丝体,将其接入到装有液体种子培养基的三角瓶中,置于25℃的摇床上振荡,从而获取一级种子液。将菌丝体打碎,将一级种子液接入到装有液体种子培养基的三角瓶中,置于25℃的摇床上振荡4 d,从而获取二级种子液。最后将种子液接入装有发酵培养基的三角瓶中,将其置于25℃的摇床中振荡培养5 d。
1.3.2 中国拟青霉液体深层发酵培养基的优化
1.3.2.1 碳源、氮源的单因素筛选试验
碳源筛选试验:葡萄糖分别以4.0%的玉米粉、可溶性淀粉、蔗糖、麦芽糖、果糖替代;氮源筛选试验:蛋白胨分别以酵母粉、黄豆粉、麸皮、硝酸铵、氯化铵替代,含量以0.5%蛋白胨的全氮含量计。各组设计3个重复,然后进行发酵培养。
1.3.2.2 碳源、氮源正交试验
根据碳源与氮源的单因素筛选的结果,选择试验结果较好的碳源、氮源各两个,设计L9(34)正交试验,发酵培养条件同1.3.2.1,每组设3个重复,如表1所示。
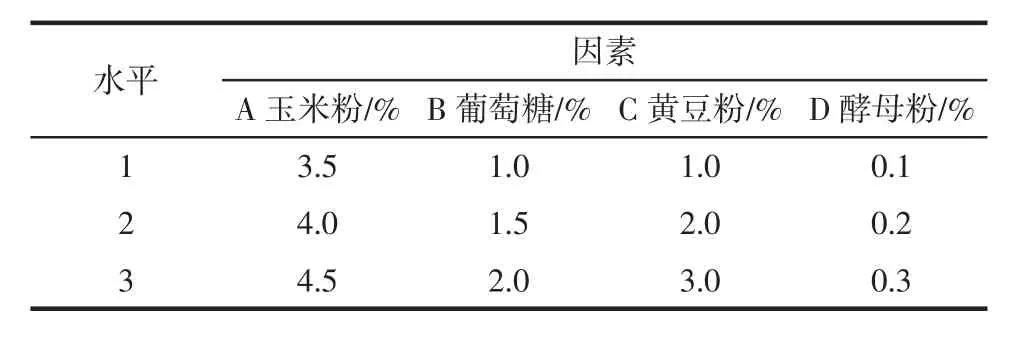
表1 碳源、氮源正交试验设计表Table 1 Scheme of carbon and nitrogen source in orthogonal test
1.3.2.3 无机盐正交试验
根据最佳碳源、氮源培养基的试验结果,选取KH2PO4、MgSO4、CaSO4、ZnSO4,设计L9(34)正交试验,发酵条件同1.3.2.1,每组设3个重复,如表2所示。
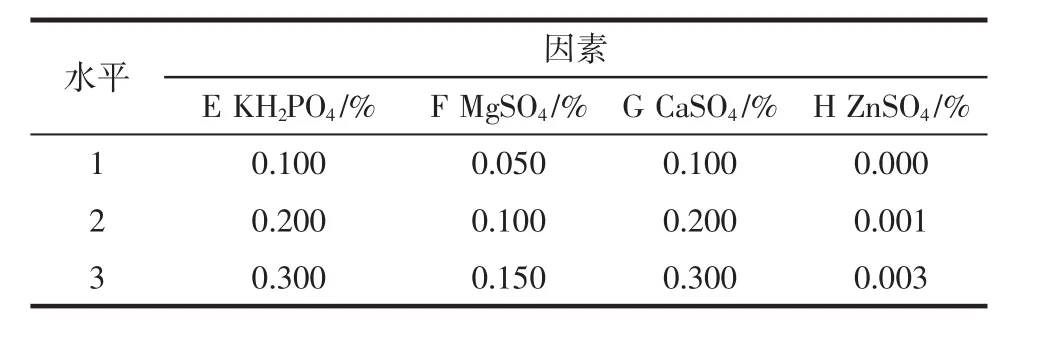
表2 无机盐正交试验设计表Table 2 Scheme of inorganic saltin in orthogonal test
1.3.3 菌丝体生物量的测定
首先过滤液体发酵所得菌体,再用蒸馏水反复漂洗菌体,将洗好的菌体放置于预处理好的玻璃平皿上,在60℃恒温的鼓风干燥箱干燥至质量不发生改变为止,将其放在分析天平称重,然后减去玻璃平皿的质量,即为发酵液菌体的质量,最后除以该发酵液的体积,即为生物量。每组重复3次,取平均值[8]。
1.3.4 胞内糖肽的测定
1.3.4.1 胞内糖肽的提取
将烘干的菌丝体粉碎,过筛后称取1.0 g,加入100 mL的蒸馏水,在90℃条件下水浴提取2 h,然后7 000 r/min离心20 min,取上清液,50℃条件下进行旋蒸,加入无水乙醇,在4℃条件下放置24 h进行醇沉,6 000 r/min离心15 min,沉淀经sevage法除蛋白沉淀60℃真空干燥至恒重,即得中国拟青霉胞内糖肽粗品,命名为CPS-Ⅰ。
1.3.4.2 糖含量的测定
标准曲线的绘制:称取干燥的无水葡萄糖标准品,配成50 mL的100 μg/mL的标准溶液。分别吸取标准溶液 0、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL 放于具塞比色管中,以超纯水补至1mL,然后加入6%苯酚500μL,混匀,迅速加入浓硫酸2.5 mL,摇匀后沸水浴处理15 min,冷水浴冷却后于490 nm处测吸光度,以葡聚糖浓度(mg/mL)为横坐标,以吸光度为纵坐标,绘制标准曲线,得标准回归方程。标准曲线线性回归方程为:y=4.577 9x+0.004(R2=0.999)。

图1 葡聚糖标准曲线Fig.1 Standard curve of glucanase
1.3.4.3 换算系数的计算
糖肽粗品组成成分不单一,单糖组分也不单一,这些单糖经苯酚-硫酸法显色后吸光度也不完全一样,而制作标准曲线时采用的是单一葡萄糖为标准品,这样会存在一定的误差,因此需用换算因子f加以校正。
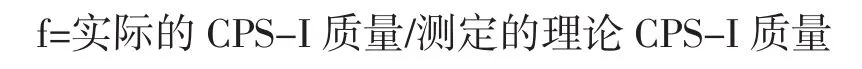
理论CPS-Ⅰ质量:称取5mgCPS-Ⅰ定容至50mL,分别取1.0 mL到3支具塞试管中,按1.3.4.2方法显色,于490 nm波长处测定吸光度,以1.0 mL蒸馏水为空白。最后根据回归方程计算理论CPS-Ⅰ含量。
2 结果与分析
2.1 最佳碳源的选择
碳源对中国拟青霉液体发酵的影响见图2。
碳源是发酵培养基的重要优化因素之一,同时也是细胞生命活动所需的主要能量来源[9]。由图2可知,中国拟青霉菌丝体都可利用这6种碳源,表明中国拟青霉既可利用复合碳源,也可利用小分子碳源。其中以菌丝体生物量为指标时,以玉米粉、葡萄糖和可溶性淀粉最佳,分别为6.19、5.37 mg/mL和4.81 mg/mL,其次是麦芽糖和蔗糖,分别为3.25 mg/mL和2.42 mg/mL,果糖最少,为1.28 mg/mL。以胞内糖肽产量为指标时,玉米粉和葡萄糖较佳,分别为0.957、0.891 mg/mL,其次是可溶性淀粉、蔗糖、麦芽糖和果糖,分别为0.837、0.721、0.062 3 mg/mL和0.045 8 mg/mL。由于玉米粉价格低,来源广,因此最终选择玉米粉;同时菌体可直接利用葡萄糖,将发酵周期缩短。因此最终选择玉米粉、葡萄糖作为正交试验中的碳源。
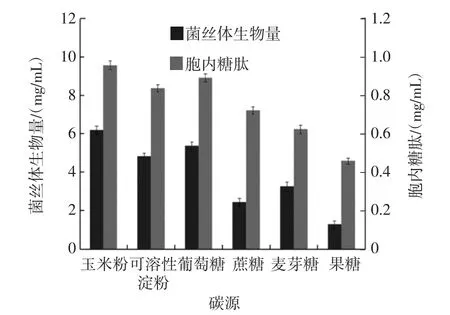
图2 碳源对中国拟青霉液体发酵的影响Fig.2 Effect of carbon sources on liquid fermentation of Paecilomyces sinensis
2.2 最佳氮源的选择
氮源对中国拟青霉液体发酵的影响见图3。
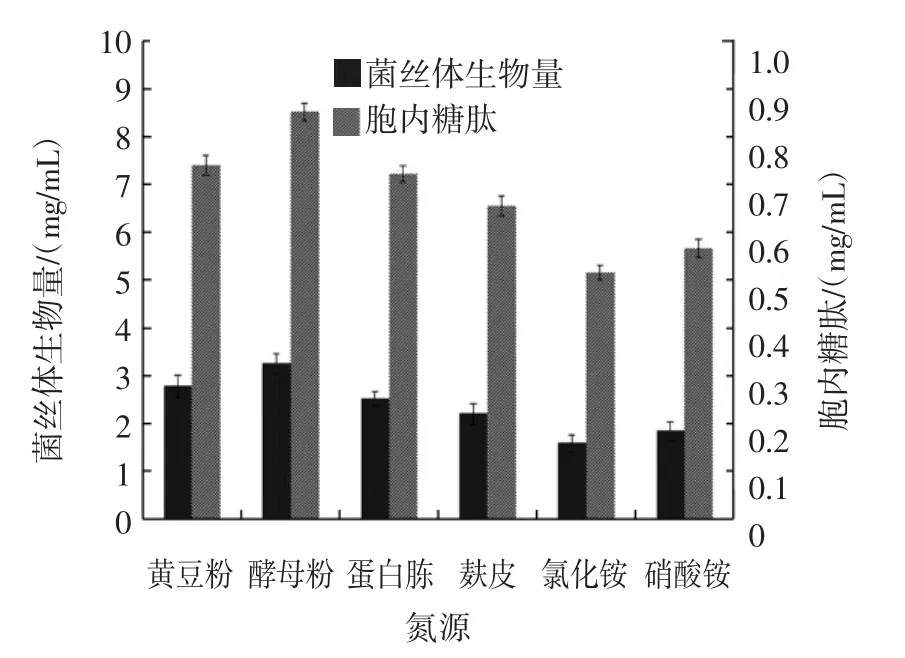
图3 氮源对中国拟青霉液体发酵的影响Fig.3 Effect of nitrogen source on liquid fermentation of Paecilomyces sinensis
有研究表明绝大多数的真菌培养基经过含有机氮源的培养基发酵后,与含无机氮源(硝酸盐、铵盐)的培养基相比,生物量和产量均得到一定程度的提升[10]。从图3可以看出,中国拟青霉在含酵母粉、黄豆粉、蛋白胨、麸皮的培养基中均能得到较好的生长,而在含氯化铵、硝酸铵的培养基中生长较为缓慢,说明中国拟青霉对有机氮的利用比无机氮好。以菌丝体生物量和胞内糖肽产量为指标,以酵母粉作为氮源时效果最佳,分别为3.25、0.853 mg/mL,其次为黄豆粉,分别为2.78、0.741 mg/mL。由于黄豆粉价格低,来源广,因此最终选择黄豆粉,同时酵母粉作为生长因子,对菌体的生长有利并能够使发酵周期有效缩短。因此,选择黄豆粉和酵母粉作为氮源进行正交试验。
2.3 碳源、氮源最佳组合的确定
碳、氮源正交试验的结果见表3。以菌丝体生物量为指标的碳、氮源正交试验结果的极差分析见表4,以胞内糖肽为指标的碳、氮源正交试验结果的极差分析见表5。
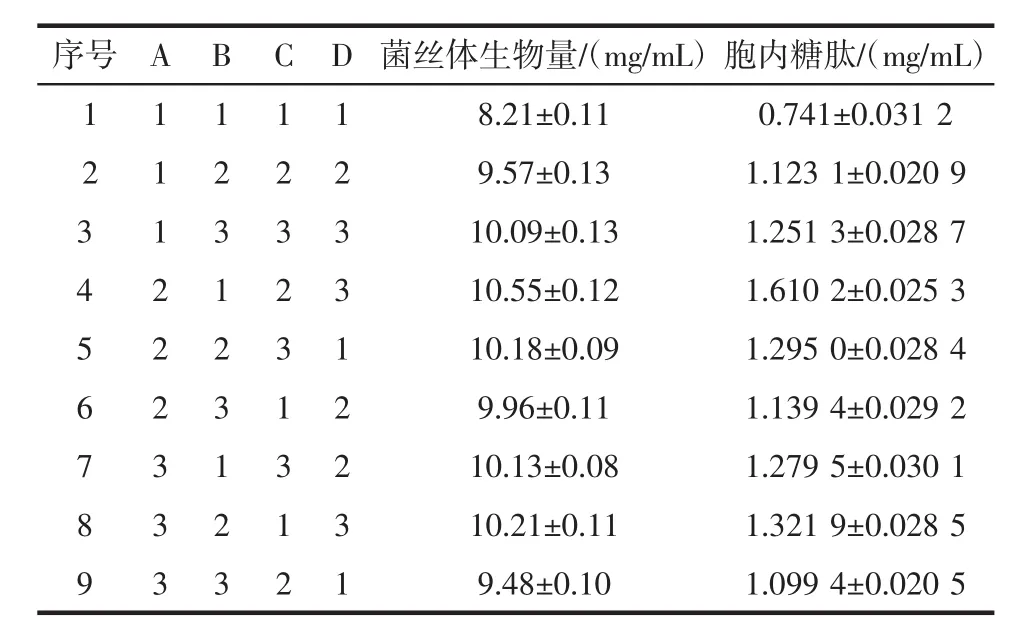
表3 碳、氮源正交试验的结果Table 3 Results of orthogonal experiments on carbon and nitrogen sources
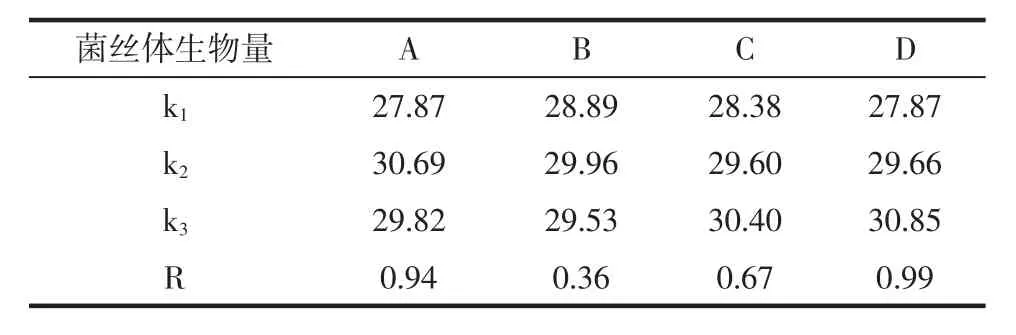
表4 以菌丝体生物量为指标的碳、氮源正交试验结果的极差分析Table 4 Analysis of orthogonal test on carbon and nitrogen sources with mycelial biomass as target
选取玉米粉(A)、葡萄糖(B)、黄豆粉(C)和酵母粉(D)作为正交试验中的因素,从而筛选出培养基中碳源、氮源的最佳组合。由表3的结果可以看出,不同组合的选择导致发酵的结果也不同。观察表4、表5中极差分析可见,以菌丝体生物量为指标,极差顺序为酵母粉>玉米粉>黄豆粉>葡萄糖,极差数据为0.99、0.94、0.67、0.36。以胞内糖肽为指标,极差顺序为酵母粉>玉米粉>葡萄糖>黄豆粉,极差数据为0.35、0.31、0.26、0.21。两种指标均表明酵母粉的浓度是对发酵影响最大的因素。对菌丝体生物量而言,应该选择A2B2C3D3组合。以胞内糖肽产量而言,应选择A2B2C2D3组合。由于黄豆粉(C)的影响对发酵的影响作用较小,故选择组合A2B2C3D3或者A2B2C2D3相差并不大,但考虑到降低试验成本,因此选择黄豆粉(C)的水平为C2,试验最终选择组合A2B2C2D3,即玉米粉4.0%、葡萄糖1.5%、黄豆粉2.0%、酵母粉0.3%。在此最优组合下,菌丝体生物量为10.78 mg/mL,胞内糖肽为1.701 2 mg/mL。
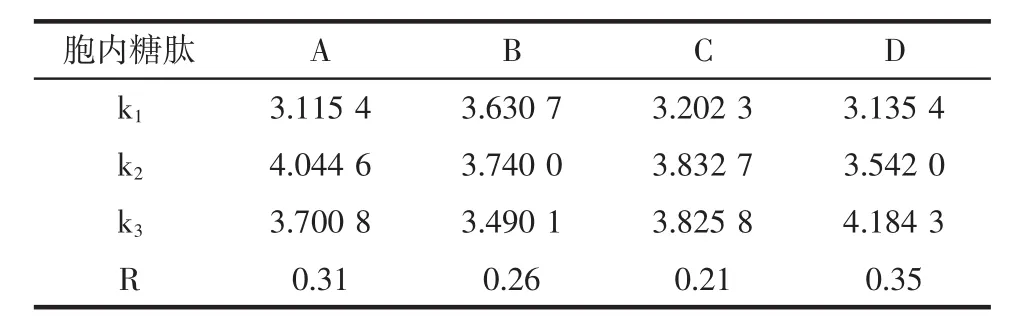
表5 以胞内糖肽为指标的碳、氮源正交试验结果的极差分析Table 5 Analysis of orthogonal test on carbon and nitrogen sources with glycopeptides as target
2.4 无机盐最佳组合的确定
在确定碳源、氮源最佳组合后,选择KH2PO4(E)、MgSO4(F)、CaSO4(G)、ZnSO4(H)4种无机盐作为正交试验中的因素,从而筛选出无机盐的最佳组合。正交试验结果见表6。以菌丝体生物量和胞内糖肽为指标的正交试验极差分析见表7和表8。
由表6结果可知,不同组合的选择导致发酵结果也是不同的。由表7、表8的极差分析可见,以菌丝体生物量为指标,极差顺序为 CaSO4>KH2PO4>MgSO4>ZnSO4,极差数据为 0.61、0.51、0.40、0.29。以胞内糖肽为指标,极差顺序为 KH2PO4>MgSO4>CaSO4>ZnSO4,极差数据为0.16、0.12、0.07、0.04。结果表明在中国拟青霉液体发酵过程中,CaSO4的浓度是对菌丝体生物量的影响最大的因素,而KH2PO4的浓度是对胞内糖肽得率的影响最大的因素。对菌丝体生物量而言,应当选择组合E2F2G3H3,对胞内糖肽产量而言,应当选择组合E2F2G1H3。由极差顺序可知,CaSO4的浓度对发酵的影响作用较小,因此选择组合E2F2G3H3、E2F2G1H3相差不大,考虑到降低试验成本,因此选择CaSO4(G)的水平选择为G1,最终确定组合E2F2G1H3,选择无机盐的配比为:KH2PO40.2%,MgSO40.1%,CaSO40.1%,ZnSO40.03%。在此最优组合下,菌丝体生物量为11.02 mg/mL,胞内糖肽为2.012 5 mg/mL。

表6 无机盐正交试验的结果Table 6 Results of orthogonal tests on inorganic salts

表7 以菌丝体生物量为指标的无机盐正交试验结果的极差分析Table 7 Analysis of orthogonal test on inorganic salt with mycelial biomass as target
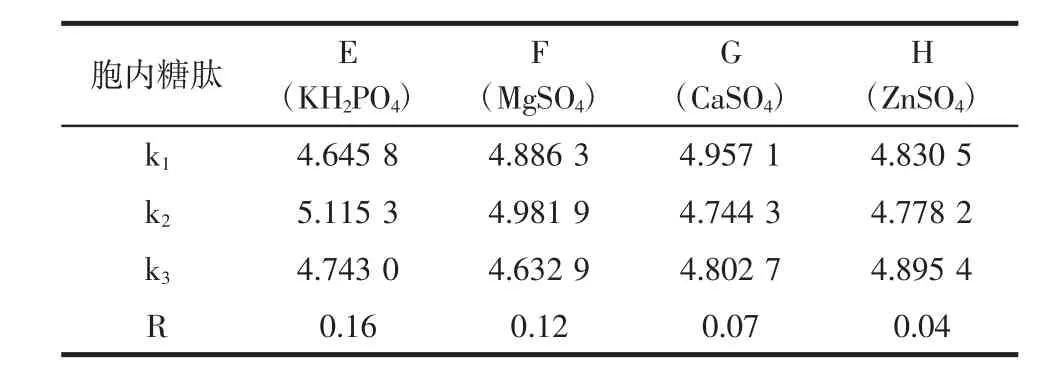
表8 以胞内糖肽为指标的无机盐正交试验结果的极差分析Table 8 Analysis of orthogonal test on inorganic salt with glycopeptides as target
3 结论
本文对中国拟青霉液体深层发酵工艺进行了优化,以发酵获取的菌丝体生物量和胞内糖肽产量为指标,通过单因素筛选试验和正交试验,对碳源、氮源及无机盐进行筛选,确定了中国拟青霉液体深层发酵的最优培养基配比为玉米粉4.0%、葡萄糖1.5%、黄豆粉2.0%、酵母粉 0.3%、KH2PO40.2%,MgSO40.1%,CaSO40.1%,ZnSO40.03%。本试验在进行接种前将制备好的所有种子液混合到一个三角瓶中,然后将其接种到优化前的发酵培养基和优化后的发酵培养基分别发酵5 d。优化后的菌丝体生物量与优化前相比提高了1.22倍,而胞内糖肽产量与优化前相比提高了54.0%。

