蛋白质-多糖自组装对白藜芦醇乳液性质的影响
闫晓佳,刘美辰,刘夫国
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
白藜芦醇是一种多酚类化合物,多存在于花生、葡萄皮和其他植物中[1],因具有丰富的生物和药理活性,如抗炎、抗氧化、减肥、预防糖尿病、保护心血管系统和神经系统等,而受到人们的广泛关注[2-5]。然而,由于白藜芦醇存在易降解、水溶性差和生物利用度低等问题,在食品中的应用受到了极大的限制[1]。胶体递送系统的开发可以有效提高活性成分的理化稳定性和生物利用率,尤其是水包油乳液特别适合用于疏水性活性成分封装递送[6]。传统的水包油乳液由小分子表面活性剂通过降低界面自由能制备而成。然而,由于小分子表面活性剂在水油界面处的热运动,其吸附、解吸处于一个动态平衡,这就导致它们稳定的乳液很容易发生絮凝、奥式熟化和相分离等[7]。同时,大量表面活性剂的使用会带来一定的安全隐患,因此由表面活性剂稳定的乳液并不广泛适用于食品和医药领域。为提高乳液的稳定性和应用范围,生物相容性良好的蛋白质和多糖作为乳化剂受到科研工作者的普遍关注,它们具有较好的乳化性,同时能够有效提高乳液的稳定性。
较多研究表明,乳液建立的递送体系能改善白藜芦醇的水分散性、化学稳定性和生物利用率[8]。采用生物大分子在油水界面逐层沉积可能是增加乳液稳定性和保护白藜芦醇的合适策略[9]。此外,油滴表面包覆的界面层结构和组成也是影响乳液理化稳定性的重要因素之一[10]。因此,本文利用不同的食物蛋白质[玉米醇溶蛋白(zein)和乳铁蛋白(lactoferrin,LF)]和羧甲基壳聚糖(carboxymethyl chitosan,CMCS)来制备具有不同界面组成和结构的水包油乳液,并对其中所负载的白藜芦醇的生物可给率进行探究。
1 材料与方法
1.1 材料与试剂
乳铁蛋白:上海普洛钦国际贸易有限公司;羧甲基壳聚糖:浙江澳兴生物科技有限公司;玉米醇溶蛋白、黏蛋白(Ⅱ)、猪胃蛋白酶(≥250 units/mg固体)、胰脂肪酶(来自猪胰腺,8×USP):西格玛奥德里奇贸易有限公司;猪胆盐(胆酸含量≥60%)、中链甘油三酯(medium chain triglyceride,MCT):上海源叶生物科技有限公司;吐温-20:天津市致远化学试剂有限公司;溴化钾(纯度>99.9%):天津市科密欧化学试剂有限公司;2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhydrazyl,DPPH,纯度>97%):阿拉丁公司;其他化学试剂均为分析纯。
1.2 仪器与设备
AUW120D电子天平、UVmini-1240紫外可见分光光度计:日本岛津公司;LGJ-25C真空冷冻干燥机:北京四环仪器厂;84-1A多头磁力搅拌器:浙江金坛区西城新瑞仪器厂;101-00AB电热鼓风干燥箱:天津市赛得利斯实验分析仪器制造厂;T25高剪切分散机:德国IKA公司;AH-BASIC高压均质机:苏州安拓思纳米技术有限公司;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;LS55-荧光分光光度计:美国PE公司;MPA-傅里叶变换红外光谱:德国布鲁克仪器有限公司;DZKW-4电子恒温水浴锅:北京市中兴伟业仪器有限公司;DHR-1流变仪:美国TA仪器公司;ZEN3600纳米粒度仪:英国马尔文仪器有限公司;ST300便携式pH计:美国奥豪斯仪器有限公司。
1.3 方法
1.3.1 玉米醇溶蛋白纳米颗粒的制备
利用反溶剂沉淀法制备玉米醇溶蛋白纳米颗粒[11]。首先将一定质量的玉米醇溶蛋白粉末溶解于75%(体积分数)乙醇水溶液中,磁力搅拌使其分散完全。然后将不同体积的玉米醇溶蛋白分散液分别注射到含有0.2%(体积分数)吐温-20的去离子水中。通过旋转蒸发除去分散液中的乙醇,形成含玉米醇溶蛋白颗粒浓度为 0.1、0.2、0.5、0.8、1.0、1.2 g/100 mL 和 1.5 g/100 mL的分散液。
1.3.2 白藜芦醇单层乳液的制备
油相的组成:将一定质量的白藜芦醇溶解于无水乙醇(0.04 g/mL)后,分散于MCT,涡旋2 min以获得含有0.25 g/100 mL白藜芦醇的油相。其中,无水乙醇作为共溶剂促进白藜芦醇在MCT中的溶解。
通过高能乳化法制备得到白藜芦醇单层乳液。将不同浓度的玉米醇溶蛋白颗粒分散液或乳铁蛋白水溶液(0.1、0.2、0.5、0.8、1.0、1.2 g/100 mL 和 1.5 g/100 mL)与油相混合,高速剪切2 min(10 000 r/min)形成粗乳液,然后通过高压均质机在50 MPa下循环5次以获得不同蛋白质稳定的水包油乳液。其中,油相与蛋白质水相的体积比为5∶95。
1.3.3 白藜芦醇双层乳液的制备
通过马尔文粒度仪测定单层乳液液滴的粒径和表面电荷,确定蛋白质作为乳化剂的最优浓度。在此基础上,采用不同浓度的羧甲基壳聚糖(0.1、0.2、0.5、0.8、1.0 g/100 mL)沉积在蛋白质稳定的液滴表面,即将单层乳液和不同浓度羧甲基壳聚糖水溶液混合,在10 000 r/min的条件下剪切2 min,然后通过高压均质机在50 MPa下循环5次,最终获得蛋白质-多糖稳定的双层乳液。其中,油相、蛋白质水相和羧甲基壳聚糖溶液的体积比为5∶47.5∶47.5。
1.3.4 乳液液滴的粒径和电位的测定
通过马尔文粒度仪测定液滴的粒径分布和电位。利用去离子水将新鲜制备的乳液稀释100倍进行测量,所有测量均在25℃条件下进行,重复3次,测定结果取其平均值。
1.3.5 流变学性质分析
为了探究羧甲基壳聚糖浓度对乳液流变学性质的影响,采用流变仪确定新鲜制备的双层乳液的流变参数,包括储能模量(G′)、损耗模量(G′′)和剪切黏度(η)。由固定应力下(1 Pa)的频率扫描确定乳液的模量,其角频率范围设置为0.1 rad/s ~100 rad/s。根据流动扫描确定乳液表面黏度随剪切速率的变化,剪切速率设置为 0.1 s-1~100 s-1。
1.3.6 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
利用FTIR分析乳液界面处蛋白质与多糖之间的相互作用。采用溴化钾压片法,对冻干样进行扫描以获得红外光谱。将溴化钾粉末研细之后,置于烘箱中过夜。将冻干的样品与溴化钾按1∶100的质量比混合,然后用玛瑙研钵研成均匀粉末状。扫描条件设置为:光谱范围为400 cm-1~4 000 cm-1,分辨率为4 cm-1。采用溴化钾作为空白对照,每个样品的光谱采集需在相同条件下重复3次。
1.3.7 白藜芦醇包埋率的测定
利用紫外可见分光光度计测定不同乳液中白藜芦醇的包埋率[12]。首先,将3.6 mL甲醇与0.4 mL新鲜乳液混合,涡旋1 min,然后在10 000 r/min的条件下离心10 min,取上清液,在307 nm处测其吸光度值Abs。根据测得的标准曲线回归方程(y=0.173 9x+0.003 3,R2=0.999 1)计算不同乳液中白藜芦醇的质量浓度(mg/L)。
包埋率计算公式:包埋率/%=C1/C2×100。
式中:C1为不同乳液中白藜芦醇的质量浓度,mg/L;C2为白藜芦醇的总质量浓度,mg/L。
1.3.8 白藜芦醇的生物可给率
由上述各项指标筛选出最优的多糖浓度制备双层乳液,并将其应用于体外胃肠道消化模拟实验中。
进行体外模拟实验前提前配制人造口腔原液(artificial saliva stock solution,ASSS)。将 1.594 g NaCl、0.328 g NH4NO3、0.636 g KH2PO4、0.202 g KCl、0.308 g K3C6H5O7·H2O、0.021 g C5H3N4O3Na、0.198 g H2NCONH2、0.146 g C3H5O3Na加入少量去离子水中,待其充分溶解后用去离子水定容至1 L,即制得ASSS,该溶液可长期存放于4℃冰箱中。取20 mL ASSS与0.6 g黏蛋白混合,在磁力搅拌器作用下搅拌过夜,制得模拟口腔工作溶液(artificial saliva work solution,ASWS)。
口腔消化:取15 mL新鲜制备的双层乳液与15 mL的ASWS混合,在磁力搅拌作用下,使用0.1 mol/L NaOH或HCl将pH值调节至7.0,保持10 min[13]。
胃消化:将上述反应后的溶液转移至100 mL烧杯中,与30 mL含有0.003 2 g/mL胃蛋白酶的模拟胃液(simulated gastric fluid,SGF)混合,使用0.1 mol/L的 HCl将pH值调节至1.5,在磁力搅拌作用下处理1 h[14]。
小肠消化:将20 mL上述胃消化液转移至另一100 mL烧杯,将pH值调节至7.0。此后,在持续搅拌下将40 mL含有10 mg/mL胆汁盐和0.4 mg/mL胰酶的模拟肠液(simulated intestinal fluid,SIF)加入到反应容器中。再次调节pH值至7.0并将样品在磁力搅拌作用下处理2 h[14]。
将经过小肠消化后的液体转移至离心管中,在15℃、10 000 r/min的条件下离心30 min,收集上清液(胶束相)。用80%的乙醇适当稀释,使得测定吸光度数值在0.2~0.8之间。在307 nm处测定吸光度值,根据白藜芦醇标准曲线,计算胶束相中白藜芦醇含量。用下式计算白藜芦醇生物可给率[15],并比较两种不同界面结构组成对白藜芦醇生物可给率的影响。
白藜芦醇生物可给率/%=胶束相中白藜芦醇含量/白藜芦醇总添加量×100
1.3.9 数据分析
试验中获得的所有数据均为3次测定的平均值。使用SPSS 18.0软件对试验结果数据的方差进行统计分析。通过Duncan检验的单因素方差分析(ANOVA)确定统计学差异,对数据进行显著性分析,p<0.05表示差异显著。
2 结果与分析
2.1 蛋白质浓度对乳液液滴大小和电位的影响
图1为不同浓度的玉米醇溶蛋白和乳铁蛋白稳定的乳液液滴的粒径大小和ζ电位。
对于玉米醇溶蛋白颗粒稳定的乳液来说,随着蛋白质的浓度从0.1 g/100 mL增加到1.5 g/100 mL,乳滴大小表现为先降低后趋于恒定(图1A)。在0.1g/100mL的低蛋白质浓度下,乳滴平均粒径高达846.5 nm,这可能是由于油滴表面没有完全被玉米醇溶蛋白颗粒覆盖,液滴之间带相反电荷的区块发生桥连絮凝,从而导致液滴的平均粒径较大[16]。随着玉米醇溶蛋白浓度的增加,玉米醇溶蛋白颗粒紧密排列于油滴表面,通过颗粒之间的静电斥力和空间位阻维持乳液的稳定性,其平均粒径保持在210 nm ~240 nm。乳铁蛋白分子稳定的传统水包油乳液中表现出相似的粒径变化趋势(图1C)。此外,玉米醇溶蛋白和乳铁蛋白稳定的单层乳液的多分散指数(polydispersity index,PdI)维持在0.1 ~0.35之间,表明粒径分布较为均匀。
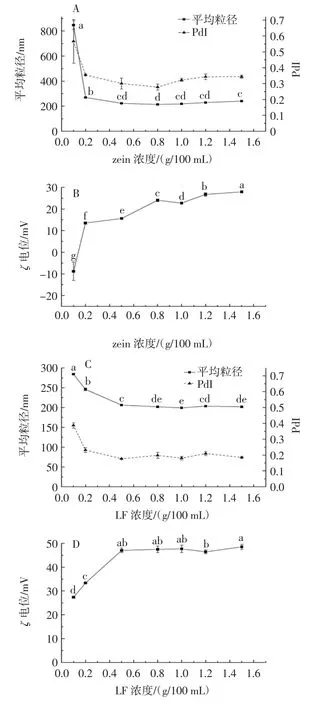
图1 不同浓度的玉米醇溶蛋白、乳铁蛋白(LF)对单层乳液液滴平均粒径(A、C)和ζ电位(B、D)的影响Fig.1 Influence of different concentrations of zein,LF on the average particle size(A,C)and ζpotential(B,D)of the monolayer emulsion droplets
表面电荷能反映液滴之间的静电斥力大小,是衡量乳液物理稳定性的重要参数之一。根据文献报道,依靠静电斥力稳定的体系ζ电位绝对值应至少为30mV,依靠空间排阻稳定的体系ζ电位绝对值应大于20 mV,才能获得较为稳定的悬浮液[17]。如图1B和图1D所示,油滴本身带负电,在0.1 g/100 mL的低玉米醇溶蛋白浓度下,液滴仍带负电荷(-8.8 mV),因此认为玉米醇溶蛋白纳米颗粒没有完全覆盖油滴表面。该结果与低浓度下玉米醇溶蛋白稳定的乳液粒径较大相一致。然而,乳铁蛋白稳定的乳液液滴在整个蛋白质浓度范围内(0.1 g/100 mL ~1.5 g/100 mL)均带正电,且电位值逐渐增大。这种差异可能是由于两种蛋白质不同的分子量及在油水界面处不同的分子结构造成的。当乳铁蛋白浓度高于0.5 g/100 mL,液滴表面的电位值趋于稳定,表明此时油滴表面已完全被乳铁蛋白分子覆盖。
综合考虑两种蛋白质稳定的乳液液滴的平均粒径和ζ电位,选择1.0 g/100 mL的蛋白质浓度进行后续蛋白质-多糖双层乳液的制备。
2.2 羧甲基壳聚糖浓度对双层乳液液滴大小和电位的影响
羧甲基壳聚糖是一种阴离子多糖,它通过静电相互作用沉积在蛋白质稳定的液滴表面。羧甲基壳聚糖浓度对双层乳液液滴大小和电位的影响见图2。

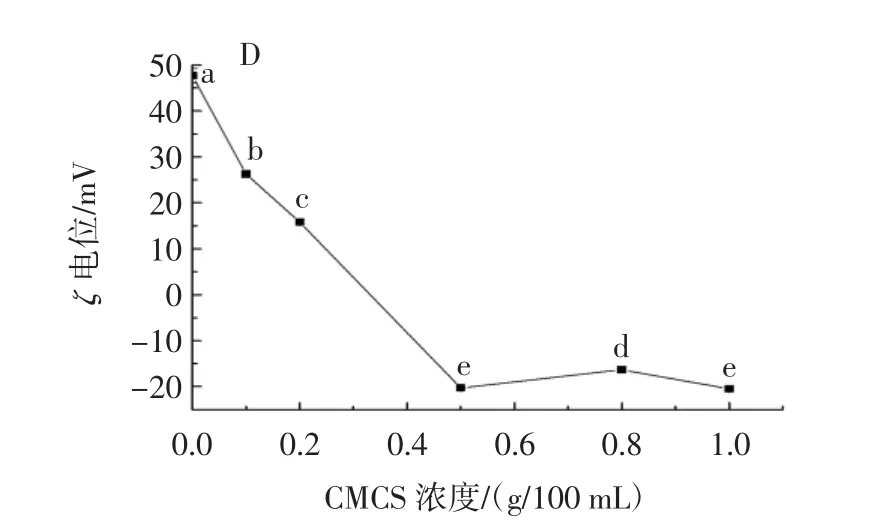
图2 不同浓度的羧甲基壳聚糖(CMCS)对玉米醇溶蛋白(zein)双层乳液和乳铁蛋白(LF)双层乳液液滴的平均粒径(A、C)和ζ电位(B、D)的影响Fig.2 Influence of different concentrations of CMCS on the average particle size(A,C)and ζ potential(B,D)of zein-bilayer emulsion droplets and LF-bilayer emulsion droplets
如图2A和图2C所示,随着多糖浓度从0.1g/100mL增加到1.0 g/100 mL,两种双层乳液的液滴粒径在200 nm ~280 nm的范围内变化。同时,随多糖浓度增加,玉米醇溶蛋白-羧甲基壳聚糖稳定的双层乳液液滴表面的电位值逐渐增大(图2B),这表明越来越多的羧甲基壳聚糖分子吸附到了玉米醇溶蛋白包覆的液滴表面。而在乳铁蛋白-羧甲基壳聚糖稳定的双层乳液中,当羧甲基壳聚糖的浓度为0.5 g/100 mL时,液滴表面所吸附的多糖已经接近饱和(图2D),这可能是由于蛋白质浓度为1.0 g/100 mL所稳定的单层乳液的液滴大小不同造成的。过剩的羧甲基壳聚糖分子会增加连续相的黏度,限制液滴的移动,降低液滴之间碰撞聚集的可能性,从而提高乳液的稳定性。
2.3 多糖浓度对双层乳液流变学特性的影响
黏度是反映乳液稳定性的重要指标,连续相的黏度越大,其中分散粒子的沉降速度越慢,乳液体系就越稳定。本试验探究了不同双层乳液黏度与剪切速率的关系,见图3。
如图3A和图3C所示,所有乳液的黏度随剪切速率的增加急剧降低,表现出剪切稀化行为。这是因为流体内的粒子原本为无序分布,剪切阻力较大,表现为黏度较大;随着剪切速率增大,粒子在剪切场的作用下被拉长,发生位置重排,呈现定向排列,使内摩擦减少,表现为黏度降低;而随着剪切速率进一步增大,流动阻力变小,直到趋于稳定[18]。随着多糖的浓度增加,样品黏度呈现出先增大后减小的趋势。玉米醇溶蛋白-羧甲基壳聚糖双层乳液和乳铁蛋白-羧甲基壳聚糖双层乳液分别在0.8 g/100 mL和0.5 g/100 mL的多糖浓度下表现出最大的黏度。然而,与1.0 g/100 mL羧甲基壳聚糖稳定的双层乳液的黏度相比,无明显差异。

图3 不同浓度的羧甲基壳聚糖(CMCS)对玉米醇溶蛋白(zein)双层乳液和乳铁蛋白(LF)双层乳液黏度(A、C)和G′/G′(B、D)的影响Fig.3 Effect of different concentrations of CMCS on viscosity(A,C)and G′/G′(B,D)of the bilayer emulsion stabilized by zein nanoparticles and LF
图3B和图3D阐释了羧甲基壳聚糖浓度对乳液损耗角正切值(tan δ=G′/G′)随频率变化的影响。损耗角正切值能够间接反映乳液的流动性,损耗角正切值越大,流动性则相对较差。乳液的tanδ曲线与黏度变化趋势相似。当羧甲基壳聚糖浓度较高(≥0.8g/100mL)时,tanδ均高于其它低浓度组,表明随着羧甲基壳聚糖浓度增加,乳液的tanδ增大,黏度特性显著,不易流动。因此,通过调节多糖的浓度可以改善乳液的流变性能和稳定性。
结合2.1与2.2乳液液滴的粒径大小与表面电荷,确定了蛋白质-多糖双层乳液的最优配方为1.0g/100 mL的玉米醇溶蛋白/乳铁蛋白和0.8 g/100 mL的羧甲基壳聚糖。
2.4 FTIR分析
为解析蛋白质与羧甲基壳聚糖之间的相互作用,利用FTIR光谱仪分析了各组分的吸收峰,见图4。

图4 羧甲基壳聚糖(CMCS)、玉米醇溶蛋白(zein)、乳铁蛋白(LF)及其复合物的傅里叶变换红外光谱Fig.4 FTIR spectra of CMCS,zein,LF,zein-CMCS and LF-CMCS
如图4所示,羧甲基壳聚糖在3 439.54、1 599.45、1 060.48 cm-1出现特征吸收峰,分别为O-H,C=O,C-O键的伸缩振动[19]。在玉米醇溶蛋白的光谱中观察到了蛋白质特有的酰胺键,它是由C-O酰胺Ⅰ带(1650cm-1)和N-H酰胺Ⅱ(1 541 cm-1)的伸缩振动产生的,但玉米醇溶蛋白在2 958 cm-1处也有伸缩振动,这可能是由于玉米醇溶蛋白的强疏水性引起的。与纯玉米醇溶蛋白相比,玉米醇溶蛋白-羧甲基壳聚糖复合物中O-H基团的特征吸收峰从3407.30cm-1移动至3448.63cm-1,且吸收强度增大,这说明玉米醇溶蛋白与羧甲基壳聚糖之间发生了氢键结合。同时值得注意的是,复合物在2 958 cm-1处的吸收峰弱于纯玉米醇溶蛋白,表明与羧甲基壳聚糖结合后,玉米醇溶蛋白的疏水性减弱。此外,复合物中酰胺Ⅰ带和酰胺Ⅱ带的位置和吸收强度均发生了变化,揭示了玉米醇溶蛋白与羧甲基壳聚糖之间存在静电相互作用[20]。
与单一乳铁蛋白的光谱相比,乳铁蛋白-羧甲基壳聚糖复合物在酰胺A带的吸收峰发生了位移,这是由于乳铁蛋白的-NH2与羧甲基壳聚糖的-COOH发生了静电作用,同时二者之间会形成氢键。另外,与羧甲基壳聚糖的复合使乳铁蛋白的酰胺I带的吸收峰从1 659.79 cm-1转移到1 631.69 cm-1,且峰面积明显增加,酰胺II带的特征峰消失,这表明羧甲基壳聚糖的加入导致乳铁蛋白的二级结构发生了变化:α-螺旋结构增加和β-折叠结构增加[21]。同时,酰胺I带的吸收峰变得宽而强,表明乳铁蛋白与羧甲基壳聚糖之间形成了氢键。红外光谱结果表明羧甲基壳聚糖与两种蛋白质通过氢键、静电相互作用结合。
2.5 白藜芦醇的包埋率
白藜芦醇在不同乳液中的包埋率见图5。
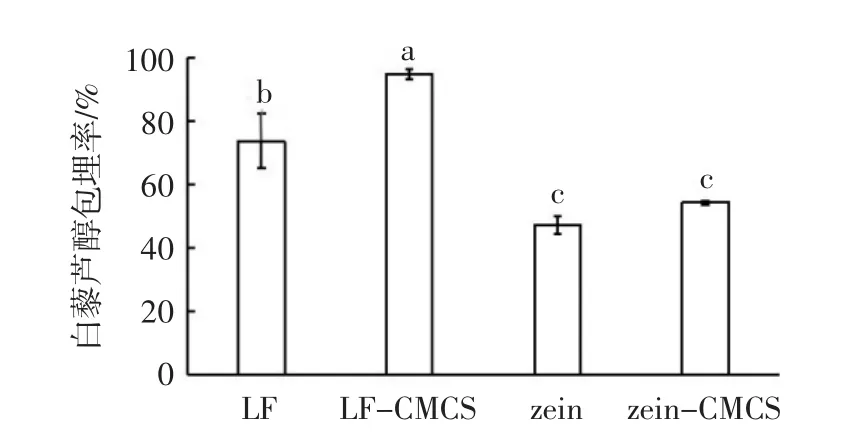
图5 白藜芦醇在不同乳液中的包埋率Fig.5 Encapsulation efficiency of resveratrol in the different emulsions
如图5所示,不同界面组成对乳液中白藜芦醇的包埋率有显著影响,其中以乳铁蛋白-羧甲基壳聚糖稳定的乳液中白藜芦醇包埋率最高,达到94.81%,乳铁蛋白稳定的乳液中白藜芦醇的包埋率达到了73.77%,而以玉米醇溶蛋白稳定的单层和双层乳液中白藜芦醇的包埋率较低,仅为47.41%和54.45%,这主要是因为乳化剂的分子结构不同。玉米醇溶蛋白表面的强疏水性导致其很容易在水溶液中发生絮凝沉淀,稳定油水界面的能力较差[22],因此对负载于油相的白藜芦醇的包埋效果较差。此外,羧甲基壳聚糖的加入有效提高了白藜芦醇的包埋率,这可能是由于界面层厚度的增加导致对内部油相及其负载的白藜芦醇有更好的稳定效果。
2.6 白藜芦醇的生物可给率
通过体外模拟胃肠道环境,探究不同界面组成对白藜芦醇生物可给率的影响。通过计算消化后胶束相中白藜芦醇含量与消化前样品中白藜芦醇的添加量的比值来确定白藜芦醇的体外生物可给率,见图6。

图6 白藜芦醇在不同乳液中的生物可给率Fig.6 Bioaccessibility of resveratrol in the different emulsions
如图6所示,游离白藜芦醇、玉米醇溶蛋白-羧甲基壳聚糖和乳铁蛋白-羧甲基壳聚糖稳定的双层乳液中白藜芦醇的生物可给率分别为(21.65±0.71)%、(62.87±0.34)%与(70.97±0.84)%。结果表明,通过构建乳液递送载体可以有效提高白藜芦醇的生物可给率。这主要归因于蛋白质-多糖界面层的保护作用。蛋白质与多糖的存在限制了胃肠道中胆汁盐和脂肪酶在脂滴表面的反应,从而抑制白藜芦醇释放到水相中被消化降解[23]。相较于玉米醇溶蛋白,乳铁蛋白稳定的双层乳液对白藜芦醇生物可给率有更好的提升效果,这可能是由于乳铁蛋白优异的乳化性能使其所形成的乳液表现出更好的稳定性。
3 结论
本文采用层层自组装技术制备了玉米醇溶蛋白-羧甲基壳聚糖、乳铁蛋白-羧甲基壳聚糖稳定的双层乳液。傅里叶变换红外光谱结果表明,玉米醇溶蛋白和乳铁蛋白与羧甲基壳聚糖之间的氢键、静电相互作用是形成双层界面的主要驱动力。玉米醇溶蛋白和乳铁蛋白与羧甲基壳聚糖稳定的双层乳液显著提高了白藜芦醇的生物可给率。本研究表明界面层的组成和结构对乳液的性质和所负载活性成分的功能性质有着至关重要的影响。

