生物滞留池微生物种群的硝化反硝化功能研究
——以深圳市为例
李笑玥,秦华鹏,王 凡,银翼翔
1)北京大学深圳研究生院环境与能源学院,城市人居环境科学与技术重点实验室,广东深圳 518055;2)中山大学大气科学学院,广东珠海519082
生物滞留池是利用工程土壤、微生物和植被的物理、化学和生物特性调控地表径流水质水量的绿色基础设施.生物滞留池作为海绵城市建设的核心设施之一,对径流污染物净化效果显著[1].但该设施对溶解态氮素污染物的处理效率存在较大波动,常出现硝态氮(NO3-N)等氮素淋失的现象[2-3].主要原因是进入生物滞留池的部分径流氮素未能通过反硝化作用被永久去除,造成硝态氮在池内累积并随后续的降雨径流淋出[4-5].微生物对生物滞留池中氮去除起到重要作用,掌握微生物种群及其氮转化功能的特征,有助于揭示生物滞留池氮去除机理,并为评估和提高系统氮去除功能提供依据.
近年来,应用分子生物学手段,如实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qPCR)和16S核糖体核糖核酸(ribosomal ribonucleic acid, rRNA)基因高通量测序等,探索微生物功能群多样性及数量在土壤氮循环,成为评价生物滞留池硝化反硝化能力的切入点.在生物滞留设施中,氨氧化、硝化和反硝化反应需要微生物体内的特异性生物酶来催化,其中,部分关键酶的编码基因已被探明,例如,编码氨氧化细菌(ammonia-oxidizing bacteria, AOB)氨单加氧酶的基因amoA-AOB、 编码氨氧化古菌(ammonia-oxidizing archaea, AOA)氨单加氧酶的基因amoA-AOA、 以及反硝化基因nirS、nirK和nosZ等多种氮转化功能基因在环境样本的调查标记中十分普遍.WAN等[6-7]搭建模拟装置研究了微生物数量与生物滞留柱填料结构的关系,但该研究使用的装置中没有植物覆盖;MORSE等[8-10]在实验室建造结构相同的模拟装置,讨论了生物滞留池中植物与微生物多样性的相互作用.CHEN等[11]采用qPCR的方法研究了美国堪萨斯州某个生物滞留系统土壤中的16S rRNA基因以及4种硝化与反硝化基因的丰度,发现其功能基因丰度与深度、淹没时间正相关;WALLER等[12]调查了美国大西洋中部沿岸州(马里兰州、北卡罗兰州和弗吉尼亚州)23个生物滞留池中2种反硝化功能基因丰度.后两项研究主要探讨了生物滞留池中的氮转化功能基因,缺乏对微生物种群多样性的分析.综合来看,目前对于生物滞留池中微生物的探究主要以实验室模拟为主,对实际运行条件下生物滞留池微生物多样性、群落结构与氮转化功能的研究较少,特别是缺乏属水平上氮转化功能菌的深入分析[14].
本研究以16S rRNA基因作为标志基因构建基因文库,对深圳市已建成的代表性原位生物滞留池土壤填料中主要细菌的群落结构和多样性进行分析,结合qPCR对硝化和反硝化细菌的功能基因丰度进行研究,并通过冗余度分析等多变量统计分析方法研究硝化反硝化细菌的群落结构、丰度与环境因子之间的相关性,探讨不同生物滞留池采样点细菌群落结构的差异性,了解硝化与反硝化微生物对环境因子的响应机制,为生物滞留池系统中氮转化功能评估提供科学依据.
1 材料与方法
1.1 采样点与样品
深圳作为中国海绵城市建设试点城市之一,生物滞留池在深圳的海绵城市建设中应用较为普遍,本研究以深圳典型生物滞留设施为例开展研究.研究区属亚热带海洋性气候,气候温和;年平均气温为22.4 ℃,平均年降雨量为1 933.3 mm,每年4~9月为雨季,期间降雨量占全年降水的85%.本研究依据较成熟的海绵项目所属的主要用地类型进行分类,主要有公园绿地、市政道路、建筑小区和模拟实验体系4种,每种类型选择2个设施,共选取8处生物滞留池为研究对象.设施结构由上到下依次为植被层、种植土层(本地土、河沙和腐殖质体积比约为5∶4∶1)、 砂层、土工布和砾石层,但土壤深度及表面植被不尽相同,见表1.

表1 生物滞留池采样点
采样时间集中在2月底至3月初(深圳市旱季),各采样点雨前干旱时间均超过2周.用手持式土壤取样器按梅花形进行5点取样,取样深度为0~15 cm(表层土壤),每个样点取样3~5 g.将采取的新鲜土壤样本剔除小石子及落叶后进行混合,封装于15 mL的离心管内,存于-20 ℃冰箱备用.
1.2 脱氧核糖核酸的提取
采用MO-BIO PowerLyzer®PowerSoil®DNA— 12855试剂盒提取土壤样品微生物脱氧核糖核酸(deoxyribonucleic acid, DNA),每个样品均提取3次.所获得的DNA均用质量分数为1%的琼脂糖凝胶电泳进行验证,用超微量紫外可见分光光度计(美国Quawell Q5000)检测质量浓度是否达标,同时依据光密度比值D(260)/D(280)判断其纯度.
1.3 高通量测序及数据分析
本研究以广泛应用于原核生物分类研究中的16S rRNA基因作为标志基因,对细菌16S rRNA基因V3、V4和V5区测序,并对深圳市已建成的代表性生物滞留池土壤填料中主要细菌的群落结构和多样性进行分析.针对8个雨水花园样地中提取的8个土壤样本,首先利用通用引物扩增样本内微生物的16S rRNA基因,然后纯化PCR 产物,并上机测序.以提取到的基因组DNA为模板,选用表2所示通用引物.
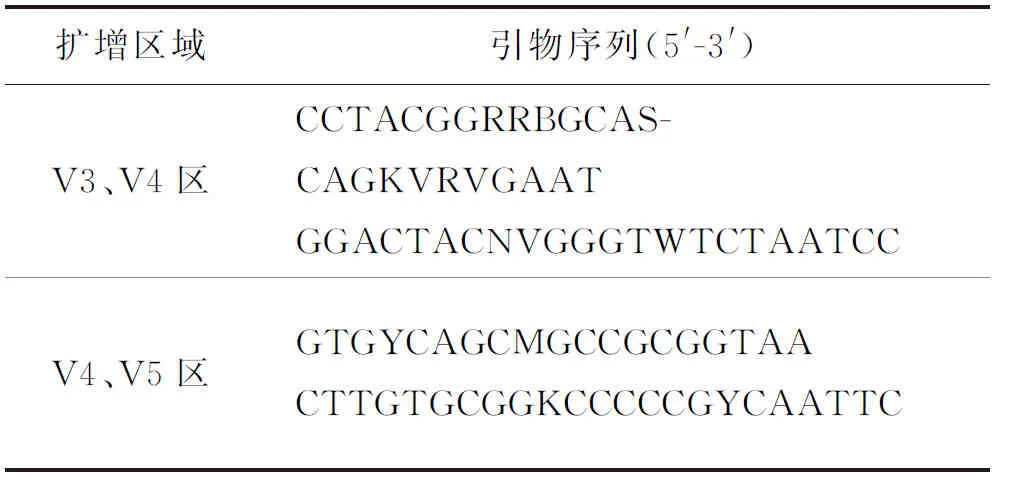
表2 16S rRNA测序引物序列
PCR反应条件为:98 ℃预变性3 min;98 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,27个循环;72 ℃保温5 min.反应产物于4 ℃保存.采用质量分数为2%的琼脂糖凝胶电泳检测PCR产物,符合扩增要求可直接用于后续分析.
委托深圳金唯智生物科技有限公司对样品进行Illumina MiSeq高通量测序.对有效数据在97%水平上进行微生物操作分类单元(operational taxonomic units, OTUs)聚类,选取OTUs序列中排在第1位的序列为代表序列,并比对Silva数据库进行物种注释.通过对OTUs进行物种在门和属等分类学水平上的群落结果统计分析,得出微生物群落结构组成.
1.4 qPCR功能基因定量分析
采用qPCR方法分别对氮循环过程中相关的5种功能基因amoA-AOA、amoA-AOB、nirK、nirS和nosZ进行定量分析,qPCR均采用SYBR Green法,利用ABI 7500型荧光定量PCR仪(Applied Biosystems, USA)仪器测定分析.
2 结果与讨论
2.1 生物滞留池中门水平微生物特征分析
2.1.1 微生物多样性和丰富度分析
DNA样本的多样性分析可以反映群落的微生物多样性和丰富度,结果如表3.样本文库覆盖率均大于98%,说明测序结果对样本真实情况具有良好的代表性,可代表样本的真实情况.

表3 生物滞留池微生物多样性和丰富度
从多样性来看,样本A1、A2、C2、D1和D2的Shannon指数高于样本B1、B2和C1,而样本A1、A2、B1和B2的Simpson指数低于样本C1、C2、D1和D2.一般而言,Shannon指数越高或Simpson指数越低都代表多样性越高.综合考虑这两个指数可知,样本A1多样性最高,即样本A1中的各物种均匀度较好;样本C1群落多样性最低,结合样本C1的丰富度指数呈现显著高的特点,推测样本C1中可能存在某几种菌为绝对优势菌的情况.A、B组样本的Sobs与Chao1值明显低于C、D组样本的,表明在A、B组样本中物种的丰富度较C、D组更低,这一差异可能与A、B组样本仅稀疏种植单一植物,且总工程土壤厚度较浅有关.
选择97%相似度的OTU,计算不同随机抽样下的Alpha多样性指数,根据多样性指数Sobs(表征实际观测到的物种数目),制作曲线图(图1),即为稀释曲线.观察样本数据的稀释曲线趋向平坦,说明测序数据量合理,更多的数据量只会产生少量的新物种,可初步判定本次测序结果合理可信.
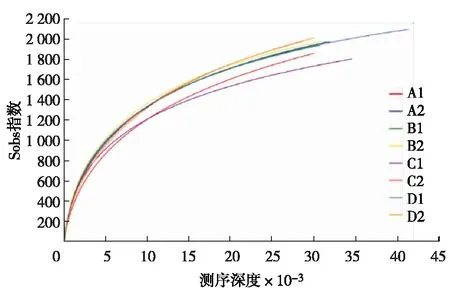
图1 相似度为97%的稀释曲线Fig.1 Dilution curve for microbial population structure under 97% similarity

图2 样品中门水平细菌(丰度>0.5%)的群落结构及分布Fig.2 Bacterial community structure and distribution of the samples at phylum level (abundance >0.5%)
2.1.2 生物滞留池中门水平微生物组成差异分析
将相对丰度低于0.5%的门类都合并为others,得到门水平种群分类图,8个土壤样品在门水平上的细菌群落组成如图2所示.由图2可见,8个样品中微生物群落结构组成总体相似,但各种微生物相对丰度略有差异,细菌群落结构在门分类水平上具有较高的多样性,经调查,样品A1、A2、B1、B2、C1、C2、D1和D2中细菌门类检测结果分别为37、37、38、35、34、36、34和35个.
种群分类发现,本研究中8个生物滞留池表层土壤内,相对丰度>0.5%的细菌共有10个门.其中,变形菌门(Proteobacteria)、放线细菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes) 6个门类是优势细菌菌门,其平均占比依次为29.67%、 21.53%、 12.82%、 12.73%、 10.67%和3.91%,总和占群落的93.49%~94.80%.变形菌门(Proteobacteria)在8个样本中丰度占比最大,样本A1、A2、B1、B2、C1、C2、D1和D2的相对丰度分别为28.69%、29.69%、25.48%、27.55%、33.22%、31.12%、30.70%和30.82%,故变形菌门(Proteobacteria)是优势菌门.有研究发现,变形菌门在生物滞留池[13-14]、人工湿地[15-17]和草地[18]的微生物氮磷去除中起到主要作用,其在生物滞留设施中相对丰度约为25%~68%[7-10].另外,绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes)对反硝化也有至关重要的作用[16-17].研究发现,样本D1、D2(实验柱对照体系)与样本B1(高污染道路生物滞留池)中绿弯菌门(Chloroflexi)较其他生物滞留池更多,样本C1与C2(建筑小区生物滞留池)中厚壁菌门(Firmicutes)的相对丰度相对与其他6个样本呈显著优势.ZUO等[10]的实验室模拟中,运行良好的实验柱中厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi) 的相对丰度波动范围分别为5%~20%和2%~11%,本研究的结果亦在该范围中.
硝化螺菌门(Nitrospirae)是一类革兰氏阴性菌,其中的硝化螺菌属(Nitrospira)细菌可将亚硝酸盐氧化成硝酸盐,是直接与径流污染处理相关的菌群,硝化螺菌门在样品A1、A2、B1、B2、C1、C2、D1和D2中的相对丰度分别为0.77%、0.67%、1.27%、0.80%、1.26%、1.18%、1.38%和1.58%;样品D2中硝化螺菌门的相对丰度最大,是样品A1和A2的2倍.
2.2 生物滞留池中属水平功能微生物差异分析
据文献[19-21]研究,硝化杆菌属(Nitrobacter)与硝化螺旋菌属(Nitrospira)的细菌都具有硝化功能;亚硝化单胞菌属(Nitrosomonas)、 亚硝化螺菌属(Nitrosospira)和亚硝化球菌属(Nitrosococcus)具有氨氧化功能;不动杆菌属(Acinetobacter)、 假单胞菌属(Pseudomonas)、 芽孢杆菌属(Bacillus)、 硫杆菌 (Thiobacillus)、 赖氨酸芽孢杆菌属(Lysinibacillus)、 罗思河小杆菌属(Rhodanobacter)、 热单胞菌属(Thermomonas)和克氏杆菌属(Klebsiella)等具有反硝化的作用,参与氮的转化.因此,重点关注8个典型生物滞留池中相关功能菌属的总相对丰度(图3和图4).调查不同样本中以上几种硝化与反硝化功能菌属的相对丰度,发现硝化细菌与反硝化细菌在不同样本中占比不同.

图3 生物滞留池中硝化功能菌属的相对丰度Fig.3 The relative abundance of functional genera related with nitrifying in bioretention cells
如图3,在生物滞留池中检出的相对丰度大于0.1%的具有硝化相关作用的微生物主要分布在5个菌属中,包括亚硝化单胞菌科(Nitrosomonadaceae)、硝化螺旋菌属(Nitrospira)、 亚硝化螺旋菌属(Nitrosospira)、 亚硝化单胞菌属(Nitrosomonas)和硝化杆菌属(Nitrobacter). 就硝化细菌的总量而言,各生物滞留池样本相差不大,其相对丰度占所有菌总和的2%左右.其中,亚硝化单胞菌科(Nitrosomonadaceae)属于β-变形菌门(β-proteobacteria),硝化螺旋菌属(Nitrospira)属于硝化螺菌门(Nitrospirae).

人工湿地是另一种处理非点源污染氮负荷的技术手段,与生物滞留池在结构与功能方面存在一定的相似性,比较对两者内部关键硝化反硝化菌属的研究结果[24]可知,亚硝化单胞菌(Nitrosomonas)在生物滞留池和人工湿地土壤中都是主要优势氨氧化细菌,但是在人工湿地中,亚硝化球菌属(Nitrosococcus)和亚硝化螺菌属(Nitrosospira)也是很常见的优势菌,然而这些菌属在本次生物滞留池的研究中则完全没有发现.可见生物滞留池与人工湿地等类似设施之间微生物结构可能存在差异.
就反硝化菌而言,在生物滞留池中检出的相对丰度大于0.1%,具有反硝化相关作用的微生物主要分布在9个菌属中,各样本中平均相对丰度最高的是芽孢杆菌属(Bacillus), 其次是赖氨酸芽孢杆菌属(Lysinibacillus)与假单胞菌属(Pseudomonas), 如图4.由于硝化与反硝化菌属在自然环境中通常不具有丰度优势,以往研究较少.吴潇[7]的研究注意到,假单胞菌属(Pseudomonas)在生物滞留池的淹没区出现,丰度约为1.39%,与本研究样本C2的丰度水平接近.总体而言,本研究的原位生物滞留池中反硝化生物种类较为丰富,检出的9种反硝化菌属,都是在表面流人工湿地中常见的反硝化功能菌属[17,19].

图4 生物滞留池中反硝化功能菌属的相对丰度Fig.4 The relative abundance of functional genera related with denitrifying in bioretention cells
样本C1和C2中的反硝化细菌群落的相对丰度占比明显高于其他样本,均超过7.5%,是取自公园和道路4个样点中反硝化细菌相对丰度的3.3~5.1倍.样本C1、C2、D1和D2的生物滞留池都没有50~60 cm的工程土壤,由于反硝化细菌多为厌氧菌,更深的土壤层厚度与植物密集间种,根系丛生带来的湿润土壤环境将有利于在土壤团粒中形成厌氧微环境,因此,具备以上特点的高台生物滞留池样本C1与下沉式生物滞留池样本C2中反硝化功能菌属的相对丰度更高.样本D1和D2的生物滞留池虽然土壤深度较深,但仅有芦苇一种植物,据此推测,生物滞留池种植植物的种类及方式(单种或间种),或将对反硝化细菌的相对丰度产生影响.样本B1和B2中反硝化菌的相对丰度虽然较低,但所检出的反硝化功能菌属的种类丰富度却优于样本C1、C2、D1和D2,这可能与样本B1和B2取自位于非机隔离带中的生物滞留池,接收到的地表冲刷径流中污染物种类更为复杂有关.
2.3 生物滞留池中硝化反硝化功能基因分析
调查样品中表征硝化作用的amoA-AOA与amoA-AOB基因,以及表征反硝化作用的nirK、nirS和nosZ基因,如图5.研究表明,生物滞留池中硝化反硝化功能基因拷贝数在不同类型的生物滞留池中表现出明显的空间分异.在市政道路类型的生物滞留池样点(B组)中,硝化功能基因丰度与反硝化功能基因丰度与其他样本相比具有显著差异,显著高于其他样本,特别是氨氧化细菌中的amoA基因丰度与其他样本中amoA基因丰度差异超过10倍.样本B1与B2中功能基因的丰度表现出的特异性与其接受的径流污染物浓度较高有关.同时,CHEN等[11]在美国所调查的生物滞留池样本中,处在污水汇流区域、平均淹没时间较其他采样区域更长的位置所测到的反硝化基因nirS、nirK和nosZ的丰度更高.高污染浓度暴露的长期驯化,使得这些体系中氮转化基因片段的累积更高.

图5 生物滞留池表层土中硝化与反硝化功能基因拷贝数Fig.5 Gene copy numbers in soil of sampling sites related with nitrifying and denitrifying in bioretention cells
另外,生物滞留池池中监测到的氨氧化细菌amoA基因的平均拷贝数高于氨氧化古菌amoA基因.MORSE等[8,11]的研究也表明,硝化功能基因amoA-AOB的丰度同常较其中的反硝化功能基因nirK、nirS和nosZ的平均丰度低1~3个数量级,这与本研究的调查结果一致.
本研究中发现生物滞留池中amoA-AOB基因的丰度水平最高值约为8.5×106g-1(每克风干土壤中目的基因的拷贝数),同时也与表面流人工湿地底泥中amoA-AOB基因的丰度水平相近,低值仅为5.9×104g-1,与中国典型温带草原和草甸草原的丰度水平类似.对于反硝化基因丰度,生物滞留池中nosZ的丰度与中国草甸草原中nosZ的丰度比较类似,较德国半自然草原的丰度更低[18,24].故污染负荷较低的生物滞留池硝化反硝化基因的丰度水平更接近自然生境,如污染负荷较高,则有可能更接近人工湿地沉积物.
2.4 生物滞留池中微生物群落分布与环境因子相关性分析

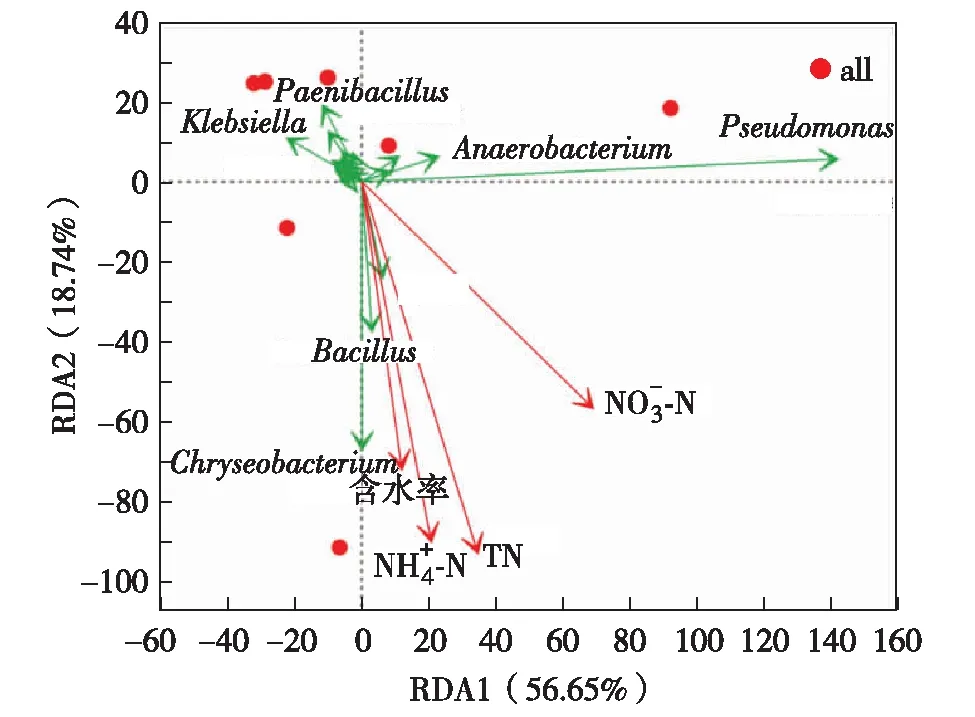
图6 生物滞留池中环境因子与细菌群落结构的关系Fig.6 Redundancy analyses for correlations between bacteria community structure and environmental factors

3 结 论
本研究采用构建基因文库和实时荧光定量的方法,在生物分子水平上对深圳市典型生物滞留设施的环境样本进行分析,调查了总细菌的多样性与门水平分布,分析了其中硝化反硝化功能菌属的群落结构、功能基因丰度及其与环境因子的关系.研究得出:
1)生物滞留池中主要优势菌门有6种,根据相对丰度水平排序依次为变形菌门(Proteobacteria)、放线细菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes),其相对丰度占群落的93.49%~94.80%.其中,与氮转化密切相关的门属包括变形菌门(Proteobacteria)、绿弯菌门(Chloroflex)和厚壁菌门(Firmicutes).
2)生物滞留池微生物群落中相对丰度最高的硝化功能菌是亚硝化单胞菌科(Nitrosomonadaceae(family)_uncultured)和硝化螺旋菌属(Nitrospira); 相对丰度最高的反硝化功能菌是芽孢杆菌属(Bacillus), 其次是赖氨酸芽孢杆菌属(Lysinibacillus)和假单胞菌属(Pseudomonas).
3)生物滞留池中硝化反硝化功能基因拷贝数在不同类型的生物滞留池中表现出明显的空间分异.在市政道路类型的生物滞留池样点中硝化功能基因丰度与反硝化功能基因丰度呈现高值.
4)RDA分析也说明了污染负荷对反硝化功能基因分布的高解释性,生物滞留池中反硝化菌更容易受到环境因子的影响.
综合各生物滞留池样地特征分析,实际运行的生物滞留池中氮转化微生物的多样性及功能基因的丰度受到体系结构、植被类型与污染负荷的综合作用.植被层选择多种植物间种或密集种植,且设置相对较深的填料层,都能为其中的反硝化微生物提供更适宜的环境.本研究的微生物调查结果可为生物滞留池的氮去除功能评估和提高提供思路.
本研究也存在一些局限性,比如对8个实际运行的设施中微生物的调查没有覆盖深圳市生物滞留池设施的所有类型和运行条件,特别是没有对深圳干湿季分明的气候特征进行深入探究,未考虑季节差异等动态变化.下一步将对这些方面进行深入的研究.

