黄芪注射液治疗急性肺损伤患者的疗效及机制研究
周易 李火平 夏光明 周帆 金朝霞 张慧
急性肺损伤(ALI)是急性呼吸窘迫综合征的早期阶段,是由心源性以外的各种肺内外致病因素所致的急性进行性呼吸衰竭,临床表现为呼吸频数、呼吸窘迫及顽固性低氧血症[1]。目前临床上参照指南采用保护性肺通气策略等为主的常规治疗取得了一定的效果,但病死率仍较高。黄芪具有抗缺氧、抗炎、镇痛和免疫调节的功能,研究表明其对ALI有一定的改善作用[2],但机制尚未完全明确。我们通过比较使用黄芪注射液和未使用黄芪注射液的ALI患者的临床资料,验证黄芪注射液对ALI患者的保护作用,同时阐述其可能的作用机制。
对象与方法
1.对象:2017年1月~2018年12月于我院重症医学科或呼吸科住院的ALI患者70例,ALI的诊断标准参照《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[3]。纳入标准:(1)年龄18~65岁;(2)入组前未使用黄芪等相关中药制剂,若正在使用上述药物需至少停用4周方可入组。排除标准:(1)伴其他严重疾病,如严重中枢神经系统疾病、高血压危象、急性心肌梗死等;(2)肝肾功能明显异常;(3)4周内使用过氯霉素。依据就诊时间将患者随机分为常规组35例和黄芪组35例。常规组男20例,女15例,平均年龄(50.3±9.7)岁,平均氧合指数[PaO2/吸入氧浓度(FiO2)](160.97±16.43)mmHg;黄芪组男22例,女13例,平均年龄(51.4±8.5)岁,平均氧合指数(159.34±13.88)mmHg,两组患者性别、年龄、氧合指数比较差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会审核批准,所有患者或其家属均签署知情同意书。
2.方法
(1)治疗方法:常规组患者按照《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)》[2]进行以保护性肺通气策略为主的综合常规治疗;黄芪组患者在常规组基础上加用黄芪注射液20 ml+0.9%氯化注射液钠250 m每日1次静脉滴注,7天为1个疗程,持续治疗两个疗程。
(2)观察指标及研究方法:①治疗前及治疗第7 d、14 d使用黄芪注射液后6 h,分别对两组患者进行以下评分:急性肺损伤(LIS)评分、急性生理与慢性健康状况(APACHEⅡ)评分、全身炎症反应综合症(SIRS)评分;②评分结束后,每位患者抽取血液5 ml,于37 ℃凝固,然后以3 000 r/min离心15 min,分离血清,采用酶联免疫吸附试验(ELISA)检测血清TNF-α、IL-6、VCAM-1及ICAM-1水平;③统计呼吸机辅助通气时间、入住ICU时间及死亡情况。
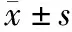
结 果
1.两组患者呼吸机辅助通气时间、入住ICU时间及死亡情况比较:黄芪组患者呼吸机辅助通气时间、入住ICU时间均低于常规组,死亡患者比例低于常规组(P<0.05),见表1。
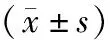
表1 两组患者辅助通气时间、入住ICU时间及死亡情况比较
2.两组患者不同时间LIS评分、APACHEⅡ评分、SIRS评分及血清TNF-α、IL-6、VCAM-1、ICAM-1水平比较:治疗前两组患者LIS评分、APACHEⅡ评分、SIRS评分及TNF-α、IL-6、VCAM-1、ICAM-1水平比较差异均无统计学意义(P>0.05)。治疗第7 d、14 d两组患者上述指标水平均低于同组治疗前(P<0.05),且治疗后同一时间点黄芪组明显低于常规组(P<0.05)。见表2。
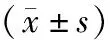
表2 两组患者不同时间LIS评分、APACHEⅡ评分、SIRS评分及血清TNF-α、IL-6、VCAM-1、ICAM-1水平比较
讨 论
ALI的发生发展伴随着多种炎症因子和细胞因子的大量释放,其进一步产生级联放大效应,又推动着ALI病程的进一步发展。目前中国的住院患者ALI发病率约为6.8%,病死率约为40.0%[4],临床上对ALI患者除针对原发疾病进行相应的治疗外,呼吸支持为主要治疗方法,以期改善患者血液低氧状态渡过急性期。本研究结果显示,黄芪组辅助通气时间、入住ICU时间及治疗后各时间肺损伤评分、APACHEⅡ评分、SIRS评分均明显低于常规组,表明黄芪注射液在治疗ALI方面有一定作用。
TNF-α主要由T淋巴细胞和单核巨噬细胞产生和释放,其在炎症中的作用机制主要是诱导细胞炎症反应、增强氧化应激、促进炎症介质的表达和释放及损害肺泡活性物质功能等。TNF-α在肺损伤中通过多条途径发挥作用:(1)直接消耗体内抗氧化物质谷胱甘肽[5];(2)刺激中性粒细胞和内皮细胞,释放氧自由基和脂质代谢产物,继续消耗抗氧化物质[6];(3)诱导多种炎症因子大量释放,触发炎症发展[7];(4)刺激前列腺素和粘附分子的产生,增强血管粘性,促进白细胞粘附血管内皮,促发血管损伤,使肺毛细血管渗透性增加,加快水肿液生成,阻碍肺泡气血交换[8];(5)损害溶酶体,释放大量酶,直接损伤肺血管内皮细胞和肺泡Ⅱ型上皮细胞,加重肺损伤[9];(6)抑制肺泡表面活性物质,导致外周气道和肺泡的潜在损伤或萎陷[10]。
IL-6是由多种基质细胞和免疫细胞产生的多功能细胞因子,ALI患者各组织器官处于应激状态,成纤维细胞、单核巨噬胞等均可释放大量IL-6。IL-6能与多种细胞因子相互作用,启动一系列信号转导机制,构成复杂的细胞因子网络,并在炎症反应中扮演重要角色[11],可用于评价炎症反应程度[12],主要通以下途径启动和活化炎性反应:(1)诱导中性粒细胞释放大量弹性蛋白酶,直接损伤肺组织[13];(2)直接诱导肝细胞产生急性期蛋白,参与炎症反应[14];(3)介导内皮细胞单核细胞趋化蛋白(MCP)-1的生成,募集外周血单核细胞向炎症部位聚集,活化特定白细胞并能启动和维持炎症反应[15];(4)诱导产生粘附因子,促进中性粒细胞粘附于肺毛细血管内壁,导致血管通透性增加[16],加剧炎性反应。
粘附分子是指存在于细胞表面、介导细胞与细胞或细胞与基质相互接触与结合的一类膜表面糖蛋白,主要包括ICAM-1和VCAM-1。目前认为白细胞与内皮细胞紧密粘附是通过整合素β2(CD11/CD18)-ICAM-1[17]和整合素α4β1(VLA-4)-VCAM-1两条通路实现[18],使之不可逆的粘附到内皮下。白细胞与血管内皮细胞紧密粘附后,在趋化因子作用下,穿过内皮细胞间隙到达炎症区域[19]。同时激活的白细胞释放各种蛋白酶、氧自由基和细胞因子,损伤肺泡上皮细胞和毛细血管内皮[20],最终导致ALI。
黄芪味甘性温,归肺、脾经,是一种重要的补气中药。本研究结果显示,与治疗前比较,两组患者治疗第7天血清TNF-α、IL-6和ICAM-1、VCAM-1水平均明显降低,黄芪组更明显。治疗第14天,黄芪组上述指标水平进一步降低,表明黄芪注射液可有效降低ALI患者TNF-α、IL-6和ICAM-1、VCAM-1的表达。因此,我们推测黄芪注射液能有效保护ALI患者的肺组织,其机制可能与其能下调患者血清TNF-α、IL-6、VCAM-1、ICAM-1的表达,从而抑制白细胞在肺组织内的浸润及保护体内抗氧化物质的损耗有关。

