异氟醚预处理通过降低肝脏caspase-1/caspase-11的表达减轻肝脏缺血再灌注损伤
王小莹 申丽娟
1 重庆医科大学附属第三医院麻醉科,重庆市 401120; 2 昆明医科大学基础医学院病理学教研室
肝脏缺血再灌注损伤(Hepatic ischemia-reperfusion injury,HIRI)是临床上肝叶切除、肝移植等手术过程中常见的并发症。它是因术中阻断肝门,阻止血流入肝,造成组织缺血、缺氧,血流恢复后出现的肝脏组织损伤[1]。细胞焦亡是一种与炎症反应相关的细胞程序性死亡,分为caspase-1介导的经典焦亡通路和caspase-11介导的非经典焦亡通路[2]。近年来研究发现,肝脏缺血再灌注损伤与缺血再灌注过程中与炎症因子caspase-1/caspase-11相关的细胞焦亡途径被活化相关[3-4]。异氟醚是临床常用的吸入麻醉药,因其不经肝、肾代谢,对肝肾有保护作用而被广泛运用于肝脏手术中,但其对肝脏缺血再灌注损伤的保护机制尚不明确。而异氟醚预处理是在缺血再灌注前给予异氟醚吸入用药,相较于手术全程用药有剂量小、效率高的优势,是一种全新的给药方式,近年来备受推崇[5]。本文旨在探究异氟醚预处理是否能对肝脏缺血再灌注损伤起保护作用,及其是否与降低介导细胞焦亡的caspase-1/caspase-11的表达相关。
1 材料与方法
1.1 实验动物 于重庆医科大学动物实验中心购买30只雄性C57BL/6小鼠,8~12周,体重(22±1.5)g。饲养于重庆医科大学动物实验中心IVC C 动物房中。自由进食、饮水,术前 12h禁食,不禁水。实验符合重庆医科大学实验动物伦理保护标准及国家相关法律规定。
1.2 主要实验器械与试剂 小动物麻醉机(中国深圳瑞沃德生命科技有限公司),异氟醚(河北一品制药有限公司),HE 染色试剂盒(中杉金桥有限公司),caspase-1 抗体(Affinity Biosciences 公司),caspase-11抗体(Affinity Biosciences 公司),GADPH(Abcam 公司),HRP 抗鼠二抗(武汉博士德)。
1.3 分组及建立HIRI模型 将30只C57BL/6小鼠随机分为3组:对照组(control组)、异氟醚组(isop组)、肝脏缺血再灌注组(HIRI组)。control组为空白对照组。HIRI 组:以乙醚麻醉小鼠,行腹部正中切口开腹,分离肝脏及周围血管组织,以血管夹夹闭门静脉,造成 70%肝脏缺血。缺血 30min后松开血管夹,使血流再灌注入肝,以连续缝合方式关闭腹腔。2h后以安乐死的方式处死小鼠取血液及肝脏组织作为实验标本。isop组:术前吸入 1.4%异氟醚气体 30min,之后间隔 30min后用乙醚麻醉小鼠后以上述方式进行 HIRI 手术并取血液及肝脏组织作为实验标本。
1.4 肝组织HE染色及病理评分 将肝脏组织制成的石蜡切片进行HE染色后于显微镜下观察,以Suzuki’s病理评分标准分别对3组小鼠肝脏组织进行评分。Suzuki’s 病理评分标准[6]:0分:无坏死、淤血及肝细胞水肿;1分:极轻微的淤血及细胞水肿(﹤10%),偶见单个细胞坏死;2分:轻度淤血及细胞水肿(11%~30%),轻度组织坏死(﹤30%); 3分:中重度淤血、细胞水肿、组织坏死(31%~60%)。
1.5 生化检查 分别收集3组小鼠血清送检,检查血清中丙氨酸氨基转移酶(Alanine aminotransferase,ALT)及天冬氨酸氨基转移酶(Aspartate aminotransferase,AST)水平。
1.6 Western Blot 分别取米粒大小的3组小鼠肝组织,用RIPA缓冲液和蛋白酶抑制剂的混合物进行裂解,BCA法测定裂解液蛋白浓度。分别取3组等量的蛋白进行12%电泳,转移至0.45mm PVDF膜上。以5%脱脂牛奶封闭1h后,用caspase-1及caspase-11抗体覆膜,置于4℃环境培养过夜。而后37℃环境下于二抗中孵育1h。以GADPH作为对照,使用Image Lab软件检测印迹,分别量化各组肝组织中caspase-1及caspase-11。
1.7 统计学方法 采用 SPSS23.0 软件对数据进行统计学分析。所有结果均以均数±标准差表示,采用方差分析法分析多组间的差异,两组间的差异用 LSD 法分析,P< 0.05 为差异有统计学意义。
2 结果
2.1 HE染色结果 control组小鼠肝脏组织镜下可见无淤血、组织坏死及细胞水肿等病理变化,而HIRI组小鼠肝组织中可见汇管区大量细胞水肿、炎性细胞聚集及细胞坏死,HIRI组Suzuki’s评分明显高于control组(P<0.05);而isop组肝组织中偶见细胞坏死及炎性细胞聚集,细胞水肿则较HIRI组明显减轻,各组Suzuki’s评分分别为control组(1.1±0.99)分,isop组(3.4±0.84)分,HIRI组(6.2±1.03)分,isop组较HIRI组显著降低(P<0.05)。见图1。

图1 各组小鼠肝脏 HE 染色切片(×100)
2.2 ALT/AST结果 收集并检测各组小鼠血清中ALT及AST水平得出:HIRI组小鼠血清中ALT及AST水平均较control组显著增高(P均<0.05),而isop组小鼠血清中ALT及AST水平均较HIRI组显著降低(P均<0.05)。见表1。
2.3 Western Blot结果 用Western Blot分别检测各组小鼠肝组织中caspase-1及caspase-11的表达,结果得出HIRI组小鼠肝脏中caspase-1及caspase-11的表达均显著高于control组(P均<0.05),而isop组中caspase-1及caspase-11的表达则较HIRI组显著降低(P均<0.05)。见图2、表2。
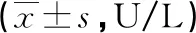
表1 各组血清ALT/AST结果
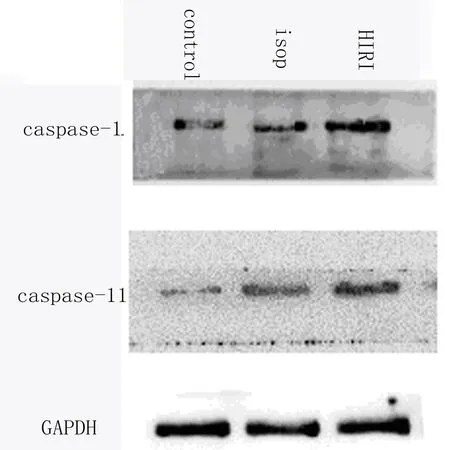
图2 Western Blot检测肝组织中caspase-1/caspase-11的表达

表2 各组caspase-1和caspase-11的相对表达量
3 讨论
肝脏缺血再灌注损伤是因肝组织在缺血缺氧环境下血液对组织的供能停止,而活性氧等机体有害代谢产物蓄积,对肝组织及供能造成损伤。当恢复血供时,不但不能改善这一情况,反而会因一系列炎症反应的活化,加重肝脏组织及功能的损害[7]。评价吸入麻醉药的效价强度时常用最低肺泡有效浓度(Mininum alveolar concentration,MAC)药物浓度,因此实验中笔者选用1.4%这一异氟醚的最低肺泡有效浓度,探究其在肝脏缺血再灌注损伤过程中,异氟醚预处理对肝脏缺血再灌注损伤的保护作用及其机制。
焦亡作为一种与炎症反应相关的细胞程序性死亡,近年来广泛研究其发生与缺血再灌注损伤的关系,以期能通过干预细胞焦亡的相关通路的活化而使器官缺血再灌注损伤得以改善[8]。细胞焦亡的途径分为caspase-1介导的经典焦亡途径和caspase-11介导的非经典焦亡途径[9]。实验证明,多种脏器的缺血再灌注过程中,由于活性氧蓄积、细胞内钙超载等因素都可以活化caspase-1介导的细胞焦亡经典途径,促进焦亡的发生,导致脏器的缺血再灌注损伤。而caspase-11介导的细胞焦亡非经典途径则与感染相关[10-11]。在脓毒血症的模型中研究发现,革兰阴性菌表面脂多糖(Lipopolysaccharide,LPS)能以胞吞的形式进入细胞,胞内的未活化的caspase-11是LPS天然的受体,LPS入胞后与其结合并活化caspase-11,启动了细胞焦亡非经典途径,促使下游IL-1β、IL-18等炎症因子释放,导致组织及功能受损[12]。因阻断肝门时会造成肠系膜静脉淤血,肠道内革兰阴性菌入血,再灌注时,革兰阴性菌随血流入肝,释放表面LPS进入肝脏固有巨噬细胞——Kupffer细胞,活化细胞内caspase-11,启动肝脏的细胞焦亡非经典途径,对肝脏造成损害[13]。而因此,笔者选择caspase-1和caspase-11为靶点进行研究。
本实验由肝脏组织切片HE染色观察并进行病理评分后得出:HIRI组小鼠病理评分明显高于control组(P<0.05),而经异氟醚预处理后的isop组小鼠病理评分较HIRI组小鼠显著降低(P<0.05)。与此同时,血清ALT/AST的检测结果也得出同样的结果。由此可得出结论:异氟醚预处理能减轻小鼠肝脏缺血再灌注损伤,并对肝功能起到一定的保护作用。而后,经Western Blot对各组小鼠肝脏组织中caspase-1/caspase-11表达情况的检验得出:HIRI组小鼠肝脏组织中caspase-1/caspase-11表达明显高于control组(P均﹤0.05),而isop组小鼠肝脏组织中caspase-1/caspase-11表达则较HIRI组明显降低(P均﹤0.05),由此可得:肝脏缺血再灌注损伤与caspase-1和caspase-11介导的细胞焦亡途径被活化有关,而异氟醚预处理对小鼠肝脏缺血再灌注损伤起保护作用,并且这一作用与其对caspase-1/caspase-11表达起到的抑制作用有关。因此笔者得出结论:异氟醚预处理对肝脏缺血再灌注损伤有保护作用,并且这一作用可能与通过抑制细胞焦亡相关蛋白caspase-1及caspase-11的表达,一定程度抑制细胞焦亡途径的活化相关,但具体机制尚不明确,有待进一步研究。

