腹腔镜大范围肝切除术和开腹大范围肝切除术治疗肝癌的对比研究
郝荣 闫萌
[關键词] 腹腔镜大范围肝切除术;开腹大范围肝切除术;治疗指标;肝功能指标
[中图分类号] R735.7 [文献标识码] B [文章编号] 1673-9701(2021)29-0088-04
Comparative study of laparoscopic extensive hepatectomy and open extensive hepatectomy in treatment of liver cancer
HAO Rong1 YAN Meng2
1.Department of Hepatobiliary Surgery, Zaozhuang Mining Group Central Hospital, Zaozhuang 277000, China; 2.Magnatic Resonance Imaging Room, Zaozhuang Mining Group Central Hospital, Zaozhuang 277000, China
[Abstract] Objective To explore the therapeutic effect of laparoscopic extensive hepatectomy (LMH) and open extensive hepatectomy. Methods A total of 97 patients with liver cancer who were hospitalized from December 2018 to December 2020 were selected as the research subjects. According to the random number table method, 49 patients in group A were treated with LMH, and 48 patients in group B were treated with open extensive hepatectomy. Perioperative treatment indexes,liver function indexes and complication rates were compared. Results Of group A,the incision length was (9.08±0.65)cm, and the amount of intraoperative blood loss was (342.15±21.26)mL, and the amount of blood transfusion was (102.03±8.54)mL, which were less than those of group B, with statistically significant differences(P<0.05). The operation time of group A was slightly longer than that of group B, with no statistically significant difference (P>0.05). The postoperative extubation time (4.88±0.26)d, diet recovery time (2.32±0.58)d and hospitalization time (6.97±0.97)d in group A were shorter than those in group B, with statistically significant differences(P<0.05).Before operation, the difference in liver function indexes between the 2 groups was not statistically significant(P>0.05).On postoperative day 1, the levels of ALT and AST in group A were lower than those in group B, with statistically significant differences(P<0.05). At 3 days after operation, the ALT level in group A was lower than that in group B, with a statistically significant difference(P<0.05).The complication rates were 6.12% in group A and 22.92% in group B, with a statistically significant difference(P<0.05). Conclusion The effect of LMH treatment for patients with liver cancer is better than that of open extensive hepatectomy, which can optimize treatment indexes, shorten postoperative recovery time, improve liver function and reduce complications.
[Key words] Lapatoscopic extensive hepatectomy; Open extensive hepatectomy; Treatment index; Liver function index
肝癌是较为高发的恶性肿瘤类型,其分为原发性及继发性肝癌,其中以肝细胞肝癌最为常见。其致病因素为脂肪肝、病毒性肝炎与酒精肝等,是威胁人类身心健康的主要杀手[1]。肝脏血供来源中,75%来自门静脉系统,其余为肝动脉系统,因此肝癌的转移方式分为门静脉肝内转移和肝静脉肺部、淋巴结转移。肝癌早期无特异性症状,随着肿瘤生长可出现消瘦、乏力与黄疸表现,此时病程多为中晚期,治疗效果欠佳。手术根治性治疗是其最理想的疗法之一,临床多通过开腹手术切除肿瘤病灶,但切口较大,创伤性明显,具有治疗局限性。在腹腔镜技术的引导下,腹腔镜大范围肝切除术(LMH)成为肝癌患者的首选术式,其能够在腹腔镜指导下同时切除3个及以上肝段,含扩大半肝切除与半肝切除等多种术式。LMH的远期生存率较高,不易导致严重并发症[2]。基于此,本研究选取2018年12月至2020年12月入院治疗的97例肝癌患者为研究对象,用于分析LMH与开腹大范围肝切除术的疗效差异,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年12月至2020年12月肝癌患者97例,根据随机数字表法分组,A组49例,男26例,女23例;年龄45~89岁,平均(51.26±1.48)岁。B组48例,男28例,女20例;年龄42~87岁,平均(51.38±1.51)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本次研究经本院医学伦理委员会审核批准。
纳入标准:術前经影像学技术和临床症状等诊断为肝癌;符合大范围肝切除手术指征,即切除范围为3个及以上肝段;患者的精神状态良好;患者及家属对研究知情且同意。排除标准:术前患者曾接受介入治疗;术中发现肿瘤远处转移;术中需联合胆肠吻合术或胆总管探查术;难以耐受手术治疗。
1.2 方法
患者入院后协助患者完成生化检验、心电图、血常规、胸片与血凝项目检查,利用增强CT等超声技术确定病灶位置与大小,评估病灶与肝内管道间关系,拟定手术方案。若病灶位置显示不清或大小评估难度较大,则可以利用肝脏三维重建技术进行评估。
A组采取LMH治疗,进行插管麻醉处理,协助患者保持平卧位,对术区进行消毒后铺巾,使患者保持头高脚低位。经五孔法进行治疗,在脐上6~8 cm处做一切口,将Trocar(10 mm)置入其中,保证Trocar入腹膜腔后启动气腹系统,经Trocar注入CO2气体,气腹压力约12 mmHg。将腹腔镜光源置入其中后全面探查肝脏与腹腔情况,评估肿瘤大小、位置、转移情况。而后做左右操作孔,尽量使两侧操作孔和肿瘤位置间形成等腰三角形,取左、右锁骨的中线位置,使其连线于同侧肋弓下缘,在交点处约3 cm处分别置入Trocar(5 mm),在脐水平左右两侧约4 cm处分别置入Trocar(10 mm)。在腹腔镜引导下,经超声定位肿瘤位置,确定肝内管道的具体走行,而后划定切除边界。先对第一肝门进行解剖处理,留置阻断带,再解剖第二肝门,离断切除范围边缘的肝周韧带并游离肝脏。使用超声刀由浅至深、自下而上离断肝脏组织,夹闭肝内管道,而后使用血管切开吻合器对Glisson蒂与肝静脉进行离断处理,将剩余的肝周韧带一并离断后移除肿瘤组织。对肝断面进行止血处理,若无胆瘘与出血表现则可冲洗肝创面。将脐下切口延长后取出肿瘤标本,缝合切口,再次置入Trocar评估出血情况,术后放置引流管。
B组采取开腹大范围切除术,术前麻醉与处理同A组,在右上腹做一反“L”形切口,进腹后探查腹腔情况,结合切除范围对肝周韧带行离断处理,游离肝脏。使用超声刀或血管钳等仪器由浅至深的对肝组织进行离断处理,经切割吻合器有效离断Glisson蒂等组织,移除肿瘤后止血,缝合切口,留置引流管。
1.3 观察指标
①观察两组患者的切口长度、术中出血量、输血量和手术时间等术中指标及拔管时间、饮食恢复时间和住院时间等术后指标。②于术前、术后1 d、3 d在空腹状态下抽取患者外周静脉血5 mL,放置于室温环境下2 h,进行离心处理10 min,转速为3500 r/min,采集血清后经酶联免疫吸附法测评血清总胆红素(TBIL)、血清谷丙转氨酶(ALT)、血清白蛋白(ALB)和血清谷草转氨酶(AST)等功能指标。③统计围术期发生腹腔积液、肺部感染、胸腔积液、胆瘘、肝功能障碍、出血、切口感染等并发症。
1.4 统计学方法
采用SPSS 21.0统计学软件分析数据,计量资料用(x±s)表示,采用t检验,计数资料用[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的围术期治疗指标比较
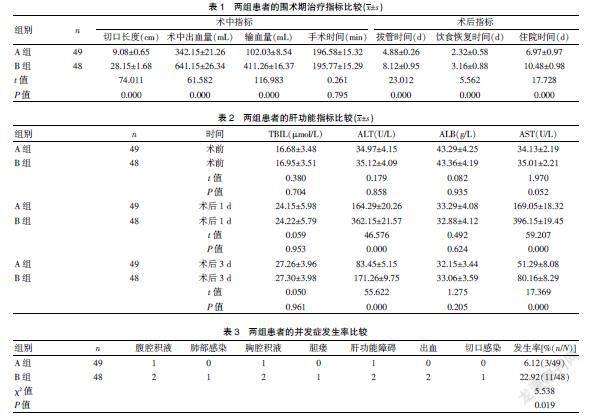
A组患者的切口长度、术中出血量与输血量低于B组,差异有统计学意义(P<0.05)。A组患者的手术时间略长于B组,但差异无统计学意义(P>0.05)。A组的术后拔管时间、饮食恢复时间和住院时间短于B组,差异有统计学意义(P<0.05)。见表1。
2.2 两组患者的肝功能指标比较
术前,两组患者的各项肝功能指标比较,差异无统计学意义(P>0.05)。术后1 d,A组患者的ALT、AST水平低于B组;术后3 d,A组患者的ALT水平低于B组,差异有统计学意义(P<0.05)。见表2。
2.3 两组患者的并发症发生率比较
A组患者的并发症发生率为6.12%,B组为22.92%,差异有统计学意义(P<0.05)。见表3。
3 讨论
肝癌手术的暴露面积大、止血与切缘操作难度大,被认为是普外科手术中的高风险手术之一[3]。在微创技术的大力普及下,LMH成为近年来大范围肝切除术的主要术式,其能够在腹腔镜下对3个以上肝段进行切除操作,对于肿瘤病灶的切除率较高,可行性较高。但临床鲜有LMH与开腹大范围肝切除术的疗效对比研究,未充分剖析LMH的治疗优势[4]。为此,本研究纳入97例肝癌患者,并对两种术式的治疗效果进行比对,发现LMH的治疗优势主要有以下几点。
3.1 LMH可优化围术期治疗指标
本研究显示,A组患者的切口长度、术中出血量与输血量低于B组,差异有统计学意义(P<0.05)。A组患者的手术时间略长于B组,但差异无统计学意义(P>0.05)。说明LMH治疗的术中出血量与输血量更少,原因是LMH可放大手术视野,对于肝内脉管系统的显示度高,超声刀等仪器的切割与止血性能优,能够保护胆管与血管,进而减少出血与失血量[5]。但LMH的手术时间略长于开腹手术,原因是LMH在术中需要精细离断肝实质组织,但其采用二维图像,立体感缺乏,难以通过医生的触感判断解剖组织结构,且穿刺套管会影响器械活动性,使得LMH手术的时间略长于开腹手术[6-7]。A组的术后拔管时间、饮食恢复时间和住院时间短于B组,差异有统计学意义(P<0.05)。说明LMH的术后恢复时间更短,原因是该术式的切口小,手术操作于密闭的腹腔内进行,不会明显刺激肠道,因此饮食恢复时间更短[8-9]。此外,LMH患者术后痛感轻微,不会因大量使用止痛剂导致胃肠道功能异常。LMH术后患者可进行早期活动,体位改变可引出腹腔或胸腔引流,因此拔管时间短。在以上因素影响下,患者的住院周期能够显著缩短[10-11]。
3.2 LMH可改善肝功能指标
本研究中,术后1 d A组患者的ALT、AST水平低于B组;术后3 d,A组患者的ALT水平低于B组,差异有统计学意义(P<0.05)。以上肝功能指标可以评估肝细胞的损伤程度,其水平受手术时间、肝脏切除范围和肝脏翻动程度等多个因素影响[12]。术后1 d,LMH对于肝功能的保护机制便可显现出来,原因是LMH的切口小,手术视角独特,术中无需大范围翻动肝脏,手术对于腹壁的损伤性小,可保护腹壁侧支循环,因此肝功能指标更优[13-14]。但由于两种术式對于肝脏的切除范围均较大,且手术耗时长,因此二者的AST与AST水平未见明显差异。
3.3 LMH可减少术后并发症
本研究中,A组患者的并发症率为6.12%,B组为22.92%,差异有统计学意义(P<0.05)。原因是LMH的术野清晰且放大,可有效辨认微小胆管或血管,离断与切除操作更为精准,不易导致出血或胆瘘等并发症[15]。且该术式对于免疫系统的干扰性小,能够减少术后感染的风险[16-18]。
综上所述,LMH对于肝癌的治疗效果优于开腹大范围肝切除术,其安全性与可行性高,可作为肝癌患者的首选术式。
[参考文献]
[1] 雷光林,李媛媛,李智,等.腹腔镜肝切除术与开腹肝切除术治疗肝细胞癌的疗效评估[J].肝胆胰外科杂志,2020,32(5):280-285.
[2] 潘树波,吴春利,侯辉,等.基于倾向性评分匹配的开腹和腹腔镜肝切除术治疗肝左叶胆管结石的队列研究[J].中华外科杂志,2020,58(7):530-538.
[3] 陈雪芳,谢浩荣,王恺,等.腹腔镜与开腹再次肝切除术治疗复发性肝细胞癌的安全性及疗效对比[J].中华肝胆外科杂志,2019,25(3):175-178.
[4] 王成方,齐瑞兆,金鑫,等.腹腔镜与开腹肝Ⅶ,Ⅷ段肝切除术治疗肝肿瘤的近期疗效对比[J].解放军医学院学报,2019,247(11):7-11.
[5] Guibaud T,Carlotta F,Waclaw H,et al.Laparoscopic major hepatectomy:Do not underestimate the impact of specimen extraction site[J]. World Journal of Surgery:Official Journal of the Societe Internationale de Chirurgie,Collegium Internationale Chirurgiae Digestivae,and of the International Association of Endocrine Surgeons,2020, 44(4):1223-1230.
[6] 林融风,华永飞,卢长江,等.腹腔镜肝肿瘤切除中转开腹的影响因素分析[J].中华肝胆外科杂志,2021,27(2):91-93.
[7] 靳曙光,徐志诚,汪俊祥,等.腹腔镜下儿童肝脏肿瘤切除术八例报告[J].中华小儿外科杂志,2019,40(8):673-677.
[8] 苏海霞,王晨光,王春燕.不同剂量利多卡因对腹腔镜子宫肌瘤切除术患者麻醉诱导时QTc的影响[J].心脏杂志,2021,33(2):165.
[9] 李会星,齐瑞兆,金鑫,等.腹腔镜与开腹左半肝切除术治疗肝脏恶性肿瘤的疗效对比[J].腹腔镜外科杂志,2020,25(4):37-41.
[10] Jinsoo Rhu,Gyu SC,Jong MK,et al.Feasibility of total laparoscopic living donor right hepatectomy compared with open surgery:Comprehensive review of 100 cases of the initial stage[J]. Journal of Hepato-Biliary-Pancreatic Sciences,2020,27(1):16-25.
[11] 林丽,张友磊,杨宁,等.完全腹腔镜肝切除术的手术室护理体会[J].腹腔镜外科杂志,2019,24(11):78-79.
[12] 李振华,杨颖,罗倩,等.开腹术后腹腔镜肝切除术手术入路选择[J].肝胆外科杂志,2019,27(5):368-370.
[13] 向伦建,刘燕,程黎,等.腹腔镜肝切除术与开腹肝切除术治疗肝细胞癌的临床疗效[J].国际外科学杂志,2019,46(2):112-118.
[14] 郝晓沛,代坤甫,马帅,等.腹腔镜肝切除手术与同期开腹手术治疗肝脏恶性肿瘤的单中心回顾性研究[J].中华普通外科杂志,2019,34(2):132-135.
[15] 马颖,罗艳丽,谢泽荣,等.腹腔镜肝癌切除术对肝癌患者转氨酶,FGF及淋巴细胞的影响[J].标记免疫分析与临床,2019,26(4):26-30.
[16] 李伟,宋卫东.三维可视化辅助下腹腔镜原发性肝癌根治性切除术的效果及对肿瘤标志物指标的影响[J].中国医药科学,2020,10(14):203-206.
[17] 曾桥.腹腔镜手术治疗肝癌的分析[J].当代医学,2021, 27(4):96-98.
[18] 姜吉洵.肝动脉化疗栓塞术联合腹腔镜下射频消融术与单纯腹腔镜下射频消融术治疗小肝癌的疗效比较[J].中国现代医生,2020,58(4):47-49.
(收稿日期:2021-04-27)

