二苯二硫醚合成工艺改进探讨
王 杰
(延安大学化学与化工学院,陕西 延安 716000)
二苯二硫醚隶属于高纯有机试剂,可被作为农药、医药及染料中间体,一般不会对水形成危害。常温常压下能维持稳定状态,但要规避和氧化物处理,维持容器处于密封状态,藏储于阴凉、干燥处。
硫酚氧化法是当下国内工业合成二苯二硫醚的方法,有流程简单、原材料成本高、废物产出量偏多等特征。金属/TiCl4制备阶段暴露出耗用大量金属、工艺清洁度偏低、后处理流程繁杂及回收率较低等弊端。鉴于以上工艺投用时优弊端,本文作出采用 SO2/KI/H2SO4/H2O还原方法的提议,但该工艺使用阶段也存在着一些问题,比如还原体系过于繁杂,对碘的利用率形成负面影响,投用的水量过多等[1]。为应对如下问题,优化工艺是唯一选择,利用SO2/I2/H2O将其取而代之,取得较好成效。
1 实验部分
1.1 主要试剂类型
苯磺酰氯、碘、蒸馏水、乙二醇二甲醚(DME)与 SO2。
1.2 分析方法阐述
课题研究阶段选用7820A气相色谱仪、Avarice DMX400核磁共振仪以及熔点仪进行分析。
1.3 具体实验过程
实验装置见图 1[2]。

图1 反应装置图示
把 40.0g(0.226mol)苯磺酞氯、20.0mL(1.113mol)水、4.0g(0.016mol)碘与 60.0mL DME分次、统一添加至250mL三口瓶内。正式反应前用SO2将装置内原有空气进行置换,反应阶段通过检测SO2缓冲气球的体积去间接的度量SO2在体系内的剩余量。若发现气球容积有减缩趋势,则要及时箱内填补SO2。于60℃条件下持续反应8h,通过检测发现原材料基本实现了完全转化。而后把反应温度提高到100℃,予以常压蒸馏处理,采集82~85℃温度区间内形成的馏分产物,能较顺利的获得乙二醇二甲醚,收率82.1%。温度降低到-10℃并静置2h去诱导产品析出过程。基于抽滤过程获取滤饼与滤液。后者采用二氯甲烷萃取,与二氯甲烷相合并,历经浓缩处理后获3.15g得棕色碘固体物,23.8g硫醚产品,收率达到95.9%,其纯净度为99.1%,熔点是58.4~59.3℃。
2 统计与分析结果
2.1 解读反应原理
本课题研究中反应体系运行时,催化剂、还原剂分别选用I2、SO2,苯磺酰氯被还原后基于偶联过程形成二苯二硫醚。苯磺酰氯作为主要的原材料之一,活泼性处于较高水平,容易和体系内SO2与H2O反应,生成相应的副产物,即苯亚磺酸、苯磺酸。为减少或者规避生成如上副产,在体系运行阶段应加强SO2以及蒸馏水添加量的控制。鉴于以上情况,本课题研究时优化改进了溶剂、蒸馏水量、I2量、温度、反应时间长度以及SO2投料形式等诸多条件因素,同时还观察研究了I2与溶剂回收再利用情况对实验结果形成的影响及其他类型底物在对本工艺运行模式表现出的适用程度。
2.2 探讨影响反应情况的主要因素
1)溶剂。从本质上分析,本课题研究中涉及的体系属于一个气-液-液反应体系,需投用适宜溶剂去溶解SO2、苯磺酰氯与水。本试验中苯磺酰氯∶水∶碘物质的量比是20∶10∶1,每10g原材料反应需配制使用15g溶剂,于60℃温度条件下探查溶剂对反应形成的影响,结果统计在表1内[3]。

表1 溶剂添加情况对二苯二硫醚收率形成的影响
由表1发现,在经改进优化后的工艺条件下,把醚作为溶剂,产品收率处于较高水平;乙二醇二甲醚最为显著,醇溶剂紧跟其后,蒸馏水作为溶剂与未添加溶剂时产品收率值均处于较低水平[4]。阐述以上情况的成因,主要是由于醇类溶剂与磺酰氯两者更容易发生酯化反应,磺酸酯是主要产物之一,伴随位阻降低过程,酯化就越容易发展与推进;相比较之下,短链醇的极性处于较高水平,对H2O与SO2的溶解量反应进行时的所需量,增加了原材料和H2O以及SO2直接接触的概率,对副反应推进过程形成诱导作用。选用H2O作为溶剂时,由于原材料和H2O以及SO2直接接触概率增加而出现了副反应。不添加溶剂与选用卤代烃作溶剂时,体系溶解的H2O与SO2量值明显低于反应所需量,对介质I2再生成HI的过程形成抑制作用,最后对主反应进行过程形成阻碍作用。综合如上内容,最后决定选乙二醇二甲醚作为本体系的溶剂。
2)H2O。体系内H2O添加量是影像I2再生成HI过程以及再生效果的关键因素之一。若体系运行阶段H2O投入量不进行严格控制,过量时很容易造成苯磺酰氯直接被水解成苯磺酸;偏少或不足时很可能会对H生成过程形成抑制作用。本课题研究中将苯磺酰氯:碘物质的量比控制为20∶1,等同于每10g原材料搭配使用15g乙二醇二甲醚,于60℃温度条件下持续反应8h,观察并分析了H2O加入量对反应形成的影响。发现伴随H2O添加量的增多,产品的收率值呈现出先增后减的趋势。若H2O量过少时,因反应体系处于缺水状态中,对I2再生成HI形成一定抑制作用;若添加过量H2O,将会诱导原材料和H2O以及SO2直接触及过程而发生副反应,故而最后设定苯磺酰氯、水两者的物质的量比为5∶1[5]。
3)I2。从本质上分析,本反应推进阶段HI发挥着还原作用,体系内I的量值对HI的循环再生成量起到决定性作用。当苯磺酰氯、水物质的量比为5∶1,每10g原材料配用15g乙二醇二甲醚,60℃条件下反应8h,观察I2量对反应形成的影响,勾画I2量对二苯二硫醚收率影响的曲线图。观察后发现,伴随I2量添加量的增多,产品收率先表现出缓缓提升特征,而后趋于相对稳定。对以上特征表现的成因进行剖析,可以做出如下表述:伴随I2量降低过程,循环体系内HI量相应减少,这在很大程度上降低了苯磺酰氯和HI触及的概率,但是其和H2O以及SO2直接接触概率提升,这是发生副反应的重要基础条件。分析到I2进价较高的实际状况,故而最后选定苯磺酰氯:碘物质的量比20∶1。
4)温度与时间。反应温度与持续时间均是影响反应效率、结果的主要因素。当体系内苯磺酰氯∶水∶碘物质的量比20∶10∶1时,每10g原材料配用乙二醇二甲醚15g的工况下,观察并探究温度与时间两项指标对反应形成的影响,统计结果见表2[6]。
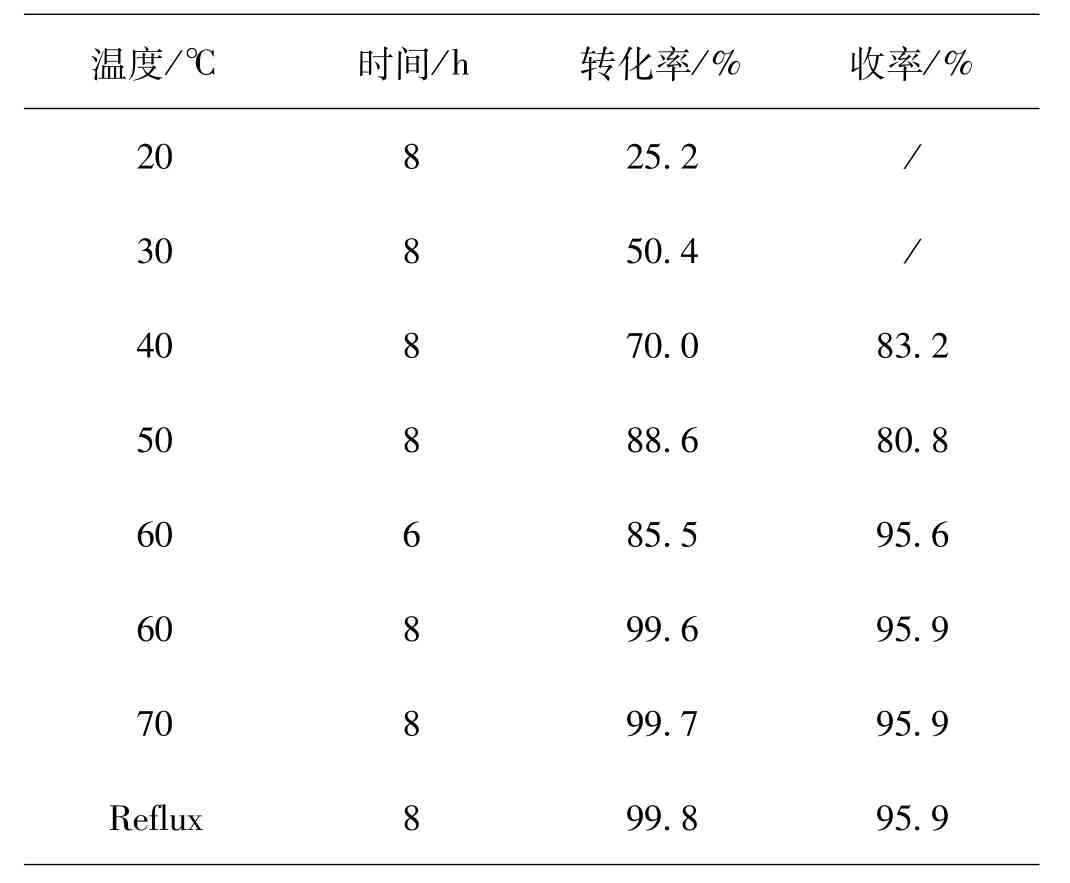
表2 时间与温度对反应形成的影响
整体分析表2内的数据信息,能较容易在感知到在偏低的温度条件下改进后的工艺依然能进行反应。和改进之前实施的工艺做比较分析,选用乙二醇二甲醚作为溶剂,有益于提高气-液-液反应的传质速率,削弱相间形成的阻力,故而不会对反应温度提出更严格的要求。当反应温度抵达60℃时,持续进行8h的反应,目标产物的收率能够抵达95.9%。而后反应温度持续上升,反应时间有一定拖延,产品收率基本上维持着相对稳定的状态中。考虑到成本等因素,最后拟定选择体系反应温度60℃,反应持续时间8h。
5)碘、溶剂的回收情况。本课题研究发明的SO2/I2/H2O工艺是改进 SO2/KI/H2SO4/H2O还原法。以上两种工业合成法在实施阶段均选用碘元素作为催化剂去催化诱导SO2还原成苯磺酰氯,最后合成目标产物二苯二硫醚。碘元素是一种售价较高的元素,其单独耗用量是当下国内工业领域中的一项常用的技术经济指标之一。故而本课题对碘和溶剂进行了回收处理。
具体是把回收过程所获得的溶剂 (回收率82.3%)与碘 (回收率 78.6%)均填补到100.0%,而后统一予以套用,获得了图3的反应结果[7]。
分析图3后发现,溶剂与碘均套用了10次,目标产品的收率依然能维持相对较稳定的状态中,每生产制造23.8g产品将会耗用0.9g碘。

图3 碘、溶剂对反应影响的曲线图
3 结语
本课题研究中建设了 SO2/I2/H2O反应体系,利用有机溶剂取代大量蒸馏水,反应后萃取碘并回收使用,应对了传统工艺下酸过量、碘回收难度高等问题。改进优化后的工艺条件可作出如下阐述:苯磺酰氯∶水∶碘物质的量比为20∶10∶1,反应温度60℃,时间6h,选用乙二醇二甲醚作为溶剂。优化工艺下提纯以后目标产物收率、纯度分别是95.9%、99.1%,碘、溶剂的回收率分别为78.6%、82.3%。碘、溶剂均套用10次,发现反应结果依然能维持相对稳定状态中。SO2/I2/H2O还原法具有较高的适用性,可以在工业化生产领域中尝试使用。

