小儿胃畸胎瘤1例并文献复习
蒋飞,马存文,邓成仕,沈艳梅
(1.云南省文山壮族苗族自治州人民医院放射科,云南 文山 663000;2.云南省文山壮族苗族自治州人民医院超声医学科,云南 文山 663000)
胃畸胎瘤是一种非常罕见的肿瘤,在小儿腹部肿块的诸多病因中,其所占比例很小,且其发病率占所有畸胎瘤不到1%[1-3],常发生在婴儿和儿童时期[4]。1922年,Eustermann和Sentry报道了第一例胃畸胎瘤。现对笔者单位确诊的1例胃畸胎瘤的临床表现、影像学检查、血清甲胎蛋白(AFP)、治疗和预后进行描述分析,并复习文献,以提高对该疾病的认识。
1 病例资料
患儿,男,11 d。因“发现腹部包块11 d”于2020年2月就诊于我院小儿外科,其母亲代诉该患儿足月经阴道分娩,产前未在我院产检,分娩前我院胎儿超声提示腹部囊实性包块,出生时腹部膨隆,可触及包块,能耐受母乳喂养,病程中无呕吐、呕血、血便,发育良好,心肺未见异常;怀孕期间没有接触过任何药物或辐射。
腹部体格检查显示腹部膨隆,中上腹部触及一个不规则包块,大小约10 cm×5 cm,包块边界清楚,活动度可,质韧。全腹未见胃肠型及蠕动波,无压痛、无肌紧张、无反跳痛。实验室检查示:糖类抗原125为59.8 U/ml,总白细胞数为13.03×109/L,AFP>1000 ng/ml(新生儿属正常),肝功能、肾功能检查均在正常范围内。超声检查:中上腹部探及一个囊实混合性肿块,回声混杂,来源不明(见图1)。腹部X线摄片显示:中上腹见一肿块,内隐约可见结节状钙化,肠袢被推向右侧及下方(见图2)。计算机断层扫描(CT)显示:中上腹有一个巨大的密度不均匀的分叶状肿块,有实性和囊性成分,实性区有结节状、条状钙化,向下延伸到骨盆入口,最大体积约6.4 cm×6.9 cm×9.9 cm(前后径×左右径×上下径),邻近脏器、肠袢受压移位,增强实性部分轻度强化(见图3)。
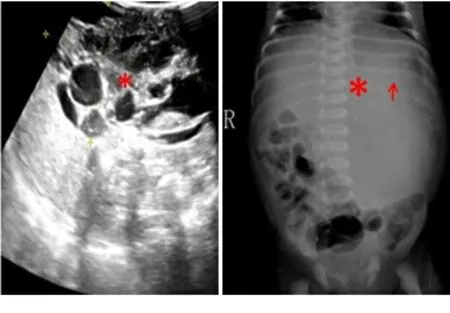
注:超声显示囊实混合性肿块(见图中*号所示),回声混杂。图1 胃畸胎瘤超声影像 注:X线摄片显示中上腹部肿块(见图中*号所示),内隐约可见钙化(见图中↑号所示),肠袢被推向右侧及下方。
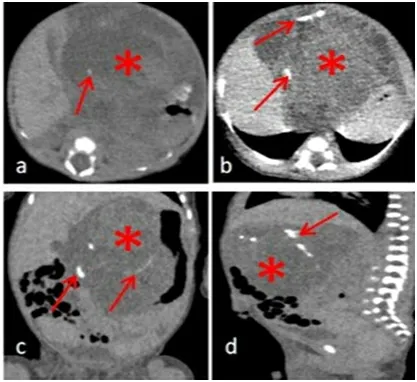
注:a:轴位平扫显示巨大囊实混合性肿块(见图中*号所示),
手术和病理检查所见:中、上腹部见不规则包块,该包块位于胃小弯侧及肝胃韧带,其基底部位于胃小弯,胃外生长,大小约10 cm×7 cm,包块质韧,囊实混合,边缘与横结肠、十二指肠及临、邻近组织粘连。镜下所见:瘤体切面囊实性,灰红色,见纤维、脂肪、软骨及表皮样组织,病理组织学检查诊断:胃未成熟畸胎瘤Ⅱ级(见图4)。术后第13天(年龄29 d)查血清AFP>1000 ng/ml,影像学检查未见残留及复发征象,无特殊不适,给予出院。术后1个多月(年龄65 d)复查血清AFP:741.5 ng/ml,影像学检查未见复发征象,小儿发育良好,大小便正常,建议继续随访复查。
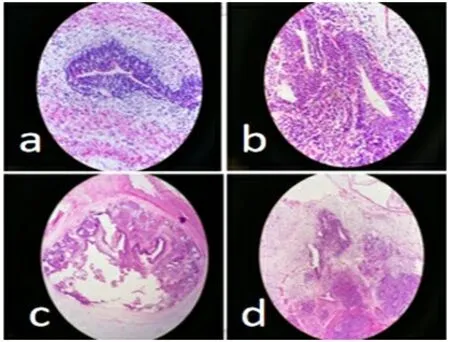
图4 胃畸胎瘤病理检查显微镜下见神经上皮纤维、脂肪、软骨及表皮样组织(a、b:×20,c、d:×4)
2 讨论
胃畸胎瘤是一种罕见的肿瘤,尤其是新生儿的胃畸胎瘤极为罕见。胃畸胎瘤好发于婴儿期和儿童期,90%的病例发生于出生后两年内[5-6],文献报道中最大的患儿8岁[7],好发于男性[5-6,8]。胃畸胎瘤的临床表现与肿物的大小、部位、有无溃疡及出血有关,早期多无症状,多表现为腹部肿块、腹部膨隆、呕吐、呕血、黑便,因肿块过大压迫膈肌上移所致的呼吸窘迫也有报道[9]。常发生于胃大弯和胃后壁,外生性生长较内生性生长常见,外生性兼内生性生长方式罕见。本例患者的肿瘤发生于胃小弯,这是相对少见的。外生性生长同大部分报道病例一致。检索的国内外文献报道中,仅发现1例[10]在早发现方面与本例相似,即产前胎儿超声检查发现了肿块,出生时就表现出腹部膨隆并触及肿块,这是极其罕见的。胃畸胎瘤多为囊实性,单纯实性或囊性少见,超声表现为回声混杂肿块,偶可见肿块与胃轮廓连接,腹部X线片表现为伴钙化的软组织肿块,胃肠道常受压。计算机断层扫描(CT)表现为巨大的、分叶状的、不均匀的囊实混合性肿块,常伴有钙化和脂肪密度,结合静脉和口服对比剂,图像后处理技术MPR有助于发现肿瘤的起源器官、与胃肠道和主要血管的关系、骨骼和钙化的存在、肿瘤的范围和是否转移。但在实际工作中,多数病例发现时由于肿瘤巨大,起源器官常难以准确诊断。本例肿块的影像学表现是典型的畸胎瘤征象,但由于肿瘤过大,且新生儿期腹部缺乏足够的脂肪,导致难以判断肿块与周围组织的关系,故术前没有准确诊断肿瘤的起源器官。
胃畸胎瘤被认为由胃内脏壁的多能细胞产生,是由内、中、外三层原始胚层演变而来的胚胎组织残留于胃部所致。根据组织学类型将畸胎瘤分为成熟性、未成熟性、恶性3类;又根据肿瘤组织的成熟程度和未成熟神经上皮的多少,将未成熟畸胎瘤分为三级,Ⅰ级属临界恶性,Ⅱ级属低度恶性,Ⅲ级属高度恶性[11]。几乎所有报道的胃畸胎瘤都是成熟和良性的,到目前为止只有2例报道转化为恶性[12]。手术切除是治疗该肿瘤的主要手段,为保证完全切除,可切除瘤外1 cm的组织,Gupta DK等[5]认为即便周围组织受侵,只要完整切除肿瘤也未见复发病例。Marina NM等[13]建议对所有性腺外未成熟畸胎瘤患者进行手术切除后密切观察,在有复发迹象之前不进行化疗,虽然这得到了大部分学者的认可,但是对完全切除的Ⅱ级和Ⅲ级未成熟畸胎瘤是否要进行辅助治疗(化疗或放疗)目前仍有争议。本例患者在术后未接受辅助治疗,随访过程中也暂未见确切复发表现。
在大部分的胃畸胎瘤病例中,肿瘤标记物甲胎蛋白(AFP)升高,术后可降至正常,但需结合年龄具体分析。本例患者术前AFP值>1000 ng/ml,术后仍>1000 ng/ml,最近一次随访是术后1个多月(年龄65 d),AFP值741.5 ng/ml。结合患者年龄,本例患者数次监测的血清AFP值在正常范围内,与绝大多数文献报道的一致[1,3,14-15]。目前,血清AFP是术后肿瘤残存和复发的监测指标,Aihole JS等[15]认为血清甲胎蛋白水平升高也可能是恶性卵黄囊成分存在的唯一警示信号。
综上,小儿胃畸胎瘤非常罕见,大多为良性,综合临床表现、特征性的影像学征象可术前诊断,确诊靠病理。目前主张手术完整切除肿瘤,且无需辅助化疗,绝大多数患者预后良好。术后应长期做影像学检查随访,且监测血清AFP变化。

